1. 引言
国外自20世纪20年代初就开始了肝癌的放疗探索,当时认为放疗对肝脏是危险的,未见报道。直至50年代,有人报道由于肝脏血流量大,肝癌放疗可以期望有效。我国从20世纪50年代开始对肝癌的放疗进行研究,并有一些成功的案例报道,但由于照射范围及照射剂量的问题使放疗的疗效不尽如人意。随着影像技术的发展,使得三维适形放疗应用于肝癌的治疗。由于可以精确定位,给予肿瘤区低分割高剂量照射,提高照射剂量,减少对正常组织的破坏,从而提高肿瘤的控制率。90年代中期之后,放疗技术逐渐成熟,为肝癌的治疗提供了新的手段。对于全身情况较好,肝功能基本正常的局限性肿瘤,部分病例可获根治。对肿瘤较大或发生转移者,有一定姑息疗效。随着影像技术的提高、放疗设备的进步、精确放疗技术的开展以及肿瘤综合治疗意识的增强,特别是介入等疗法与放疗的结合,以及肝癌放射生物学基础研究的进展,肝癌放疗得到重新认可。
2. 肝癌放射治疗的常用类型
随着对肝癌放射治疗临床经验的积累及肝脏对放射敏感性的逐步认识,人们认识到解决与放射治疗技术有关的肝脏的放射耐受量、照射野的设计与靶区高剂量照射等临床难题是提高肝癌放疗效果的关键。肝癌的放射敏感性相当于低分化鳞癌,目前主要采用外照射或内照射途径进行,据研究表明肿瘤区放射剂量达到50~60 Gy时,治疗效果可明显提高[1] 。经临床观察研究表明,3DCRT (或与肝动脉化疗栓塞(TACE)结合,3DCRT+TACE)已经成为目前取得高疗效、低损伤的有效方法[2] 。
2.1. γ刀
全身γ刀是一种填充式三维适形放疗,通过聚焦放射源60Co产生的多源、多束射线,围绕焦点(靶区)根据肿瘤深度调整高剂量点位置,也可以根据肿瘤大小采用单靶点或多靶点拟合,形成一个高峰剂量区。聚焦后射线高剂量点在肿瘤中心,其剂量强度从焦点中心向边缘逐步衰减,其结果是周边正常组织的受照范围小,受照剂量低,可采用50%剂量线为处方剂量,使靶区内剂量分布变化的梯度增大,肿瘤中心区可获得更高的剂量[3] 。γ刀其剂量强度衰减非常锐利。可以有利于对靶区外正常组织的保护。具有定位准确、治疗精确、靶剂量集中,周围正常组织受照射剂量低的特点,从而实现靶区的剂量升级,可实现大剂量的单次治疗和较大剂量的分次治疗,以提高肿瘤的局控率。是一种治疗中晚期肝癌的有效无创治疗方法[4] 。
体部伽马刀属于三维适形放疗,是精确的放射治疗,副作用少而轻微,因而治疗肝癌安全可靠。无论对小肝癌还是大肝癌均有较高的局部缓解率,早期小肝癌是y刀最好适应证。对于一些中晚期患者,能达到缓解症状、延长生存期、改善生存质量的目的。对较大的肝癌,如果肝功能正常,且病变位于肝脏边缘或向外生长,估计正常肝脏受辐射剂量较少的,可以考虑行γ刀治疗。另外,常规放疗后复发的再治疗和常规放疗追加剂量也较为安全有效,而且不良反应小,肝功损害程度轻。袁林[5] 等的研究表明:肝癌患者的细胞免疫指标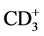 ,
,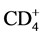 、
、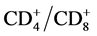 、NK等在行体部伽马刀治疗后1周后无明显改变,1个月后明显升高,提示体部伽马刀治疗后破坏的肿瘤异化组织被机体吸收可在一定程度上激活机体的免疫系统,使患者机体的细胞免疫功能逐渐增强。对癌结节较多、肿块较大、估计正常肝组织受射线照射较多的,或肝功能差、合并血小板减少者,应列为γ刀治疗禁忌证[6] 。体部伽马刀放疗的要点:1) 精确摆位,保证患者每次治疗的位置与定位CT扫描时体位一致。2) 准确勾画肿瘤廓及周围正常组织结构。3) 肝脏在膈肌下运动幅度较大,治疗范围应考虑其移动幅度及体位。4) 选适宜的时间一剂量一分割方式[7] 。
、NK等在行体部伽马刀治疗后1周后无明显改变,1个月后明显升高,提示体部伽马刀治疗后破坏的肿瘤异化组织被机体吸收可在一定程度上激活机体的免疫系统,使患者机体的细胞免疫功能逐渐增强。对癌结节较多、肿块较大、估计正常肝组织受射线照射较多的,或肝功能差、合并血小板减少者,应列为γ刀治疗禁忌证[6] 。体部伽马刀放疗的要点:1) 精确摆位,保证患者每次治疗的位置与定位CT扫描时体位一致。2) 准确勾画肿瘤廓及周围正常组织结构。3) 肝脏在膈肌下运动幅度较大,治疗范围应考虑其移动幅度及体位。4) 选适宜的时间一剂量一分割方式[7] 。
2.2. X刀
x刀是通过在直线加速器上采用三级准直系统或特殊限束装置或专用小型高能x-线机,通过非共面或共面弧形照射或多野集束技术将X射线聚集于病灶处,产生高度聚焦的剂量分布区,使肿瘤受到高剂量照射,剂量分布集中,靶区外剂量递减陡峭,靶区周边正常组织剂量小的效果[3] 。x刀治疗晚期肝癌可以延长患者生存期,也是一种较好的治疗方法。
x刀是采用圆孔状的线束旋转照射,所获得的高剂量区是球型分布,加上孔径较小,所照射的体积较小,因此,x刀在肝癌的应用应该严格选择适应证。x刀只适宜治疗早期瘤体圆而规则的肝癌和肝转移的圆型小结节。国内外近年报道认为,临床靶体积(cTV)为2~622 cm (平均78 cm),一般病灶影像学最大直径小于5 cm较为理想;或病灶较大且其他治疗措施选择困难者或;有明确手术禁忌证或拒绝手术治疗的肝癌患者也可以考虑SRT [8] 。
2.3. 立体适形放射治疗
立体适形放射治疗是近来的快速发展新的放射治疗方法,可使瘤组织更多接触照射剂量而正常组织受到照射剂量较小,所以患者容易接受,副作用小。立体适形放疗方法的靶区具有较小范围,使得靶区的轮廓更为清晰,能够准确定位肝癌。三维适形放疗使肿瘤边缘与周围正常组织剂量差别比较大,能最大限度地减少正常肝组织和其它重要器官的受照剂量,最大限度地杀死靶区肿瘤细胞[9] 。随着3-DCRT技术应用于临床,高剂量区域与临床靶区形状高度一致,降低了正常组织受照射剂量,从而提高了肿瘤的局部控制率。3-DCRT和调强适形放疗等现代放疗技术逐渐成熟,为放疗在肝癌治疗中的应用提供了新的机会。肝细胞癌恶性程度高,病情进展快、立体放射治疗对小于直径3厘米小肝癌能够得到较好的控制。而直径大于3 cm的肝细胞癌,可先常规放疗,剂量可达30GY,肿瘤体积缩小,周围得到控制再采用立体适放疗方法。3-DCRT通过改善剂量分布,提高了靶区的照射剂量,减少了周围正常组织的照射,用于原发性肝癌的治疗,可提高肿瘤局部控制率和患者生存率,延长生存期[10] 。
3. 放疗与其他方法联合应用的研究
原发性肝癌冶疗方法较多,各有优缺点及适应证。总体上,肝癌疗效并不令人满意。如何合理地综合运用各种治疗手段提高疗效是目前研究的热点,其中放疗与其他治疗方法的结合已积累了一定的经验并初见成效。
3.1. 放疗与热疗
肿瘤组织的生长特点是其血管生长畸形,结构紊乱,血管平滑肌破坏及毛细血管变形,并有血窦及畸形的毛细血管网形成。因此,肿瘤组织的血液供应比正常组织明显增多,但血液循环速度明显降低,仅为正常组织的1%~10%。而且实体肿瘤缺乏平滑肌及神经支配,对热的扩散降低,温度易在瘤体内局限性升高。而正常组织受热时,有良好的血液循环,可以充分的散热,致使肿瘤组织局部温度高于邻近组织的5%~10%,从而达到杀灭肿瘤细胞保护正常组织的目的。肝癌热疗的抗肿瘤机制主要使肝癌病灶局部温度超过癌细胞的阈值,使其凋亡坏死。并且,肿瘤组织在高热作用下出现即时性代谢异常,热量更加聚集并伴有PH值进一步降低,加剧局部组织的氧缺乏及营养缺乏,引起恶性肿瘤细胞的变性坏死,以达到对肿瘤细胞直接杀伤作用[11] 。其次热疗通过抑制血管内皮生长因子、促进血纤维蛋白溶解酶原激活抑制因子1 (PAI-1)及其产物的表达,通过抗肿瘤血管作用而抑制肿瘤生长及转移[12] 。还有研究表明热疗可以上调机体的免疫功能[13] ,抑制肿瘤的侵袭、转移[14] 。
放疗与热疗结合具有较好的生物学基础。在低pH值下,对处在乏氧和营养不良状态的放疗抗拒性肿瘤细胞有放射增敏作用,另外热疗可阻断放射损伤之修复,故对放疗具有协同作用。
3.2. 放疗与高强度聚焦超声
高强度聚焦超声是一种局部高温治疗肿瘤的新技术,发展于20世纪80年代后,它将体外低能量超声波聚焦于体内深部肿瘤病灶,利用超声波具有的组织穿透性和可聚焦性等物理特征。通过焦点区高能量超声波产生的瞬间高温效应和空化效应,使治疗区域的温度在瞬间骤升至65℃~100℃,使局部组织出现凝固坏死。我国高强度聚焦超声技术的研究与应用起步较晚,但发展很快,已具有世界领先水平[15] 。
高强度聚焦超声与放疗联合应用可以获得治疗增益。肝脏属于放射晚反应组织,具有较强的亚致死性损伤修复能力,而且放疗对乏氧细胞、S期细胞不敏感。而高强度聚焦超声对乏氧细胞的杀灭作用与足氧细胞相同,它能减小放射线的氧增强比,抑制放射损伤的修复,包括亚致死性损伤修复和潜在致死性损伤修复,对放射不敏感的S期细胞有直接杀灭和致敏作用,因此三维适形放射治疗和高强度聚焦超声有协同作用。
3.3. 放疗与肝动脉化疗栓塞
肝动脉化疗栓塞是目前非手术切除治疗原发性肝癌的首选方法,近期疗效确切,可使癌组织发生不同程度的坏死。单个药物在肝癌化疗中的全身应用多无明显疗效,多种化疗药物联合应用亦未显著提高疗效,而肝动脉局部灌注的疗效则较为肯定。术前放疗可使不可切除的肝癌缩小后变得可以切除。
肝动脉化疗栓塞是建立在如下的理论基础上:1) 正常肝组织血供25%~30%来自肝动脉,70%~75%来自门静脉,而肝癌血供95%来自肝动脉;2) 肝动脉栓塞导致肝肿瘤血供减少90%,从而缺血坏死;3) 肝内化疗药物毒副作用降低;4) 局部药物浓度可比全身浓度高达100~400倍。只要是动脉血供丰富,均需要进行肝动脉碘油栓塞化疗[16] 。但是正常肝组织的血供仍可来自门静脉,或是肝动脉即使被栓塞,但侧枝循环已形成,有时仍不能治愈肿瘤。于湧等采取在栓塞治疗2个周期后补充全身伽马刀的局部放疗,治疗所给予的肿瘤剂量达到50 Gy/10次,按照L-Q模式,有效生物剂量BED相当于常规放疗剂量的80 Gy,这是常规放疗无法达到的肿瘤根治性剂量,从而保证有效地杀死肿瘤细胞[17] 。在原发性肝癌治疗和肿瘤的局部控制上,采用TACE术后联合体部伽马刀对残余局部肿瘤病灶行根治性放疗为非手术治疗的一个有效方法,值得临床进一步的探讨和研究。
3-DCRT与TACE结合在肝癌治疗中具有明显的协同和互补作用,主要有:1) TACE治疗可使肿瘤缩小,减轻放射治疗的“瘤负荷”,使照射靶体积缩小,从而提高3-DCRT的治疗效果;2) TACE后持续滞留于肿瘤中的化学药物对放射治疗起增敏作用,同时TACE使肿瘤细胞周期同步化,有利于射线对肿瘤的杀灭作用;3) 3-DCRT可阻断门静脉供血及代偿性供血使TACE后复发明显降低;4) 对于一些少血供肿瘤而乳化碘油充盈不良者,3-DCRT可针对此部位提高肿瘤局部的控制率。谭新劲[18] ,潘汉城[19] 等试验结果3DCRT + TACE组近期治疗有效率和年生存率均显著高于TACE组,表明3DCRT + TACE介入治疗是治疗原发性肝癌较有效的方法。
4. 肝癌放疗的毒副作用及并发症
肝癌放疗的毒副作用按发生时间分为早期和晚期两种。早期毒副反应多发生在放疗期间,主要包括:1) 急性放射性肝损伤:发生于放疗过程中,表现为胆红素升高,血清谷丙转氨酶升高,可伴肝区疼痛,是较常见的治疗中并发症;2) 骨髓抑制:血小板、白细胞降低。一般经对症治疗或中止放疗一段时间都能恢复,多数病人能继续治疗;3) 消化道症状:食欲减退,恶心较为常见,极少数出现溃疡和穿孔、上消化道出血;4) 全身表现:疲倦乏力。晚期毒副反应多发生在放疗后期,有放射野内的肝萎缩、纤维化;大血管(下腔静脉)狭窄;放射性肝损伤。其中最严重的是放射性肝损伤,一般出现在放疗后1~4个月,是肝脏的一种亚急性放射损伤,能够引起肝脏功能减退,以静脉闭塞为特征,具有较高的死亡率。
梁霞[19] 等完成了236例总放射剂量为43.7~88 Gy (平均为71.3 Gy)的治疗,出现了白细胞降低,上消化道出血,放射性肝损伤等不良反应。临床医生和学者的研究表明:放疗后最严重的不良反应是高胆红素血症、低白蛋白血症、放射性肝炎和腹水,影响愈后的因素主要是门静脉癌栓、治疗后的肿瘤反应程度和急、慢性肝损伤。
经统计分析,乙型肝炎病毒携带和Child.Pugh B级肝硬化是影响肝癌患者放疗效果最重要的因素。肝癌伴乙型肝炎病毒感染者行x一刀放射治疗,发生放射性损伤者占比例较大,其中以HBsAg、HBeAg、HBcAb均为阳性的肝癌患者发生肝损伤的程度最重。放射性肝损伤的危险因子包括:大体积的正常肝组织接受高剂量照射;伴门静脉内瘤栓;放疗期间发生急性肝功能损害;最重要的因素是病人原有肝硬化的严重程度,如Child-PughB级的病人较A级更易发生放疗性肝损伤。因此必须注意以下4点:1) Child-PughB,C级是放疗的相对禁忌症;2) 对有门静脉栓塞的病人,放射剂量应更低;3) 在设计放疗计划时应尽量正常肝的放射剂量限制在安全的范围内;4) 当病人发生急性放射性肝损伤后,应降低放射总剂量或考虑终止放疗[20] 。
5. 肝癌放疗的研究进展及展望
肝癌手术切除是最有效的治疗方法,但肝癌发病隐匿,临床上大部分病人就诊时已失去手术治疗机会。非手术措施有常规放、化疗、血管栓塞、介入热疗等,效果不理想。近年来随着对肝癌的照射方法和范围的改进,由全肝照射-局部照射-全肝移动放照射一手术定位局部照射和超分割照射等,使肝癌放疗效果明显提高,副作用显著降低。但是单独的放疗在肝癌的治疗中依然存在重要缺陷,如对肿瘤新生血管的作用,放射性肝损伤的预防等[21] ,这些问题有待进一步的研究和突破。
实体肿瘤不断形成的新生血管是瘤细胞生长、侵袭和转移的基础,肿瘤血管密度高低与患者生存时间密切相关。近年来的研究表明,肝癌VEGF表达与肿瘤微血管密度有直接相关性,是无疾病进展生存率和累积生存率的独立预后因素。郑青平[22] 等的研究结果显示,血管形成能力与放射治疗肝癌疗效具有相关性。从中得到的启示是为非手术肝癌患者制定治疗方案时,可以检测其血浆VEGF含量,含量低者放疗可能收到较好效果,而含量高者放疗可能不是首要的选择,或许介入栓塞化疗等措施可以获得更大疗效。所以通过检测肝癌患者血浆VEGF水平来确定是否选择放疗作为非手术患者的首要治疗方案,具有积极临床意义。
肝癌放疗联合基因治疗的综合治疗有着良好前景。肿瘤抑制基因p53是与人类肿瘤相关性最高的抑癌基因,也是与放射敏感性关系最大的相关基因,是肿瘤基因治疗的重要靶点之一。p53基因的正常功能对肿瘤细胞的凋亡和提高放射敏感性起到了关键作用[23] 。余舒亮[24] 等研究通过建立裸鼠人肝癌移植瘤模型,观察tAd-p53 (重组人p53腺病毒)联合放疗对肝癌生长抑制的协同作用,结果显示联合治疗组裸鼠的肿瘤生长抑制率为81.49%,而肿瘤体积增加倍数明显小于对照组,说明tAd-p53与放疗联合治疗对裸鼠肝癌抑制瘤有明显的生长抑制作用且联合治疗的疗效大于tAd-p53治疗及单独放疗。tAd-p53联合放疗治疗肝癌将成为一种新的治疗手段。
近年来靶向药物在肝癌治疗中也显现能够延长患者的生存期,相信如果将放疗与靶向药物联合,会提高肝癌的疗效。随着肝脏放射生物学研究的深入、放疗设备和影像技术的发展,基础研究及靶向药物的应用,有望进一步提高肝癌的疗效,提高患者的生存质量。