1. 引言
明串珠菌(Leuconostoc)是韩国泡菜、德国泡菜和腌菜等发酵蔬菜中的优势细菌,在保持产品的质量中起着重要作用[1] 。明串珠菌是耐氧的革兰氏阳性细菌[2] ,底物通过戊糖磷酸解酮酶(Pentose PhosphoKetolase, PPK)途径而脱氢并产生能量(见图1)。
明串珠菌在食品和医药工业中具有生成双乙酰、葡聚糖、甘露醇和2, 3-丁二醇、代谢产生细菌素等应用[3] [4] 。明串珠菌是美国FDA认可的GRAS菌,也是国家卫计委认可的安全菌[5] ,不产内毒素,能分泌特异性胞外蛋白且没有蛋白降解活性,因此明串珠菌是表达异源蛋白的很好的候选菌[6] 。
产业升级转化过程中甘露醇和2, 3-丁二醇等化学品需要微生物发酵产生,从而有利于绿色和环保。还有,明串珠菌的染色体基因组只有2 Mb左右[7] ,故发酵周期短且可作为底盘生物或精简基因组而构建成优势小基因组微生物。因此,明串珠菌具有巨大的应用价值,已成为国内外学者的研究热点[8] -[15] 。
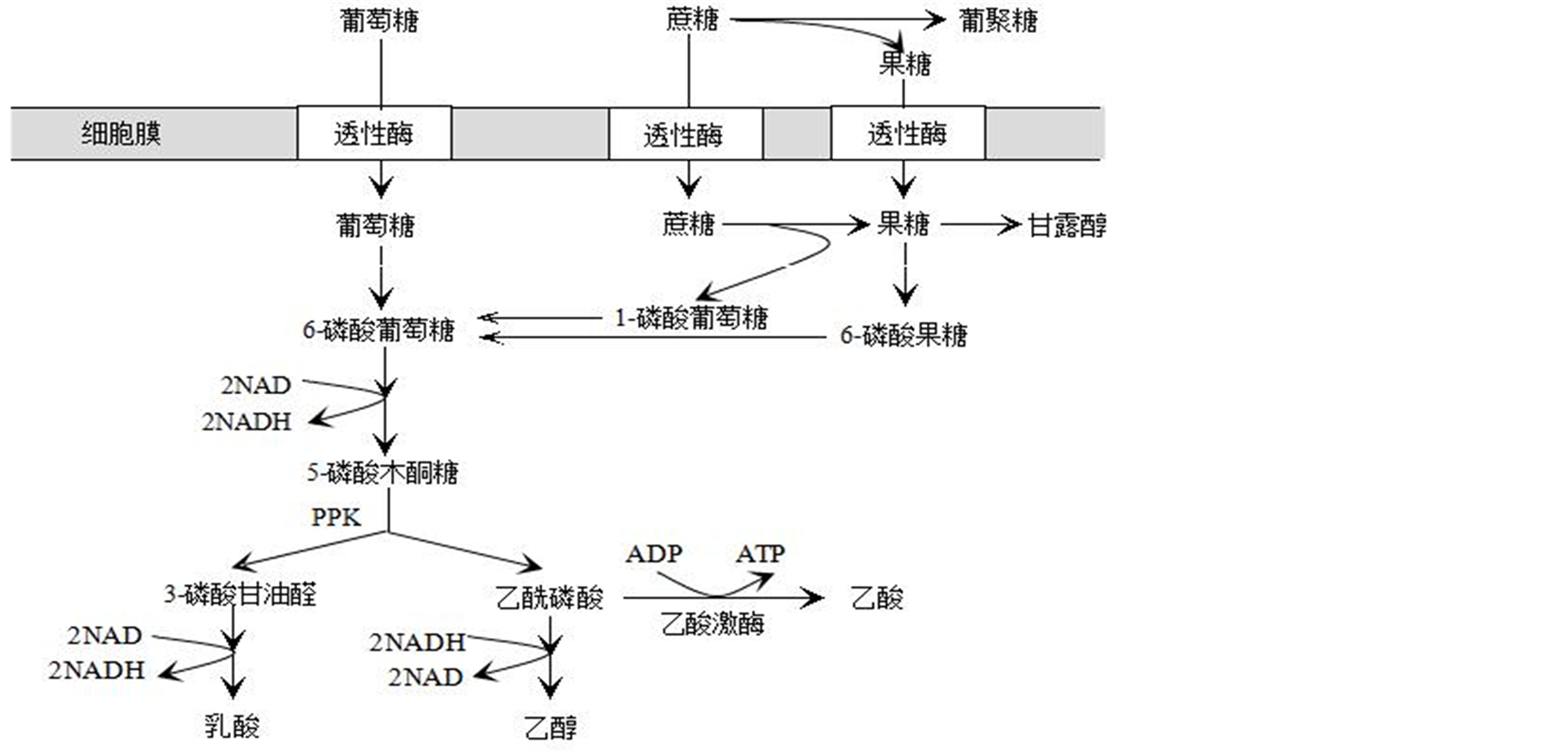
Figure 1. The main carbon metabolic pathway of L. mesenteroides
图1. 肠膜明串珠菌主要碳代谢途径
本文以乙酸激酶基因ack为目标序列,以四环素为筛选标记,构建自杀性重组质粒,转化肠膜明串珠菌,使染色体上基因失活,获得突变型菌株。通过PCR扩增和产物检测,验证基因失活体系的构建成功。
2. 材料与方法
2.1. 材料
2.1.1. 菌株与质粒
本文所用的菌株和质粒,见表1。
2.1.2. 试剂和仪器
工具酶为TaKaRa的;其它试剂为分析纯;主要仪器有DL9700型基因扩增仪、Bio-Rad Gene Pulser XcellTM电击仪、722N型可见分光光度计。
2.1.3. 培养基和培养条件
在37℃、150 r/min下用LB培养大肠杆菌;在30℃、120 r/min下用MRS[16] 培养肠膜明串珠菌。
2.2. 方法
2.2.1. DNA操作
明串珠菌基因组DNA的提取参照文献[16] ,电转化参照文献[9] 。
大肠杆菌的质粒提取参照文献[17] ,大肠杆菌的转化采用CaCl2法。
引物序列见表2,PCR扩增过程见表3。
2.2.2. ack的PCR扩增与测序
参照Leuconostoc mesenteroides subsp. mesenteroides ATCC 8293(GenBank accession number CP000414)的乙酸激酶基因(ack)序列设计引物对A1-A2,扩增ack。将扩增产物连接到pTA2-T载体上,转化大肠杆菌DH5α,送样测序。

Table 1. Bacterial strains and plasmids used in this study
表1. 实验所用的菌株和质粒

Table 2. Primers used in this study
表2. 实验所用的引物

Table 3. Steps of PCR
表3. PCR步骤
2.2.3. 同源重组载体的构建
参照质粒pBR322序列,设计引物对T1-T2,扩增四环素抗性基因表达盒,将扩增产物连接到pTA2-T上,转化大肠杆菌DH5α,提取质粒得到中间载体pTA2-Tet。根据扩增的ack序列设计引物对U1-U2,扩增ack上游片段,将扩增产物连接到pTA2-Tet的KpnI和XhoI位点上,转化DH5α,提取质粒得到pTA2-T-U;设计引物对D1-D2,扩增ack下游片段,将扩增产物连接到pTA2-T-U的PstI和XbaI位点上,转化DH5α,提取质粒得到同源重组载体pTA2-T-U-D。
2.2.4. 肠膜明串珠菌的电转化
同源重组载体pTA2-T-U-D转化肠膜明串珠菌,从平板上挑取单菌落进行液体MRS培养,用5 μg/mL四环素和5 μg/mL氨苄检验菌株的抗性。保留具有四环素抗性且对氨苄敏感的菌株,作为疑似失活菌株。
2.2.5. 突变型菌株的PCR验证
分别在ack基因上游和下游片段序列上设计引物Y1、Y2,提取疑似失活菌株的基因组DNA作为模板,通过PCR验证菌株的ack基因是否失活。
2.2.6. 发酵实验
以1%接种于MRS中,发酵24 h后参照文献[18] -[21] 检测培养基中的乙酸、乳酸、乙醇、双乙酰和甘露醇含量。
3. 结果与分析
3.1. ack基因克隆和序列同源性
约1.1 kb的PCR扩增片段连接到pTA2-T载体上,转化DH5α,获得重组子,重组质粒命名为pTA2-ack。测序分析表明长度为1112 bp,与L. mesenteroides ATCC8293的乙酸激酶基因序列比对结果:核酸序列同源性为99%,有9个碱基的差异,氨基酸序列同源性为100%。已提交到GenBank,接收号为JF837336。
3.2. 同源重组载体的构建
以质粒pBR322为模板,扩增TetR基因表达盒,获得的PCR产物长约1.2 kb,与pTA2-T载体连接,重组质粒命名为pTA2-Tet。扩增的ack上游片段为约500 bp,与pTA2-Tet连接,重组质粒命名为pTA2-T-U。扩增的ack下游片段大小约450 bp,与pTA2-T-U连接,同源重组载体命名为pTA2-T-U-D。
3.3. 疑似失活菌株的筛选
将pTA2-T-U-D经电击转化肠膜明串珠菌后,涂布于含四环素的MRS平板上,保留抗四环素而对氨苄青霉素敏感的重组子(发生二次交换的),废弃对四环素和氨苄青霉素都具有抗性的重组子(只发生一次交换的),从而获得疑似失活菌株。
3.4. 疑似失活菌株的PCR检测
为了验证疑似失活菌株染色体上的ack基因已被失活,对重组子进行了PCR检测。分别以CGMCC 1.10327(原始菌株)和疑似失活菌株的染色体DNA为模板,用相同的引物对Y1-Y2进行PCR扩增,对得到的产物进行琼脂糖凝胶电泳。疑似失活菌株的扩增产物长度比CGMCC1.10327的大1200 bp左右(图2),与预期结果一致。将该疑似失活菌株命名为Leu ack::TetR。
3.5. 种菌株的生理特性比较
为了进一步验证ack基因的失活并研究ack基因失活对肠膜明串珠菌碳代谢的影响,用MRS进行发酵24 h时并考察乙酸、乙醇、乳酸、双乙酰、甘露醇的量。
在相同条件下,CGMCC1.10327和Leu ack::TetR两种菌株的生物量基本一致。比较两者的代谢产物
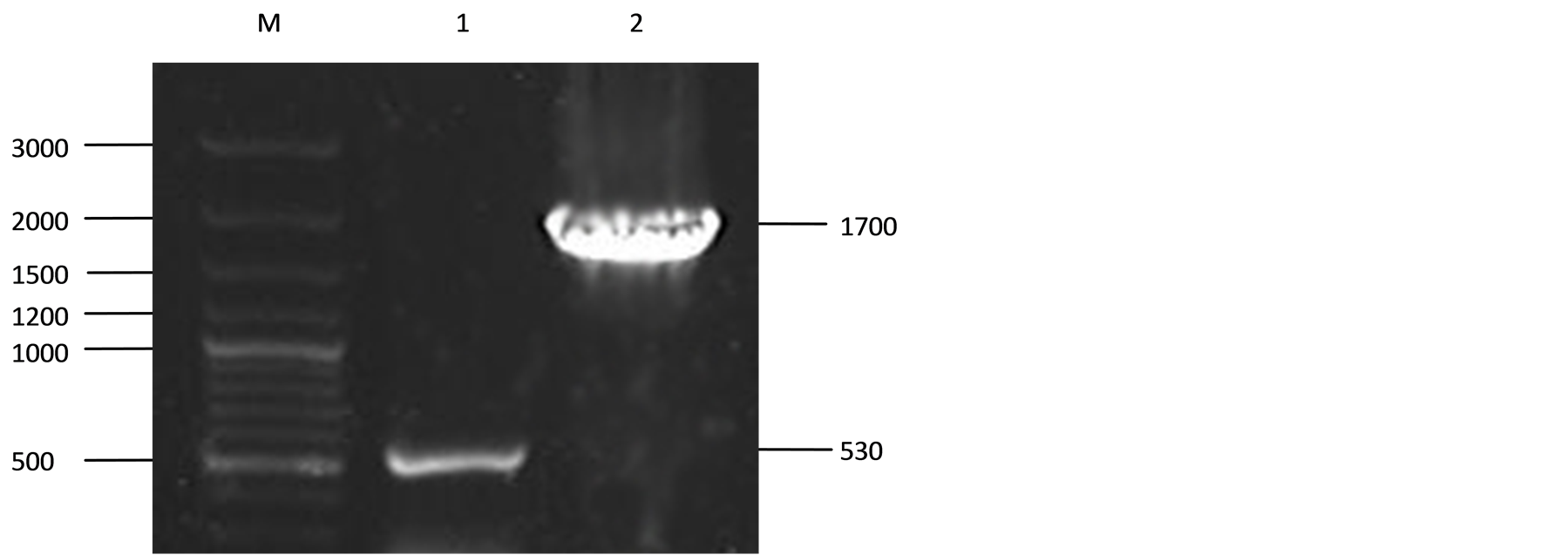
Figure 2. Characterization of defined ack inactivated mutant by PCR analysis
M: DNA marker; 1: PCR fragment of ack of CGMCC1.10327; 2: PCR fragment of ack of presumed mutant
图2. ack基因失活菌株的PCR鉴定

Table 4. Comparison of fermentation parameters of the two strains (Unit: g/L)
表4. 两菌株的发酵参数比较(单位:g/L)