1. 引言
金黄色葡萄球菌(Staphylococcus aureus)是一种重要的人类病原菌,可引起肺炎、败血症等许多严重感染[1] 。由于其高耐药性及耐甲氧西林金葡菌(MRSA)的检出率逐年上升,为争取早期治疗、及时控制感染,优化选择抗菌药物显得尤为重要[2] [3] 。
由于长期、广泛的对陆生生物资源的开发和研究,从陆生生物代谢产物中发现新菌种、新抗生素的几率越来越微弱。而在深海和深海淤泥内的微生物面临着低温、高盐、黑暗、高压和营养匮乏等各种极端的环境,也正是这样极端海洋环境的多样性和特殊性共同造就了海洋微生物种类的多样性和特殊性,人们看到了极具开发前景的微生物资源,其中包括深海真菌、细菌等等[4] [5] 。
本实验从深海淤泥中筛选能够较好的抑制金黄色葡萄球菌的海洋真菌,并对其进行鉴定,为下一步研究该真菌的抗菌物质活性,寻找可能的新的抗菌药物打下基础。
2. 材料与方法
2.1. 材料
2.1.1. 试验材料
土样样品由中国大洋生物样品馆提供。样品采集于西南印度洋DY115-20V-S12-TVG4(水深:1783 m),DY115-20V-S16-TVG6(水深:1761 m)。金黄色葡萄球菌(编号:ATCC6538),购自中国微生物菌种网。
2.1.2. 试剂与培养基
PCR试剂,购自大连宝生物公司。其他生化试剂均为分析纯。
PAD培养基和LB固体培养基用于真菌的活化和培养。
2.1.3. 仪器与设备
MT180B-生化恒温培养箱(新苗医疗器械制造公司);JA12002型-电子天平(精密科学仪器公司);超纯水装置(法国MILLIPORE);LX-100-手掌型离心机(其林贝尔仪器制造公司);MLS-3020-湿热高压灭菌器(日本SANYO);HWY111-恒温培养振荡器(智诚分析仪器制造公司);SW-OJ-2FD-洁净工作台(安泰安气技术公司)。
2.2. 实验方法
2.2.1. 真菌的分离
采用涂布平板法分离真菌菌株[6] 。取海泥样品0.5 g于试管中,加入4.5 mL 60%的海水,混匀,静置2 h,将原液按梯度依次稀释,做成5个不同的稀释浓度,取10−7至10−3稀释浓度取样100 μL滴在PAD培养基中间位置用玻璃棒涂布。接种完放在28℃培养箱中培养3~5 d,用接种针挑取形态不同的真菌菌落,在28℃培养箱中培养3~4 d。
2.2.2. 真菌的纯化
用记号笔将分离实验平板中待划线纯化的菌落编号,并相应的在划线纯化的平板上标明菌株编号。挑取菌落接种到PAD培养基上,28℃培养箱中培养3~4 d。
2.2.3. 对峙培养
将金黄色葡萄球菌培养液以0.1%的接种量加入LB培养基中,缓慢摇匀再倒平板,待凝固后接种待测菌株,37℃培养12 h后,再放入28℃培养箱内培养,每隔12小时,观察其抑菌效果。
2.2.4. 真菌发酵液的抗菌活性测定
采用琼脂扩散法测试所分离的真菌菌株发酵液对金黄色葡萄球菌的抑菌活性[7] 。
分别挑取一环具有抑菌活性的真菌菌株接种到100 mL PDA液体培养基中,28℃摇床培养(180 r/min) 3~4 d,将发酵液在8000 r/min、4℃条件下离心10 min,取上清,旋转蒸发浓缩20倍,将5 mL浓缩液经0.22 μm无菌微孔滤膜过滤除菌即得到粗发酵液。
将金黄色葡萄球菌培养液以0.1%的接种量加入LB培养基中,缓慢摇匀再倒平板,待凝固后,采用琼脂平板打孔法,将400 µL粗发酵液加入孔中。37℃培养24 h,观察是否对金黄色葡萄球菌的生长有抑制作用,并测量抑菌圈的直径。抗菌活性测定实验重复做3次。
2.2.5. 真菌的鉴定
1) 形态鉴定
采用点植培养法将筛选出的对金黄色葡萄球菌具有拮抗作用的真菌菌株进行群体形态鉴定,参考《真菌鉴定手册》观察菌落的形态,对菌株的菌落的大小,高度,边缘,质地,渗出物,正反面的颜色,表面纹饰等特征进行观察并记录[8] 。
采用吕氏碱性美蓝染色镜检法对菌株进行个体形态鉴定。
2) 26S rDNA鉴定
PCR扩增和检测:挑取菌落,装入50 µLTaKaRa裂解缓冲液(Code No.9164)中,变性后离心,取上清用作PCR扩增。用TaKaRa真菌鉴定PCR试剂盒(Code No.RR178),进行PCR扩增目的片段。PCR反应体系见表1。扩增产物用含EB的1%琼脂糖凝胶电泳检测。
测序:样品送至大连宝生物公司测序,以Seq Forward为引物。

Table 1. Reaction system of PCR
表1. PCR反应体系
Reverse Primer: 5′-GAGCGGATAACAATTTCACACAGG-3′, Forward Primer: 5′-CGCCAGGGTTTTCCCAGTCACGAC-3′.
序列同源性分析:将测序结果在GenBank中通过BLAST进行基因比对,获得相似度较高的序列后,与所测序列通过ClustalX进行多重序列比对,比对结果通过MEGA 6.0软件构建系统发育树。
3. 结果与分析
3.1. 真菌的分离结果
从样品DY115-20V-S12-TVG4中筛选得到45个菌落。从样品DY115-20V-S16-TVG6中筛选得到53个菌落。如图1、图2。
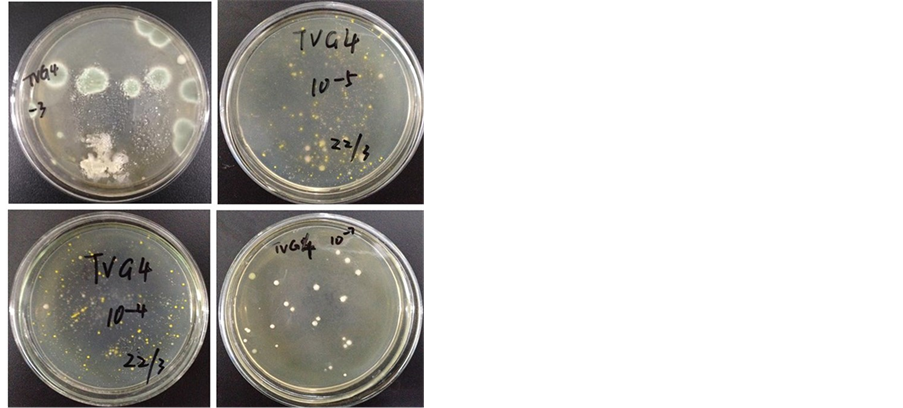
Figure 1. The colony growth from of the soil (DY115- 20 V-S12-TVG) after gradient dilution
图1. 泥样DY115-20 V-S12-TVG梯度稀释后平板上生长的菌落图
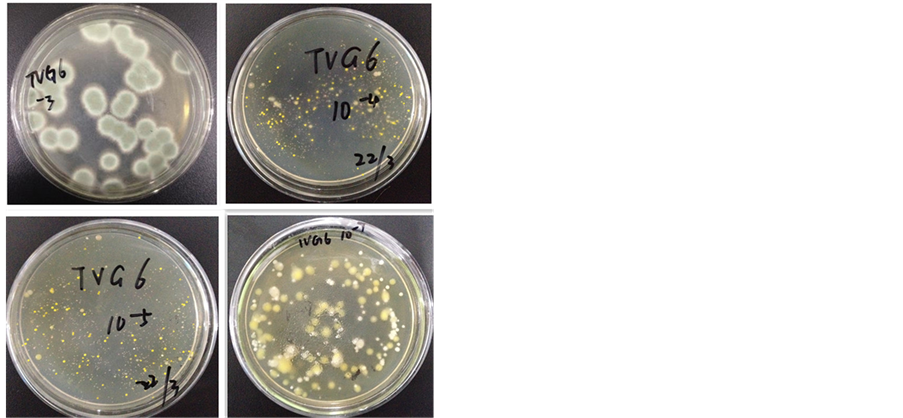
Figure 2. The colony growth from the soil (DY115-20 V-S16-TVG6) after gradient dilution
图2. 泥样DY115-20 V-S16-TVG6梯度稀释后平板上生长的菌落图
经对峙培养总共筛选出5株对金黄色葡萄球菌有抑制性的菌株,采用琼脂扩散法对5株菌株的发酵液进行复筛,最后得到1株抑制效果最佳的菌株,即1B24,其抑菌圈的直径为36 mm,如图3。
3.2. 菌株的鉴定结果
3.2.1. 形态鉴定结果
1B24在PDA培养基上呈干燥,致密,表明光滑,粉粒状,全缘,扁平,中间突起,正面深绿色,背面中间黑色周围黄色至橘色,菌落质地均匀的绒状,中央与边缘的颜色一致,边缘圆整。见图4。
光学显微观察发现菌株1B24分生孢子梗由菌丝垂直生出,分生孢子梗无横隔,光滑,子囊孢子很小,颜色较深,分生孢子呈卵圆形,呈长链状,表面光滑。如图5。
3.2.2. 菌株系统发育树的构建
将序列同NCBI基因库里面记载的所有己测定生物的Nucleotide collection比较,序列登录号为18195。根据供试真菌26S rDNA序列构建的系统发育树可以看出,1B24与标准菌株Talaromyce聚到一起,被鉴定为Talaromyces(篮状菌属) (图6)。
4. 讨论
本实验采用平板涂布法和对峙培养法对深海淤泥的泥样进行分离和纯化,从中得到98株真菌。用金
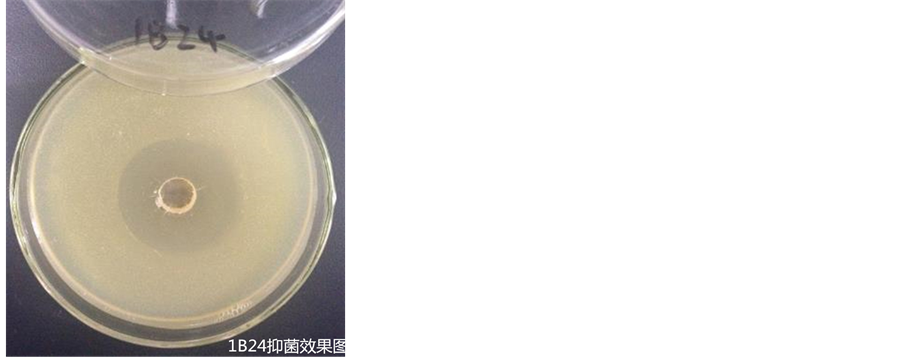
Figure 3. The bacteriostatic effect of 1B24’s fermented liquid
图3. 1B24菌株发酵液的抑菌效果图
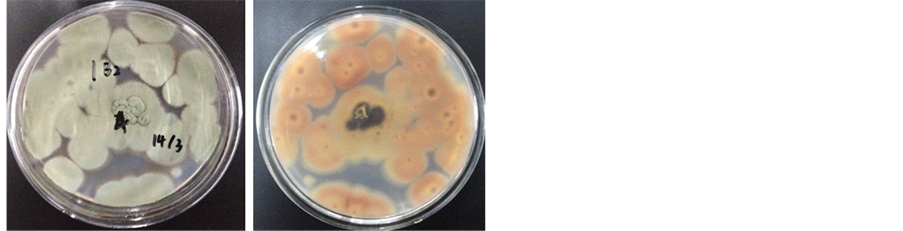
Figure 4. The colonial morphology of 1B24 (the left is positive; the right is opposite)
图4. 1B24的菌落形态(左为正;右为反)
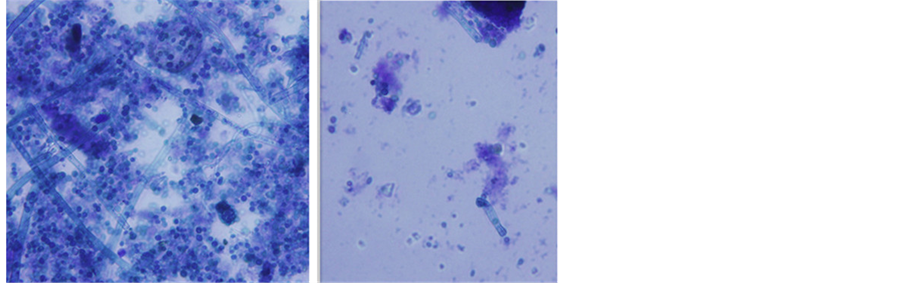
Figure 5. Microscopy figure of 1B24 (×1000 times)
图5. 1B24的镜检图(×1000倍)
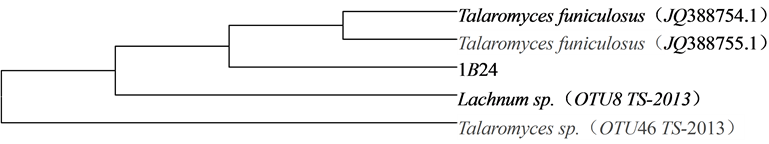
Figure 6. The phylogenetic tree of 1B24
图6. 1B24菌株系统发育树
黄色葡萄球菌作为指示菌,依照对峙培养法进行初筛,先初步选出5株对金黄色葡萄球菌具有拮抗作用的菌株。用琼脂扩散法对真菌发酵液进行筛选,筛选出对金黄色葡萄球菌抗性最强的拮抗菌,编号为1B24。对其进行群体形态鉴定、镜检,通过26S rDNA测序结果,得到的序列测序同Gen Bank数据库里所记载的已测定的生物的序列进行比较,得到同多种的篮状菌的序列相似程度达到了100%,最后确定其为篮状菌属(Talaromyces)。
下一步将分离纯化该真菌发酵液中的抗菌活性物质,并对其结构进行确定,以期寻找可能的新型抗菌药物。
基金项目
辽宁省教育厅项目(L2013510);中央高校基本科研业务费(DC110318);大连民族学院大学生创新创业训练计划资助项目(X201403066);大连民族学院“太阳鸟”项目。

NOTES
*通讯作者。