1. 引言
植物激素是植物体内合成的一系列痕量有机化合物,在极低的浓度下便可引发生理反应,几乎参与了调控植物从种子休眠、萌发、营养生长到生殖生长,以及成熟和衰老的整个生命过程[1] -[3] 。既可调控植物自身的生长发育,又通过与植物所生存的外部环境相互作用调节其对环境的适应性[4] [5] 。植物激素在植物体内含量极低(一般ng/g,甚至pg/g水平),而且与其共存的成分非常复杂[6] [7] ,此外,植物激素性质不稳定,易被光解、热解和氧化[8] ,因此,如何对微量植物激素进行简便、快速和准确的定量分析,一直是植物激素研究领域的难题之一。
目前,植物激素的测定方法主要有酶联免疫吸附法[9] 、气相色谱法[10] [11] 、液相色谱法[12] [13] 和气相色谱–质谱法[14] [15] ,上述方法存在着前处理复杂繁琐、耗费试剂多、处理过程易造成待测成分损失、检测时杂质成分干扰严重等缺点。超高效液相色谱–串联质谱具有高灵敏度和高选择性的优势,增加了定性和定量的可靠性[16] [17] 。本研究以油蒿叶为材料,建立了超高效液相色谱–串联质谱(UPLC-MS/ MS)方法测定油蒿叶片中吲哚-3-乙酸(IAA)、脱落酸(ABA)、赤霉素(GA3)和茉莉酸(JA)4种内源植物激素的检测方法。
2. 材料和方法
2.1. 植物材料
2013年6月,在宁夏盐池荒漠生态系统定位研究站采集当年生油蒿叶片,采样后立即放入液氮罐中,真空冷冻干燥,研磨成粉末,过40目筛,混匀备用。
2.2. 仪器与试剂
2.2.1. 仪器
Agilent1260超高效液相色谱仪串联AB Qtrap5500质谱仪(美国),配有电喷雾电离接口(ESI)及Analyst数据处理系统;Thermo481恒温制冷摇床(美国);Beckman Avanti J-26 XP高速离心机(美国);Organomation氮吹仪(美国);上海亿倍冷冻干燥机。
2.2.2. 试剂
盐酸、异丙醇、二氯甲烷为分析纯(北京化工厂生产);实验用水为美国Milli-Q plus超纯水机生产的超纯水;乙腈、甲醇、乙酸为色谱纯(美国Fisher公司生产);吲哚-3-乙酸、脱落酸、赤霉素和茉莉酸标准品购自Sigma公司。
2.2.3. 标准溶液的配制
分别准确称取吲哚-3-乙酸、脱落酸、赤霉素和茉莉酸标准品5 mg于10 mL容量瓶中,用甲醇定容,配制成0.5 mg·mL−1的储备液,密封储存于−20℃冰箱中。用时稀释成一系列质量浓度的标准溶液。
2.3. 试验条件
2.3.1. 色谱条件
色谱柱:Agilent SB-C18,4.6 mm × 50 mm,1.8 μm;柱温:30℃;进样体积:10 μL;流速:0.8 mL·min−1;流动相:乙腈(A),0.1%乙酸–水溶液(B);洗脱程序:0~0.5 min,90% B,0.5~5 min,90%~5% B,5~5.1 min,90% B,5.1~8 min,90% B。
2.3.2. 质谱条件
离子源:电喷雾离子源(ESI);扫描方式:负离子模式;检测方式:多反应监测(MRM);气帘气压力为30 PSi,温度为600℃,雾化器压力为40 PSi,辅助气压力50 PSi,离子化电压−4500 V。
2.4. 样品提取方法
准确称取50 mg油蒿鲜叶干粉,加入0.5 mL异丙醇/水/盐酸(体积比2:1:0.002),4℃ 100 r.p.m震荡30 min,然后加入1 mL二氯甲烷4℃震荡30 min,4℃13,000 g离心5 min,取下层溶液,氮吹仪吹干,加入0.1 mL甲醇溶液溶解样品,−20℃冰箱保存备用。
2.5. 植物激素的定性和定量测定
根据植物激素标准品的保留时间和质谱定性离子对样品中的植物激素定性,外标曲线计算植物激素的含量。每种指标的测定重复3次,实验数据用Excel软件进行分析。
3. 结果与分析
3.1. 色谱条件的优化
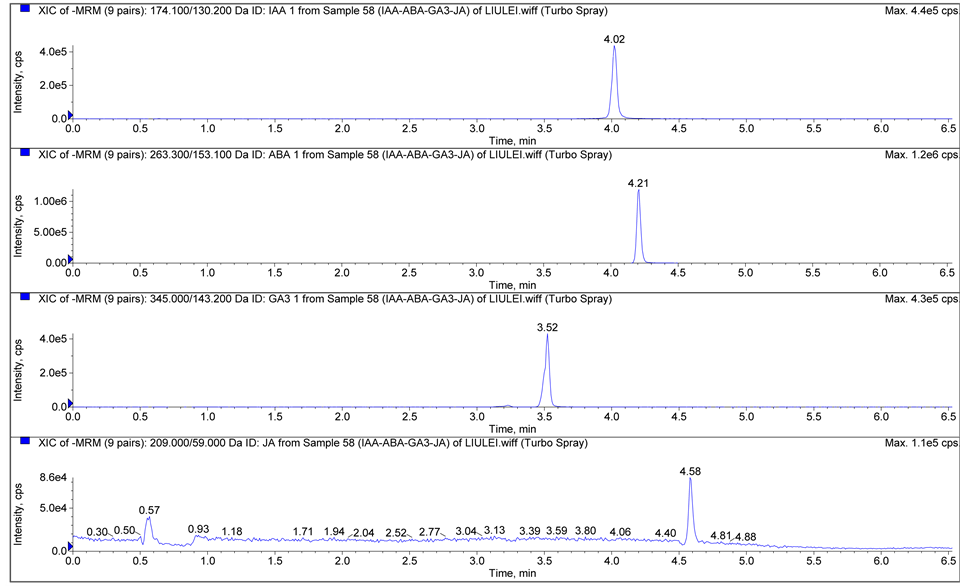
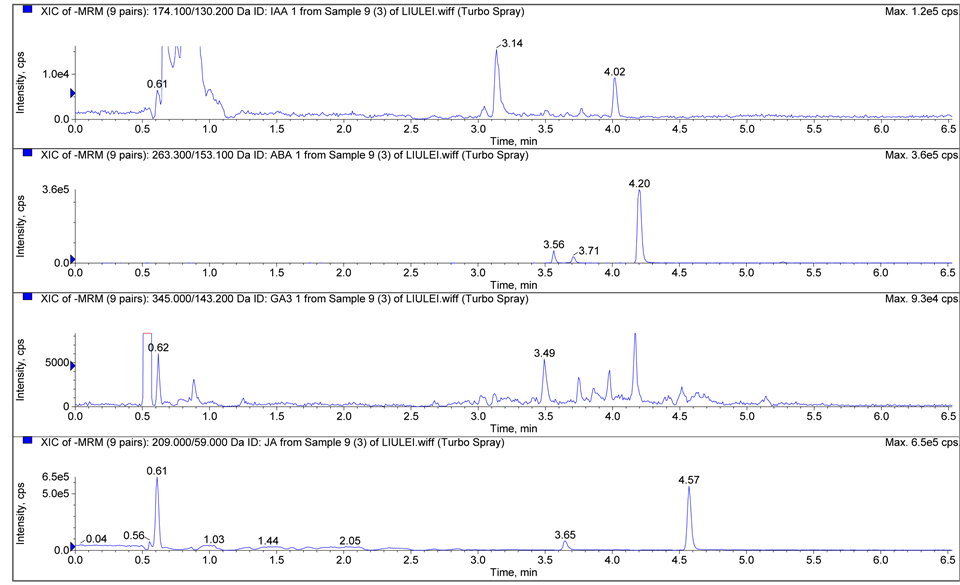
当甲醇作流动相时,离子化程度受到抑制,丰度明显降低,导致灵敏度下降,而乙腈的离子化效率明显优于甲醇,因此采用乙腈作为流动相。在流动相中加入乙酸能增加酸性植物激素在ESI−模式下的离子化效率。分别配制0.05%、0.1%、0.2%的乙酸水溶液作为流动相,试验表明0.1%的乙酸水溶液能提供最佳离子化条件,峰面积信号最强,灵敏度最高。图1为4种植物激素标准溶液(a)和沙蒿叶中植物激素(b)的MRM色谱图。
 (a)(b)
(a)(b)
Figure 1. Multiple reaction monitor (MRM) chromatogram of four phytohormones of standard solution (a) and leaves of A. ordosica (b)
图1. 4种植物激素标准溶液(a)和沙蒿叶中植物激素(b)的MRM色谱图
3.2. 质谱条件的优化
分别取10 ng·mL−1 IAA、ABA、GA3、JA标准溶液,以流动注射方式进行ESI源质谱分析。4种内源植物激素负离子信号比正离子信号明显,所以选择负离子监测模式进行检测。在此模式下,对质谱条件进行充分优化,选取经碰撞后所得丰度较高的离子作为定量离子,并确定其最佳碰撞能量、去簇电压以及碰撞池出口电压(表1)。在负离子监测模式下,各激素在Agilent SB-C18色谱柱上实现有效分离,各离子之间不会产生干扰。
3.3. 方法的线性范围和检出限
取质量浓度分别为1、5、20、50、200 ng·mL−1的IAA、ABA、GA3、JA混合标准溶液,在相同的色谱和质谱条件下测定其峰面积,以浓度为横坐标,定量离子的色谱峰面积为纵坐标得标准曲线,并求出相应的线性回归方程及相关系数。结果表明:4种内源植物激素在1~200 ng·mL−1的浓度范围内具有良好的线性关系,相关系数均在0.9989以上。按3倍信噪比计算得到样品中4种植物激素的检出限(表2),可见各植物激素线性关系良好,检出限均低于0.07 ng·mL−1,说明该方法对植物激素有很高的检测灵敏度。
3.4. 方法的精密度
在上述色质谱条件下,对10 ng·mL−1的IAA、ABA、GA3、JA混合标准溶液重复测定7次,IAA、ABA、GA3、JA峰面积相对标准偏差分别为0.92%、1.36%、1.25%、1.56%。结果表明,本法的精密度良好。
3.5. 方法的回收率
分别在已测知植物激素含量的油蒿叶样品中添加5、20、100 ng·g−1的IAA、ABA、GA3、JA混合标准溶液,按上述样品提取方法进行处理,UPLC-MS/MS进行测定,平均回收率94.0%~98.3%,回收率相对标准偏差小于4.2% (表3),说明该方法重现性良好。

Table 1. MS/MS parameters for determination of phytohormones
表1. 植物激素的质谱分析参数

Table 2. Linearity and detection limits of four phytohormones
表2. 4种植物激素的线性方程及方法检出限

Table 3. Recovery rates of four phytohormones by UPLC-MS/MS
表3. UPLC-MS/MS测定4种植物激素的回收率
3.6. 实际样品的测定
按照本文所建立的分析方法,对油蒿叶片中的植物激素含量进行测定,生长素、脱落酸、赤霉素、茉莉酸含量分别为4.74 ng·g−1、11.67 ng·g−1、3.41 ng·g−1、77.00 ng·g−1。
4. 讨论
超高效液相色谱串联质谱法测定植物激素是近年来发展起来的一种新方法[18] ,它结合了色谱对复杂样品的高分离能力和质谱的高选择性、高灵敏度的特点,大幅度地提高了检测的灵敏度[19] ,而且可以避免GC-MS分析中样品繁琐衍生化的处理过程[20] ,此外,与传统的液相色谱和气相色谱检测方法相比,色谱质谱联用可以消除色谱由于工作原理而可能导致的定性错误,保证了定性和定量结果的可靠性[21] 。能为同时测定多种植物激素提供简便,准确,快速的检测方法。
关于植物激素的提取方法,目前多采用有机溶剂浸提,固相微萃取小柱纯化后进样分析,此方法虽然具有节约溶剂,简单快速等优点。但是这种基于除杂的纯化方法往往有较大的基质效应,而且过程也较为繁琐、损失也大。而本文采用的二氯甲烷萃取后直接进样分析,可以达到理想的分离结果。
本文建立了超高效液相色谱–串联质谱法同时测定油蒿叶中多种植物激素的分析方法。该方法具有简单、灵敏度高、选择性好、分析时间短、回收率高等优点,完全适用于植物样品中植物激素含量的检测。