1. 引言
羟基(-OH)与苯环( )相连的化合物是酚,酚类为原生质毒,属高毒物质。酚类主要来自炼油、炼焦等化工废水。根据酚类能否与水蒸气一起蒸出,分为挥发酚与不挥发酚。一般认为,沸点在230℃以下为挥发酚,通常为一元酚。
)相连的化合物是酚,酚类为原生质毒,属高毒物质。酚类主要来自炼油、炼焦等化工废水。根据酚类能否与水蒸气一起蒸出,分为挥发酚与不挥发酚。一般认为,沸点在230℃以下为挥发酚,通常为一元酚。
目前水质挥发酚的分析方法普遍采用4-氨基安替比林光度法。当水样中挥发酚浓度低于0.5 mg/L时采用4-氨基安替比林萃取光度法,浓度高于0.5 mg/L时采用4-氨基安替比林直接光度法 [1] 。笔者均采用4-氨基安替比林直接光度法,并从缓冲溶液出发,探讨不同缓冲容量及用量对校准曲线的线性规律及数据的重复性的影响,并模拟实际水样进行分析,从而确定最佳的缓冲容量及用量。
2. 实验
2.1. 仪器与试剂
仪器:紫外可见分光光度计,北京普析通用仪器有限责任公司,T6;实验室pH计,上海仪电科学仪器股份有限公司,PHSJ-4A;电子天平,梅特勒–托利多仪器(上海)有限公司,ME204;超纯水器,北京同泰联科技发展有限公司,TTL-10B。
试剂:苯酚贮备液(经标定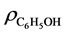 = 1.0224 g/L);苯酚工作液(苯酚贮备液稀释100倍);4-氨基安替比林(2%);铁氰化钾(8%);磷酸I (移取1.40 ml磷酸至1000 ml容量瓶中,用水稀释至标线,摇匀,测得pH = 2.010、T = 23.6℃);磷酸II (移取1.00 ml磷酸I至250 ml容量瓶中,用水稀释至标线,摇匀,测得pH = 4.176、T = 23.6℃) [2] ;氨-氯化铵缓冲溶液(I、II、III、IV,配制的浓度详见3实验结果与讨论)。所用药品均为分析纯,所用水均由超纯水器制得。
= 1.0224 g/L);苯酚工作液(苯酚贮备液稀释100倍);4-氨基安替比林(2%);铁氰化钾(8%);磷酸I (移取1.40 ml磷酸至1000 ml容量瓶中,用水稀释至标线,摇匀,测得pH = 2.010、T = 23.6℃);磷酸II (移取1.00 ml磷酸I至250 ml容量瓶中,用水稀释至标线,摇匀,测得pH = 4.176、T = 23.6℃) [2] ;氨-氯化铵缓冲溶液(I、II、III、IV,配制的浓度详见3实验结果与讨论)。所用药品均为分析纯,所用水均由超纯水器制得。
2.2. 实验原理
酚类化合物于pH (10.0 ± 0.2)介质中,在铁氰化钾存在下,与4-氨基安替比林反应,生成橙红色的吲哚安替比林染料,其水溶液在510 nm波长处有最大吸收。
显色后,在30 min内,于510 nm波长测定吸光度 [3] 。
2.3. 实验方法
实验部分均由两部分组成,一部分是校准曲线,一部分是带点测量(取苯酚工作液5.00 ml,三组平行测量),均参照4-氨基安替比林直接光度法(HJ 503-2009),带点测量应与校准曲线同时测定。
讨论的焦点主要集中在不同缓冲容量及不同用量对校准曲线的线性规律以及数据的重复性的影响,因此进行单一变量的操作。除了加入缓冲溶液这一操作有所不同,其他所有操作均与HJ 503-2009一致。
2.4. 数据处理方法
公式:偏差 ;
;
标准偏差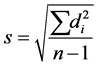 ;
;
相对标准偏差 =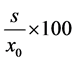 。
。
相对标准偏差 [4] 能衡量数据的分散程度,其值越大,说明分散程度越大,数据的重复性越小;反之,相对标准偏差的值越小,数据的分散程度越小,数据的重复性越大,进一步说明实验操作具有可重复性。实验部分均以校准曲线(5.00 ml, 51.120 μg)为x0,以带点测量的点为di进行相对标准偏差的计算,这样可以讨论在同一次测量当中数据的重复性。
3. 实验结果与讨论
通过表1可以看出:
1) 对比缓冲溶液I与III,二者pH相近。当用量相同时,采用缓冲溶液III,酚标准工作液的校准曲线的R2值均达到0.999以上且相对标准偏差较小,这说明采用缓冲溶液III有利于酚标准工作液的校准曲线的线性规律及数据的重复性。
从氨-氯化铵缓冲溶液中缓冲对的性质出发,氯化铵易溶于水,而氨水易挥发。缓冲对的相对浓度越高,氨水越容易挥发,即所谓“跑氨”现象越明显,pH波动也会越大,体系的显色也越不稳定,因此缓冲溶液III有利于酚标准工作液的校准曲线的线性规律及数据的重复性。这一点对比pH相近的缓冲溶液II与IV也可证明。

Table 1. Date of different buffer solution
表1. 不同缓冲溶液的数据
2) 对比缓冲溶液III与IV,当缓冲溶液用量由0.5 ml增加到2.0 ml时,采用缓冲溶液IV,酚标准工作液的校准曲线的R2值均为0.9999,而且相对标准偏差均小于2,数据稳定。由此可以得出缓冲溶液IV更适合挥发酚的实验。
对比缓冲溶液III与IV,前者氨水的浓度大,“跑氨”现象明显,pH有波动,显色效果不如后者稳定。此外,根据缓冲溶液的性质可知,当缓冲对的浓度之比等于1时缓冲能力最强,而缓冲对浓度之比越接近1缓冲能力越强 [4] ,因此采用缓冲溶液Ⅳ的校准曲线线性规律及数据的重复性好于采用缓冲溶液III。
3) 对比缓冲溶液IV的三组实验可以看出,当缓冲溶液IV用量为2.0 ml时,相对标准偏差最小,数据最稳定。可以初步得出实验的最佳条件是采用缓冲溶液IV,用量为2.0 ml。
对于缓冲溶液IV,氨水的量很少,“跑氨”现象已不明显,当缓冲溶液用量增加时,缓冲对的相对浓度也增加,缓冲能力也增强 [5] ,显色稳定。
通过以上讨论,可以初步得出实验的最佳条件是采用缓冲溶液IV,用量为2.0 ml。将这一条件应用到实际水样,讨论可行性。
4. 模拟实际水样进行实验
4.1. 实验方法
由于水样采集的时候加入磷酸酸化使之pH约为4,而且蒸馏过程中也加入磷酸使甲基橙呈橙红色(甲基橙的显色范围是:红3.1~4.4黄),因此实际水样的pH也约为4。
移取2.00 ml苯酚贮备液于烧杯中,加入少量水,加入1.20 ml磷酸溶液I,转移至200 ml容量瓶中,用水稀释至标线,摇匀,此为实际水样的苯酚工作液。测得pH = 4.152、T = 22.8℃,使用时当天配制。
依然参照HJ 503-2009,只是在操作中,用磷酸II将各比色管中溶液稀释至标线,加入2 ml缓冲溶液IV,其他操作均同于HJ 503-2009。
4.2. 实验结果与讨论
由图1可知,缓冲溶液IV用量为2.0 ml时用于模拟水样的校准曲线R2值为0.99997,线性规律好;由表2可知,数据的相对标准偏差值低,重复性好。这说明缓冲溶液IV用量为2.0 ml对于实际水样具有操作意义。
实际上,根据分布分数的公式

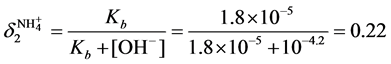

根据缓冲容量的公式
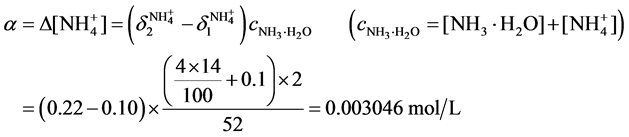

Figure 1. Calibrated curve of simulated actual water samples
图1. 模拟实际水样校准曲线

Table 2. Analytical results of simulated actual water samples
表2. 模拟实际水样带点测量结果
即如果采用缓冲溶液IV用量2.0 ml,使溶液体系的pH由10.2变化到9.8,需要加入H+的浓度为0.003046 mol/L,相对应的pH = 2.52。换言之,采用缓冲溶液IV用量2.0 ml时,为了保证体系的pH在10.0 ± 0.2范围内,水样的pH最低为2.52 [4] 。而实际水样的pH约为4,因此采用缓冲溶液IV用量2.0 ml可用于实际水样。
5. 结论
1) 通过表1的比较,缓冲溶液IV在酚标准工作液的校准曲线的线性规律及数据的重复性方面是最佳的,进一步说明采用缓冲溶液IV应用于测定水质挥发酚的实验中具有可行性而且在实际操作方面有可重复性。此外,相对于参照HJ 503-2009配制的缓冲溶液I,缓冲溶液IV在很大程度上节约了试药。
2) 通过模拟实验及讨论可以确定,缓冲溶液IV用量2.0 ml可以应用于pH大于2.52的实际水样,操作可行且数据稳定。
3) 鉴于氨-氯化铵缓冲溶液中缓冲对的性质,建议配制好缓冲溶液IV后,将其置于冰箱中保存。