1. 引言
自从1972年Fujishima和Honda报道了TiO2电极上水的光电分解 [1] ,氧化钛半导体光催化技术在光催化分解水制氢制氧、光催化降解有机污染物、光催化还原CO2以及光催化有机反应等领域的应用吸引了越来越多研究者的关注 [2] [3] [4] 。然而,由于较大的禁带宽度(Eg ≈ 3.2 eV),使得氧化钛光催化剂对太阳光的利用率不足。此外,光激发形成的电子-空穴对(e--h+)复合严重,导致其量子效率低下。通过减小氧化钛的颗粒尺寸来缩短光生载流子扩散到光催化剂表面的距离,可有效降低载流子的复合率。但纳米尺寸的氧化钛给光催化剂的分离和重复使用带来了问题。
钛铁矿是含钛的主要矿物之一,主要成分为FeTiO3,在我国储量丰富。本课题以钛铁矿为原料,提取其中的钛和铁,并以其为前驱体合成可磁分离的氧化钛复合光催化剂。磁性纳米粒子负载在氧化钛表面(TiO2@Fe3O4)的结构中,磁性粒子会覆盖住氧化钛的反应活性位,导致光催化性能降低。而且负载法制备的Fe3O4粒子过小导致磁分离性能不佳。而Fe3O4@TiO2的结构尽管能充分暴露TiO2的表面,但Fe3O4的导带低于TiO2的导带,其价带却高于TiO2的价带,因此不仅不能促进载流子的分离,反而会降低TiO2光生电子和空穴的氧化还原能力,成为光生载流子的复合中心 [5] [6] 。通过在磁核与氧化钛之间引入一层惰性的氧化硅可保持氧化钛中光生载流子的氧化还原性能,同时又可在酸性环境中保护磁核 [6] [7] [8] [9] 。
基于由钛铁矿提取的钛源为固体氧化钛,难以对磁核进行包裹。因此我们以其作为原料固相合成层状钛酸盐,并通过软化学剥离途径制备二维氧化钛纳米片胶体(titania nanosheets, TNSs),随后通过絮凝法合成Fe3O4@SiO2@TNSs复合催化剂。二维TNSs结构作为光催化剂具有如下优势 [10] - [15] :大的比表面积可以提供更多的活性位点;构成原子位于表面或近表面,因此光生载流子扩散到表面的路程极短,从而有效地降低了光生电子-空穴对的复合率;TNSs表面带负电荷,可与带正电的客体物种结合而形成不同的复合材料,且稳定性好。然而较大的带宽使得TNSs仅能吸收紫外光,从而限制了其对太阳光的利用。
H2O2作为光催化中的助剂,可捕获导带上的光生电子,有效降低光生电子与空穴的复合率。与此同时,H2O2在捕获电子后形成具有强氧化能力的羟基自由基(•OH) [16] [17] 。此外,在H2O2的作用下,氧化钛表面可修饰-OOH基团,其颜色也从白色转变为黄色,从而实现可见光响应 [18] [19] [20] 。我们以有机染料罗丹明B(RhB)作为模型污染物,以可见光以及太阳光为光源,考察复合材料的光催化活性以及回收重复使用性能。
2. 实验
2.1. 由钛铁矿分离TiO2和Fe2O3
钛铁矿的提取采用盐酸法 [21] ,具体过程如下:称取10 g钛铁矿原料于100 mL NaOH (2 mol∙L−1)溶液中,加热煮沸15 min,静置冷却后通过离心分离得到固体。重复以上步骤,所得固体用去离子水反复洗涤至近中性,得到去除Al2O3和SiO2的钛铁矿。称取2.0 g除去杂质的黑色固体于250 mL圆底烧瓶中,通过漏斗加入50 mL浓盐酸(固液比1:25)。在80℃下回流搅拌8 h,得到棕色浑浊悬浮体系。加水稀释至250 mL后得到黄色溶液,离心分离出未溶出的矿渣。通过称量矿渣的质量,计算溶出率。将所得黄色上清液加入一定量的EDTA-2Na络合铁离子,然后用氨水将溶液pH调至~1。并在110℃水解1 h,得到黄色悬浮液。离心分离,所得固体经过稀盐酸、去离子水多次洗涤后得到白色偏钛酸,经过400℃煅烧2 h后得到TiO2粉体。离心所得上清液经氨水调节pH至10后产生棕色沉淀,经过滤、洗涤、烘干、400℃煅烧2小时后得到Fe2O3样品。
2.2. 合成磁性复合光催化剂
我们以提取得到的TiO2为原料,固相法制备层状钛酸盐。质子化后的钛酸盐通过乙胺的软化学剥离得到二维TNSs溶胶。Fe3O4磁核的合成采用乙二醇溶剂热法 [22] 。为保护磁核在酸性条件下不被溶解以及在磁核与氧化钛之间引入惰性层,采用正硅酸乙酯为硅源,在磁核外包裹一层SiO2。最后通过絮凝工艺将TNSs包裹在Fe3O4@SiO2外,形成可磁分离的Fe3O4@SiO2@TNSs复合光催化剂。以磁核含量最优(质量百分比为10%)的可磁分离复合光催化剂Fe3O4@SiO2@TNSs为例:将0.05 g Fe3O4@SiO2置于20 mL去离子水中超声分散10 min。然后加入113 mL TNSs溶胶(4 g∙L−1),继续超声10 min。分散完全后,通过滴液漏斗滴加0.1 mol∙L−1盐酸溶液,出现棕黑色的絮状沉淀。继续滴加,直至沉淀不再产生。沉淀经10,000转离心、去离子水洗涤至中性、60℃干燥24 h得到Fe3O4@SiO2@TNSs复合物。按照Fe3O4@SiO2在复合物中的质量含量,所得样品分别标记为Fe3O4@SiO2@TNSs-5%、Fe3O4@SiO2@TNSs-10%和Fe3O4@SiO2@TNSs-20%。
我们以德固赛P25氧化钛和Fe3O4负载的氮掺杂纳米氧化钛(Fe3O4/N-TiO2)作为对比光催化剂。Fe3O4/N-TiO2的合成如下:N-TiO2根据文献报道的固相离子交换法制备 [23] 。Fe3O4的负载通过共沉淀方法实现。
2.3. 表征
样品的结构及组成通过X射线衍射(XRD, DX-2700X)测试获得,加速电压和电流分别为35 kV和25 A。复合光催化剂中铁含量通过重铬酸钾-无汞法测定。样品的形貌通过扫描电子显微镜(SEM, FEI Quanta 250 FEG)观察获得。能谱(EDX)与元素分布图在Oxford公司X射线能谱仪上收集数据。样品的孔结构参数通过液氮温度氮气吸附/脱附技术(ASAP2020物理吸附仪)进行表征。磁化曲线在综合物性测量系统(PPMS, Quantum Design Model-9)上采集。
2.4. 光催化性能测试
光源采用太阳光和可见光两种,其中可见光以300 W氙灯(HSX-F300, Beijing NBet)为光源,用滤波片滤去420 nm以下紫外光。准确称取100 mg催化剂加入到100 mL 1.0 × 10−5 mol∙L−1 (可见光为光源)或2.0 × 10−5 mol∙L−1 (太阳光为光源)的RhB溶液中。在开始光照之前,通过30分钟的剧烈搅拌来建立光催化剂与染料分子之间的吸附/解吸平衡。随后在吸附解吸平衡后,在搅拌下按0.1 mol∙L−1加入H2O2。光照开始后,每隔一定的时间段取样,通过外磁场分离催化剂颗粒。所得清液采用Shimadzu UV-2450分光光度计来测试吸收光谱。并通过计算最大吸收波长处吸光度变化(A/A0)来得到染料浓度的变化(C/C0),从而评估材料的光催化降解效率。
3. 结果与讨论
3.1. 由钛铁矿提取TiO2和Fe2O3
采用盐酸提取法,钛铁矿的溶出率为~97%。提取所得氧化钛和氧化铁的收率分别为~53%和~80%。图1为所得氧化钛和氧化铁的XRD图谱。所得衍射峰均可指认为锐钛矿TiO2 (JCPDS No. 21-1272)和赤铁矿α-Fe2O3 (JCPDS No. 80-2377)的特征衍射。没有其它衍射峰出现,表明所得产物纯度较高,没有杂质。
3.2. TNSs的制备与表征
图2(a)为质子化层状钛酸盐LPT的XRD图谱。所有的衍射峰都可以指认为纤铁矿型层状钛酸盐相 [24] ,尖锐的(020)衍射峰表明了其有序排列的层状结构。插图为LPT的结构模型,TiO6八面体通过共边连接形成二维平面层,板层带负电,层与层之间通过层间质子形成三维层状结构。经过乙胺的软化学剥离后,得到稳定的TNSs胶体(图2(b)插图)。图2(b)为TNSs的TEM照片。由图可知,TNSs表现出典型类似石墨烯的二维纳米结构,具有超薄的厚度和亚微米到数微米的横向尺寸。此外,众多褶皱的出现表明TNSs具有出色的柔性,这为构筑包裹磁核的结构提供了可能。
3.3. Fe3O4@SiO2@TNSs复合材料的表征
复合材料中的铁含量通过重铬酸钾-无汞滴定法测得,Fe3O4@SiO2@TNSs-5%、Fe3O4@SiO2@TNSs-10%和Fe3O4@SiO2@TNSs-20%样品经三次平行实验所得Fe3O4平均含量分别为5.22%、9.35%和18.33%,与实际投料比例相近,表明几乎所有原料Fe3O4@SiO2和TNSs都进入了复合物。
图3为各种材料的XRD图谱。Fe3O4样品具有立方相Fe3O4 (JCPDS No.75-0033)的特征衍射峰。包裹了氧化硅层的Fe3O4@SiO2样品除了衍射峰强度有所减弱外,保留了立方相Fe3O4的主要特征衍射峰,表明SiO2层的包裹对磁核没有影响。除此之外,Fe3O4@SiO2样品在2θ = 20˚位置处的宽峰对应无定型氧化硅的衍射,这证明了氧化硅层的成功包裹。在Fe3O4@SiO2@TNSs样品中,立方相Fe3O4的特征衍射峰依然可以看到,同样表明TNSs包裹对磁核没有影响。其衍射峰强度较弱这与Fe3O4@SiO2在复合物里的低含量相关(重量百分比10%)。与Fe3O4和Fe3O4@SiO2样品相比,Fe3O4@SiO2@TNSs样品中还有两个弱的衍射峰,分别对应TNSs重新堆垛的层间(020)和层内的(200)衍射。与LPT中尖锐的(020)衍射相比,复合物中的较弱的(020)衍射表明其无规则的片层堆叠以及较小的厚度。而代表层内衍射的(200)峰的出现说明TNSs的二维结构被完整保留。
我们通过扫描电镜对Fe3O4@SiO2@TNSs样品的表面形貌进行了观察,结果如图4(a),图4(b)所示。在低倍照片中,复合催化剂表现出无规则的形貌特征。而在高倍的照片中,我们发现这种无规形貌是由柔性的TNSs二维纳米片堆积而成,其表面负载了一些数百纳米大小的微球。这些微球为没有被TNSs包裹的Fe3O4@SiO2粒子。EDX能谱(图4(c))表明复合材料中存在Ti、O、Fe、Si、C等元素,其中C主要来自于合成过程中使用的有机物。图4(d)~(h)显示了Ti、O、Fe、Si四种元素在复合物中的分布情况。由图可知,代表不同元素的亮点在整个区域中分布均匀,表明磁核和TNSs在复合光催化剂中的分布均

Figure 1. XRD patterns of TiO2 and Fe2O3
图1. 由钛铁矿提取的氧化钛、氧化铁的XRD图谱
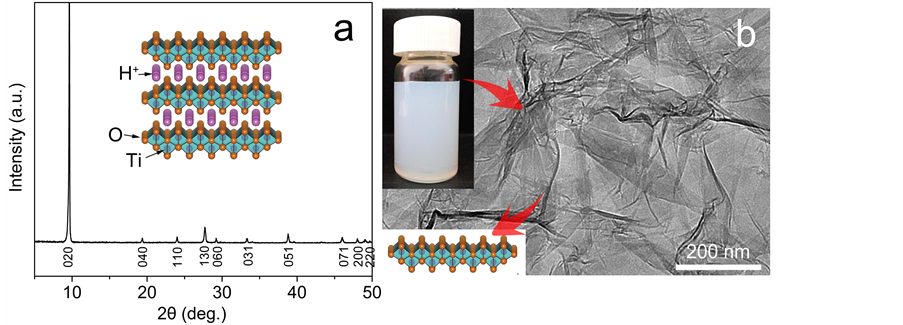
Figure 2. (a) XRD pattern and crystal structure of LPT; (b) TEM image, photograph and structure of TNSs
图2. (a) LPT的XRD图谱及其结构示意图;(b) TNSs的TEM照片,插图为其胶体悬浮液和结构示意图
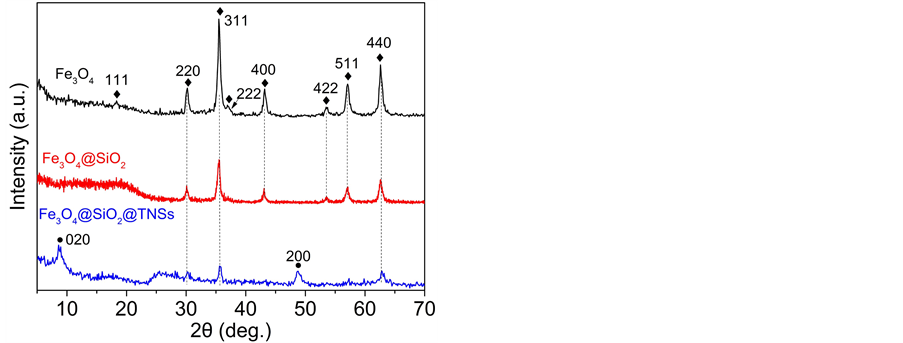
Figure 3. XRD patterns of Fe3O4, Fe3O4@SiO2 and Fe3O4@SiO2@TNSs
图3. 样品Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2@TNSs的XRD图谱
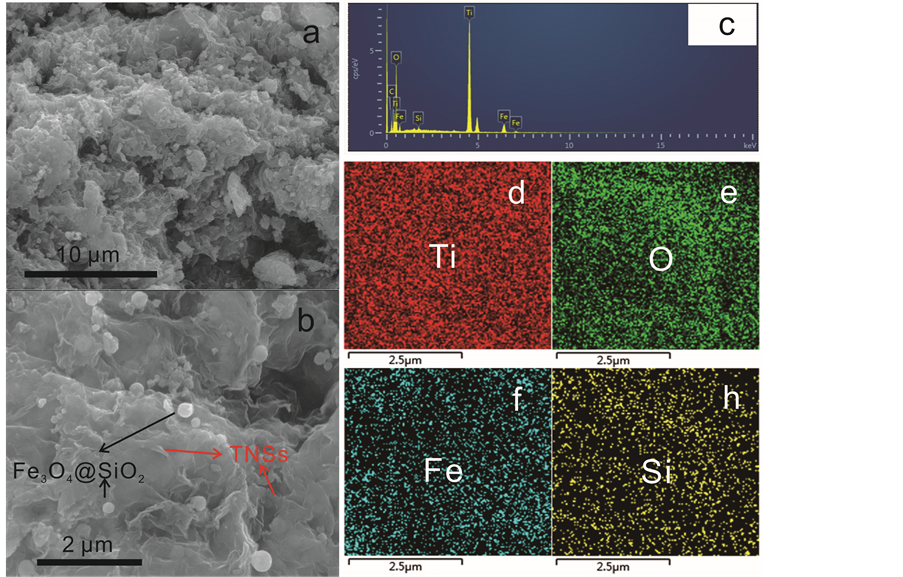
Figure 4. (a, b) SEM images, (c) EDX and (d-h) element mapping of Fe3O4@SiO2@TNSs-10%
图4. 样品Fe3O4@SiO2@TNSs-10%的(a,b)SEM照片、(c)EDX谱和(d-h)元素分布图
匀。此外,磁核的均匀分布与SEM照片中少数磁核负载于表面形成对比,这说明大部分的磁核位于TNSs内部,成功地形成了包裹结构。
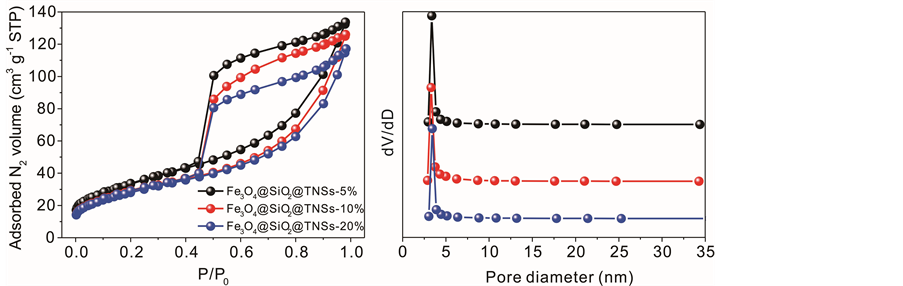
图5为样品的氮气吸附/脱附等温线及相应的孔径分布图。所有的样品均呈现IV类等温线,表明具有介孔结构。H3型回滞环代表其介孔为片状粒子堆积形成的狭缝孔。孔径分布(图6(b))同样说明介孔结构的存在,孔径主要分布在2~20 nm。表1为该三种催化剂的孔结构参数。样品的BET比表面积和孔容随着磁核含量的提高而减小,这表明材料的孔道结构主要来自于二维柔性TNSs的堆垛。然而,当磁核含量为20%时催化剂仍具有高达~100 m2∙g−1的比表面积和0.18的cm3∙g−1孔容。Fe3O4@SiO2@TNSs复合光催化剂高的比表面积为光催化反应提供了大量的反应活性位点,发达的介孔孔道促进了反应物和产物在催化剂体系中的快速扩散,因此,Fe3O4@SiO2@TNSs复合材料是一种极具潜力的可磁分离光催化剂。
图6为复合催化剂Fe3O4@SiO2@TNSs(磁核含量10%)的磁化曲线。样品的磁化率随着外磁场强度的增大迅速达到饱和,其饱和磁化强度(Ms)约为6 emu∙g−1。磁化曲线清楚地表明该材料不存在磁滞现象,这是典型的铁磁物质在小于临界尺寸时所表现出来的超顺磁性。插图为复合催化剂的磁分离性能。由于表面存在大量的亲水基团,催化剂可在水中实现高度分散。在外加磁场作用下,几乎所有的Fe3O4@SiO2@TNSs都被吸到磁铁一侧,表明催化剂具有优异的可磁分离性能。
3.4. Fe3O4@SiO2@TNSs复合材料的光催化性能研究
3.4.1. 可见光催化活性
图7(a)为RhB溶液(1.0 × 10−5 mol∙L−1)在Fe3O4@SiO2@TNSs (磁核含量为10%)复合材料和过氧化氢存在下随可见光照的吸收谱变化。由图可知,经过30分钟的暗吸附,染料在材料表面的吸附基本达到了平衡。光照开始后,RhB在554 nm处的吸收峰随着光照时间的延长迅速降低,10分钟后此处的吸收几
 (a)(b)
(a)(b)
Figure 5. (a) N2 sorption isotherms and (b) pore size distribution of Fe3O4@SiO2@TNSs samples
图5. Fe3O4@SiO2@TNSs样品的(a)氮气吸附/脱附等温线及(b)孔径分布图

Figure 6. Magnetization curve of Fe3O4@SiO2@TNSs-10% (the inset is the photograph of sample dispersed in water and magnetically separated by a magnet)
图6. Fe3O4@SiO2@TNSs-10%的磁化曲线(插图为光催化剂在水中的分散性和可磁分离性能)

Table 1. Pore parameters of Fe3O4@SiO2@TNSs samples
表1. Fe3O4@SiO2@TNSs样品的孔结构参数
乎消失,溶液也几乎为无色(图7(a)插图)。这一结果表明了在H2O2的辅助下Fe3O4@SiO2@TNSs有着非常优异的光催化性能。
图7(b)比较了不同条件下可见光降解RhB的性能。RhB是一个非常稳定的杂环碱性染料,经30分钟可见光照射后自降解率不到7%。加入H2O2后,30分钟光照也仅降解约14%的RhB。在单独Fe3O4@SiO2@TNSs存在下,只有30%的RhB被光催化降解脱除。由于TNSs的带宽较大,仅能吸收紫外光,因此纯复合催化剂在可见光照射下获得RhB降解率是由染料敏化作用引起的。相反,当加入一定量的H2O2后,Fe3O4@SiO2@TNSs则表现出优异的光催化性能。在开始光照的五分钟里,大于80%的染料被快速降解,而在光照10分钟后,几乎所有染料被完全降解。为更好地理解光催化过程,我们采用一级动力学方程ln(C0/C) = kt对催化反应进行了动力学研究,其中C0、C、k、t分别为吸附平衡后RhB溶液的浓度、溶
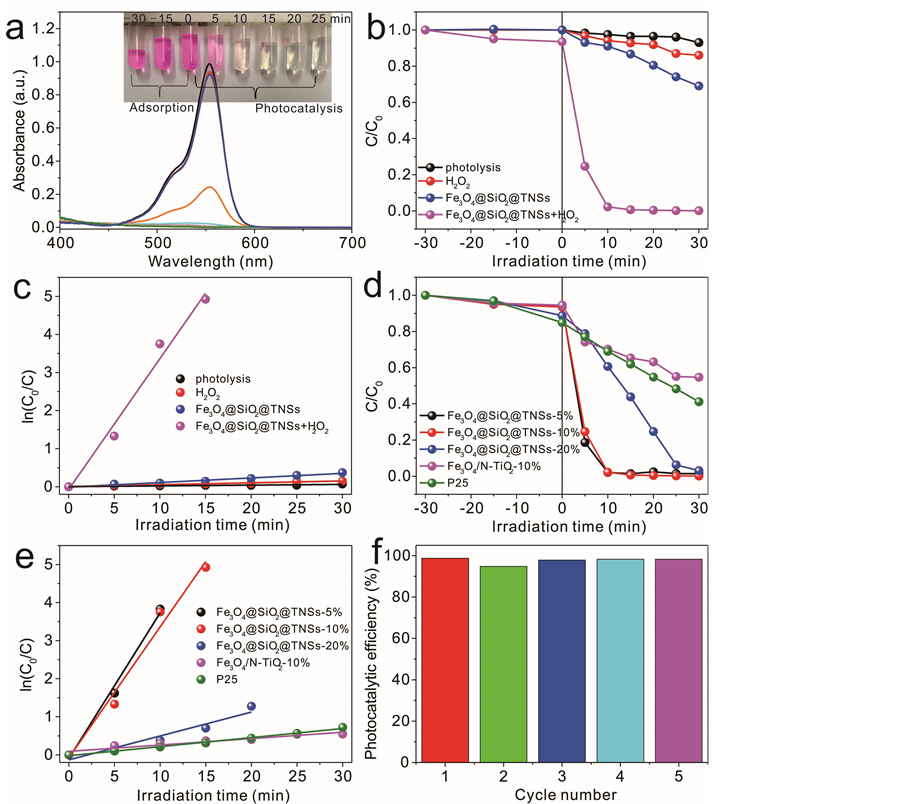
Figure 7. The photocatalytic performance for degrading RhB (1.0 × 10−5 mol∙L−1) under visible light (λ > 420 nm). (a) The change of absorption spectra of RhB solution by Fe3O4@SiO2@TNSs (the inset is the color change of RhB solution); (b) Photodegradation performance; c) Pseduo-first-order kinetics fitting under various conditions; (d) Photodegradation performance and (e) pseduo-first-order kinetics fitting by different catalysts; (f) The reusability of Fe3O4@SiO2@TNSs-10%
图7. 可见光(λ > 420 nm)催化降解RhB (1.0 × 10−5 mol∙L−1)性能。(a) Fe3O4@SiO2@TNSs光催化降解RhB,溶液吸收光谱随时间变化,插图为溶液颜色的变化;(b) 不同实验条件下Fe3O4@SiO2@TNSs光催化降解RhB性能比较及(c)相应的一阶动力学拟合;(d)不同催化剂光降解性能比较及(e)相应的一阶动力学拟合;(f) Fe3O4@SiO2@TNSs-10%的重复使用性能
液在光照时的浓度、速率常数和光照时间。拟合后的数据如图7(c)所示,所有拟合的曲线都近似为过原点的一条直线,表明光催化降解RhB过程符合一阶动力学。自降解、单独H2O2、单独Fe3O4@SiO2@TNSs以及Fe3O4@SiO2@TNSs和H H2O2共存条件下的一级动力学速率常数分别为1.95 × 10−3、4.91 × 10−3、1.21 × 10−2和3.44 × 10−1 min−1。
我们研究了Fe3O4@SiO2含量对光催化性能的影响。如图7(d)所示,Fe3O4@SiO2含量为5%和10%时,复合材料具有类似优异的光催化活性。当Fe3O4@SiO2含量提高至20%时,材料的光催化活性显著降低。这一结果是由光催化活性组分TNSs在复合物Fe3O4@SiO2@TNSs-20%中的含量降低所导致。然而,由于Fe3O4@SiO2@TNSs-5%样品中磁核的含量过低,部分TNSs并没有包裹在磁核上。这导致光催化反应结束后,催化剂不能完全通过磁分离回收。因此,我们选择Fe3O4@SiO2@TNSs-10%作为最优催化剂。
此外,我们对Fe3O4@SiO2@TNSs样品在H2O2辅助下的光催化性能与德固赛P25氧化钛(无磁分离性能)以及自制的共沉淀法Fe3O4负载氮参杂纳米氧化钛(Fe3O4/N-TiO2,负载量10%)进行了比较。如图所示,以未负载磁性粒子的P25作为催化剂,经30分钟可见光照射后,RhB的去除率约为60%。而以磁性纳米粒子负载的N-TiO2作为催化剂,RhB在半小时内的去除率仅为30%,其活性远远低于未负载磁性纳米粒子的N-TiO2纳米颗粒 [23] 。这是由于磁性粒子的负载掩盖了N-TiO2表面的催化活性位点,从而使其光催化活性大大降低。经一级动力学拟合(图7(e)),P25和Fe3O4/N-TiO2的速率常数分别为2.38 × 10−2和1.67 × 10−2,仅为Fe3O4@SiO2@TNSs-10%的6.9%和4.9%。
为考察复合材料的重复使用性能,我们对材料进行了磁分离回收再利用。图7(f)为最优Fe3O4@SiO2@TNSs催化剂的循环性能。如图所示,复合材料表现出极佳的稳定性,第五次循环依然可以降解超过98%的RhB。
3.4.2. 太阳光催化活性
考虑到实际应用,我们以太阳光为光源考察了Fe3O4@SiO2@TNSs催化剂的光催化活性。由于1.0 × 10−5 mol∙L−1的RhB溶液降解速率太快,我们采用2.0 × 10−5 mol∙L−1的RhB溶液。如图8(a)所示,经30分钟太阳光照射后染料溶液几乎为无色。吸收曲线在554 nm处的吸收也在15分钟后几乎消失,表明该

Figure 8. The photocatalytic performance for degrading RhB (2.0 × 10−5 mol∙L−1) under solar light. (a) The change of absorption spectra of RhB solution by Fe3O4@SiO2@TNSs (the inset is the color change of RhB solution); (b) Photodegradation performance and (c) Pseduo-first-order kinetics fitting by different catalysts; (d) The reusability of Fe3O4@SiO2@TNSs-10%
图8. 太阳光催化降解RhB (2.0 × 10−5 mol∙L−1)性能。(a) RhB溶液吸收光谱随时间变化,插图为光照前后溶液颜色的变化;(b) 不同催化剂降解性能比较及(c) 相应的一阶动力学拟合;(f) Fe3O4@SiO2@TNSs-10%的重复使用性
复合催化剂可高效利用太阳光催化降解有机染料。图8(b)比较了不同磁核含量催化剂的光催化性能。空白实验(无催化剂)中30分钟后染料降解了~40%,这主要来自于太阳光谱中的紫外光促进H2O2分解形成强氧化性的羟基自由基。三种不同磁核含量的复合材料光催化性能与可见光类似,5%和10%复合材料的活性要远远高于20%的复合材料。Fe3O4@SiO2@TNSs-10%样品在5分钟内就降解了~90%的染料,15分钟后几乎完全降解。一级动力学拟合结果见图8(c),空白实验、Fe3O4@SiO2@TNSs-5%、Fe3O4@SiO2@TNSs-10%、Fe3O4@SiO2@TNSs-20%的速率常数k分别为1.88 × 10−2、3.36 × 10−1、2.47 × 10−1、2.35 × 10−2 min−1。循环重复实验(图8(d))同样表明,Fe3O4@SiO2@TNSs催化剂在太阳光照下具有优异的稳定性,在第五次循环中仍可完全降解RhB。
4. 总结
我们以钛铁矿为起始物质,通过盐酸浸出法提取了其中的氧化钛和氧化铁,并以其为原料合成了可磁分离的Fe3O4@SiO2@TNSs复合光催化剂。催化剂在过氧化氢辅助下,表现出优异的可见活性,无论在可见光还是太阳光照射下都可高效光催化降解有机污染物,其性能远远优于商品氧化钛P25和氮掺杂氧化钛。此外,催化剂在外磁场作用下实现快速回收,并表现出极佳的稳定性和循环性。因此,Fe3O4@SiO2@TNSs有望成为具有优良可见光催化活性和重复使用性,并可磁分离的高效光催化剂,应用于实际有机污染物的氧化降解。
基金项目
浙江理工大学大学生科研创新计划项目。