1. 引言
壳聚糖(chitosan, CTS)是生物界中唯一大量存在的天然碱性多糖,无毒无味、可生物降解、生物相容性好、成本较低,具有优良的分散性、保湿性、成膜性、抗菌性等诸多优点,在医药、纺织和食品等领域有着广泛的应用。用壳聚糖进行涂膜保鲜 [1] [2] ,其膜层具有通透性、阻水性,可以对各种气体分子增加穿透阻力,形成了一种微气调环境,是果蔬组织内的二氧化碳含量增加,氧气含量降低,抑制了果蔬的呼吸代谢和水分散失,减缓果蔬组织和结构衰老,从而有效地延长果蔬的采后寿命。单一膜对水果有一定的保鲜作用,但壳聚糖膜自身有一些缺点如成膜保湿性,机械去强度等性能差,抑菌范围窄等,通过添加一定的功能改良剂,能够改善这些缺点,开发可食用保鲜剂 [3] [4] [5] [6] 。例如:李满林 [7] 采用一锅法将氨基硫脲接入壳聚糖结构得其衍生物,对细菌有一定的抑菌活性,但低于原料壳聚糖,抑菌性不足;又如,羧基化壳聚糖 [8] 具有良好的物理化学及生物学性质,但壳聚糖羧基化反应过程存在壳聚糖降解、取代基种类较少、产物取代度偏低等现象。
L-半胱氨酸(L-cystine)是一种具有生理功能且在自然界广泛存在的重要物质。在动植物体内能够起到防御有害物质和增加活力的作用,也是组成蛋白质的20多种氨基酸中唯一具有活性巯基(-SH)的氨基酸,广泛应用于食品、药物和化妆品中 [9] ;L-半胱氨酸上的还原性-SH使其能够抑制水果的酶促褐变现象 [10] [11] ,此外,还具有一定的抑菌作用,其类SOD活性也最高,对大肠杆菌、金黄色葡萄球菌都有很强抑菌作用。但由于L-cys为氨基酸类小分子物质,其水溶液涂在水果表面不能形成保护膜,无法直接做保鲜剂使用;改性L-cys对金黄色葡萄球菌和大肠杆菌均有抑制作用 [9] ,因此,本文通过化学修饰法,制备可用于水果保鲜的改性壳聚糖(CTS-cys),并考查其相关性能 [12] [13] [14] 。
2. 实验部分
2.1. 材料
2.1.1. 主要仪器与试剂
傅里叶变换红外光谱仪(Perkin-Elmer240Q,美国PE公司)、紫外可见分光光度计(U-3900,日本日立公司)、冷冻干燥机(LCT-10C,北京四环科学仪器厂有限公司)、超净工作台(SW-CJ-2F,苏净集团苏州安泰空气技术有限公司)、恒温培养箱(SPX250B-2,上海福玛实验设备有限公司)、手提式压力蒸汽灭菌器(XFS-280B,浙江新丰医疗器械有限公司)。
CTS,L-cys,1-乙基-(3-二甲氨基丙基)碳二亚胺盐酸盐(EDAC),氯化钠,氢氧化钠,碘,碘化钾,硫代硫酸钠:均为分析纯试剂(AR),购自于上海阿拉丁生化科技股份有限公司。可溶性淀粉,营养琼脂:均为食品级,成都市科龙化工试剂厂生产。
2.1.2. 测试菌株
革兰氏阴性大肠杆菌,革兰氏阳性金黄色葡萄球菌,蜡样芽孢杆菌:均由广东药科大学食品学院微生物实验室提供。
2.2. CTS-cys的合成
将CTS溶于0.1%HCl溶液配成1.0% (W/V)壳聚糖溶液,EDAC经室温平衡后,按摩尔比1:1.2 (CTS: EDAC)直接粉末加入,室温下活化45分钟 [15] ;再以质量比为2:1 (CTS:L-cys)将称量好的L-cys溶解后缓慢加入,并充分搅拌;室温下反应3小时后,得到粗产物,将粗产物倒入大量乙醇中,抽滤,得到沉淀产物并装入已验漏的透析袋中。用1 mM HCl (pH = 4)溶液透析1次,后用含1% NaCl的1 mM HCl溶液透析1次,再用含0.5% NaCl的1 mM HCl溶液透析1次,透析间隔24 h,透析环境最好为低温且避光。透析好的样品分瓶装好并进行冷冻干燥,得到新鲜CTS-cys于4℃保存备用。
2.3. 测试与表征
2.3.1. 傅里叶变换红外光谱(FTIR)分析
分别配制质量分数均为1.000%的L-cys、CTS和CTS-cys水溶液,各取适量涂膜于玻璃片上,待冷风吹干后在玻璃片上成膜,用镊子小心撕下透明的薄膜,以空气为参比进行背景扫描,用FTIR对待测样品进行红外光谱测定。
2.3.2. 紫外-可见光光谱分析
分别取适量L-cys、CTS和CTS-cys制备成质量分数为0.001%的水溶液,以超纯水为参比建立基线,在200~800 nm波长下进行扫描,观察衍生物的最大吸收峰位置,获取结构中相关基团的信息。
2.3.3. 巯基含量的测定
采用直接碘量法 [16] ,利用-SH和I2的氧化还原反应,可用于测定巯基含量。称取适量CTS-cys,以3:1000的比例溶解于超纯水。用1M HCl调节pH = 2~3范围内,后加入2~5滴1%淀粉溶液。用1 mM碘溶液滴定至溶液变为亮蓝色且30 s内不褪色。按公式(1-1)计算巯基含量。
 (1-1)
(1-1)
式中:n(-SH)为聚合物中巯基的含量(μmol/g);C(I2)为碘溶液浓度(mol/L);V(I2)碘液的体积(mL);m(CTS-cys)为壳聚糖半胱氨酸衍生物的质量(g)。
2.4. CTS-cys的防褐变实验
配制质量分数为1.000%的CTS-cys、CTS水溶液。双蒸水作为空白对照液,分别处理鲜切的苹果块(新产),定期观察其对于鲜切苹果块的防褐变效果。
2.5. CTS-cys的抑菌实验
采用抑菌圈法评价CTS-cys的抑菌效果。将CTS-cys溶于无菌水配制成浓度为0.2%,0.5%,1%,1.5%溶液备用,将大肠杆菌、金黄色葡萄球菌、芽孢杆菌菌种划线接种到平板,37℃恒温培养24 h。将样品液和固体培养基消毒数小时,同时将钳下的抑菌环进行消毒,进行完以上操作后,在操作台内将抑菌环浸泡在样品液中,待一段时间后,将抑菌环移至装有细菌的培养基上,每个浓度一个抑菌环,加上一个空白抑菌环做对照,再置于37℃恒温箱中培养24 h后记录抑菌环半径,L-cys和CTS样品采用上述方法同时进行实验。抑菌率按式(1-2)计算。
 (1-2)
(1-2)
式中:RI为抑菌率;D为对照菌落直径;d为处理菌落的直径。
2.6. CTS-cys对鲜切水果中Vc含量的影响
用不同浓度的改性壳聚糖保鲜剂(CTS-cys)对冬枣、苹果进行保鲜实验。采用碘量法 [17] 测定其果肉维生素C含量的变化。
3. 结果与分析
3.1. CTS-cys的结构
3.1.1. 红外光谱分析
如图1所示,壳聚糖谱图高波数段3680~2950 cm−1为羟基的缔合峰,同时与氨基的伸缩振动峰交盖,这是由于分子中存在着羟基之间以及羟基与氨基之间的氢键缔合所致;在壳聚糖改性后,这部分的缔合峰明显变窄。在1024 cm−1处的醇羟基C-O伸缩振动吸收峰强度变强,说明-OH上发生了反应,再结合1726 cm−1处出现了C = O特征吸收峰,且强度明显增强,可能是反应过程中生成了一定酯类。在1631 cm−1处有较强的酰胺I吸收峰,在1517 cm−1处有酰胺II峰的峰位,表明衍生物中可能形成了酰胺键(-NHCO-)。而在2490 cm−1处有一小峰,是-SH的特征吸收峰,综上推测,壳聚糖上的氨基和L-半胱氨酸上的羧基发生反应,并以酰胺键的形式结合,同时使L-cys上的巯基接到CTS上。
3.1.2. 紫外光谱分析
从图2可以看出:壳聚糖、L-半胱氨酸的吸收光谱相似,在200~400 nm波长范围内有明显吸收峰,说明壳聚糖与L-半胱氨酸有类似的发色基团。壳聚糖在210 nm有最大吸收峰,是壳聚糖的最大吸收波长,在309 nm也有一个吸收峰。L-半胱氨酸的在210 nm有-COOH基团的最大吸收峰,同时还有助色团-NH2。CTS-cys有两个吸收峰,说明只有两个发色基团。酯基的最大吸收波长的最大值为210 nm,而CTS-cys的最大吸收波长在209 nm,该处可能为酰胺基的最大吸收。表明壳聚糖与L-半胱氨酸之间发生了化学反应,并可以推测是壳聚糖上的氨基与L-半胱氨酸的羧基形成了酰胺键,与红外光谱推测的结果相一致。
3.2. CTS-cys的巯基含量
在反应物、反应时间、反应条件和后处理相同的前提下,以标定后浓度为0.001 mol/L的碘溶液滴定称量后质量相近的5组样品(a~e)。结果显示(见图3),各组测定结果相近,巯基含量都在325 μmol/g水平上下浮动。含量范围为316.27 ± 6.70到332.10 ± 3.06 μmol/g ( , n = 3)。
, n = 3)。
3.3. CTS-cys对鲜切苹果块的防褐变实验
不同溶液对鲜切苹果块的防褐变效果如图4,用CTS-cys溶液处理的鲜切苹果块,4~5天时未出现明

Figure 1. IR spectra of CTS and CTS-cys
图1. CTS和CTS-cys红外光谱

Figure 2. UV spectra of CTS, L-cys and CTS-cys
图2. CTS,L-cys及CTS-cys紫外光谱

Figure 3. The thiol content of lyophilized samples of chitosan cysteine derivatives
图3. 壳聚糖半胱氨酸衍生物冻干样品的巯基含量
显的褐变,而用CTS溶液或双蒸水处理的苹果块褐变明显。
3.4. CTS-cys,L-cys,CTS的抑菌效果
3.4.1. 对大肠杆菌的抑菌效果
由图5可以看出,L-cys和CTS-cys对大肠杆菌都有很好的抑菌效果,在测试浓度范围内,均能达到很高抑菌效果;CTS对大肠杆菌的抑菌能力最弱。由抑菌率曲线图4可知,L-cys和CTS-cys的抑菌率曲线趋势相同,都随浓度增大而上升,最高抑菌率可达到100%和89%。L-cys对大肠杆菌的抑菌效果最好,w(L-cys)为0.5%可达最佳抑菌效果,但在浓度为0.2%时抑菌率较低。CTS-cys在w(CTS-cys)为1.5%时可达最佳抑菌效果,在0.2%低浓度时,抑菌率比L-cys和CTS要高。而CTS的最高抑菌率只有49.36%,远低于L-cys和CTS-cys,抑菌率随浓度增大而增大,但增加幅度较小。相对于前期的工作中,通过化学
 (a)双蒸水溶液 (b) 1%CTS水溶液 (c) 1%CTS-cys水溶液
(a)双蒸水溶液 (b) 1%CTS水溶液 (c) 1%CTS-cys水溶液
Figure 4. Effects of different solution on anti-browning of fresh-cut apple pieces
图4. 不同溶液对鲜切苹果块的防褐变效果
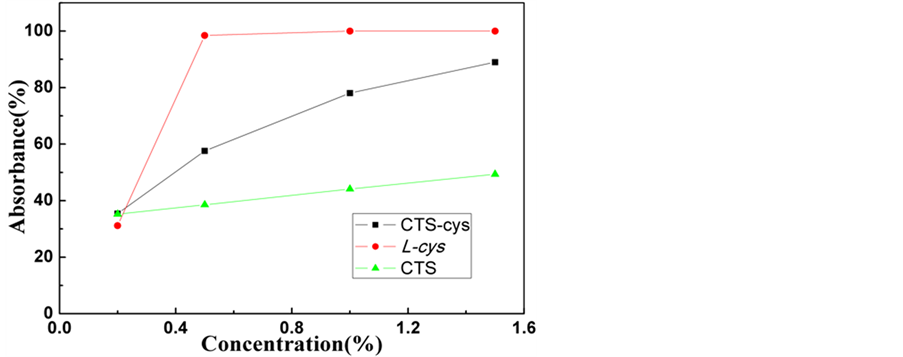
Figure 5. The inhibition rate curve of CTS, L-cys and CTS-cys against Escherichia coli
图5. CTS、L-cys和CTS-cys对大肠杆菌的抑菌率曲线图
改性法制得的可食用果蔬保鲜剂SA-cys [18] ,对大肠杆菌的抑菌效果要弱些。
3.4.2. 对金黄色葡萄球菌的抑菌效果
如图6,L-cys对金黄色葡萄球菌的抑菌效果很好,在测试浓度范围内均为完全抑菌,w(L-cys)为0.2%即可达最佳抑菌效果;而CTS-cys对金黄色葡萄球菌的抑菌效果相对较弱,最高抑菌率在w(CTS-cys)为1.5%达92.86,在w(CTS-cys)为1.0%可达较高的抑菌效果,与SA-cys相比,CTS-cys对金黄色葡萄球菌的抑菌效果要好些;CTS的抑菌率呈缓慢上升趋势,但最高抑菌率只达51.23%,仅为L-cys抑菌效果的一半。
3.4.3. 对蜡样芽孢杆菌的抑菌效果
由图7可以看出:L-cys,CTS-cys,CTS对蜡样芽孢杆菌均有一定的抑制效果,其抑菌率随浓度增大而升高,但变化不明显,且效果较之对大肠杆菌和金黄色葡萄球菌的抑制效果均降低,相对而言,L-cys

Figure 6. The inhibition rate curve of CTS, L-cys and CTS-cys against Staphylococcus aureus
图6. CTS、L-cys和CTS-cys对金黄色葡萄球菌的抑菌率曲线图

Figure 7. The inhibition rate curve of CTS, L-cys and CTS-cys against Bacillus cereus
图7. CTS、L-cys和CTS-cys对蜡样芽胞杆菌的抑菌率曲线图
的抑菌效果较好,最高可达81.22%;CTS-cys较L-cys要弱些,最高可达60.50%,而CTS的抑菌率为44.05%,仅为L-cys的一半。且CTS-cys的抑菌效果远不如SA-cys的好。
3.5. CTS-cys对鲜切水果中Vc含量的影响
用浓度为1.0~1.5%wt CTS-cys保鲜剂对冬枣进行涂膜保鲜处理,贮藏四天后测得其Vc含量为324.51 mg/100g,Vc含量下降了13.89%,空白组Vc含量下降34.77%。
用与上述同浓度的CTS-cys保鲜剂对苹果进行涂膜保鲜处理,贮藏四天后测得其Vc含量为2.25 mg/100g,Vc含量下降了43.75%,空白组Vc含量下降53.75%。
4. 结论
1) 通过化学改性法制备的CTS-cys分子结构中含有CTS和L-cys的特征基团,引入了-SH,其含量最高可达335.16 μmol/g。
2) CTS-cys具有良好的抑菌性,对3种菌株的抑菌效果从大到小为金黄色葡萄球菌,大肠杆菌,蜡样芽孢杆菌。对金黄色葡萄球菌和大肠杆菌的最高抑菌率分别为92.86%和89.00%;而对蜡样芽孢杆菌的抑菌率仅为60.50%。综合分析各试样的抑菌效果,质量分数为1.0%~1.5%的CTS-cys水溶液最适宜作为鲜切苹果块的保鲜剂。
3) 巯基化壳聚糖引入亲水基团-SH后,形成的涂膜较致密,透氧能力降低,使果蔬处于稀氧环境中;另一方面-SH具有还原性,从而使果蔬中的酚类被氧化成醌的机率降低。在微酸性条件下,-SH还可增强壳聚糖的杀菌能力,从而减少果蔬的腐烂变质现象。
4) 水果中含有的维生素C,具有一定的还原性,易被空气中的氧气氧化,通过在水果表面涂布保鲜剂,形成致密的保护膜,相对于无保护膜的水果,涂膜后减少氧气的通过量,水果处于稀氧状态,Vc更多的被保留下来,使Vc含量的减少率下降;此外,与氧气接触面积的大小对Vc含量的变化有一定的影响。
基金项目
国家级大学生创新创业训练计划项目(项目名称:绿色环保型水果蔬保鲜剂的研制;项目号:201610573008)。