1. 引言
随着纳米技术的迅速发展,工程纳米材料(ENMs)的大量生产和广泛使用势必给人类健康和生态环境带来潜在的压力 [1] [2] 。有关ENMs的环境行为与毒理效应研究已受到环境科研人员的普遍关注 [3] [4] [5] 。纳米陶瓷材料具有优良的绝缘和导电性能,被广泛应用于现代各种新兴技术中 [6] [7] 。纳米氧化锆(nZrO2)是代表性的纳米陶瓷材料 [6] 。尽我们所知,有关nZrO2的水环境行为及生态毒性研究仍十分有限。
溶解性有机质(DOM)是天然水环境中普遍存在的一类物质,它对ENMs在环境中的迁移 [8] [9] [10] 、转化 [11] 及生物有效性 [12] [13] 都有显著的影响。前人研究表明DOM可增加ENMs (例如纳米二氧化铈 [8] [14] 、纳米二氧化钛 [14] 、纳米零价铁 [10] )在水环境中的稳定性,并可减轻ENMs (例如纳米二氧化铈 [14] 、纳米二氧化钛 [14] [15] 、纳米银 [12] )对水生生物的毒性。因此,在探究nZrO2在水环境中的行为及生态毒性时,考虑DOM的影响效应是十分必要的。本研究旨在通过物化性质的表征以及以斜生栅藻为模式生物的生态毒性测试,揭示腐殖酸(HA)对nZrO2的水相行为与生态毒性的影响规律。
2. 材料与方法
2.1. 实验材料
粉体nZrO2购自德国PlasmaChem公司,纯度 > 97.2%,原始粒径为5~25 nm,比表面积为130 ± 20 m2/g。HA类似物(黄腐酸FA ≥ 90%)购自上海阿拉丁生化科技股份有限公司。本文选取的水相介质为绿藻培养液,制备方法依据国际经济合作与发展组织(OECD)制订的藻类生长抑制实验准则 [16] 。
2.2. 物化性质分析
nZrO2储备液配置于盛有高纯水的避光Pyrex玻璃瓶中,随即在超声池(25℃; 150 W, 40 kHz)连续超声30 min。使用微量进样器从储备液中量取一定体积的nZrO2悬浮液加入到正在搅拌的HA溶液中,并通过0.1 M NaOH或HCl溶液将所测试的悬浮液pH值调至7.8 ± 0.2。使用透射电镜(TEM, FEI-Tecnai G2F20, Hillsboro, OR, USA)表征nZrO2的在测试介质中的形貌。使用马尔文激光粒度仪(ZetaSizer Nano ZS90, Malvern Instruments Ltd., Worcestershire, UK)对nZrO2在测试介质中的零点电势(ZP)和水动力学直径(DH)进行表征。通过电感耦合等离子体质谱(ICP-MS, Thermo Fisher iCAP-Q, Germany)确定nZrO2溶解部分的浓度(检测限为1 μg/L)。
2.3. 生物毒性测试
斜生栅藻(Scenedesmus obliquus)购自中国科学院武汉水生生物研究所。将指数生长的绿藻重新悬浮在新鲜OECD培养基中,以获得3 × 105个细胞/mL的最终细胞密度(包括对照实验),以确保观察到的效应与暴露的测试物质相关。将含有各种浓度测试物质的锥形瓶用绿藻接种并培养96 h。在不存在或存在三种浓度的HA (1, 10和40 mg/L)的情况下,绿藻分别暴露于低(1 mg/L)和高浓度(50 mg/L)的nZrO2悬浮液中。在96 h后测定藻细胞密度,以提供细胞数并计算绿藻生长率(%)。取10 mL测试藻液(96 h),并以4500 rpm离心30 min。将沉淀物重新悬浮于1 mL磷酸盐缓冲液(pH = 7.2)中,并通过超声波破碎细胞。超声处理后,通过高速冷冻离心机(D3024, Scilogex, Rocky Hill, CT, USA)在15,000 rpm下离心15 min后除去细胞碎片,并提取上清液用于生物化学测定。使用购自南京建城生物工程研究所(中国南京)的商业试剂盒进行超氧化物歧化酶(SOD)活性的测定。
3. 结果与讨论
3.1. HA对nZrO2在水相中物化性质的影响
图1展示了在有/无HA存在时nZrO2在测试介质中的形貌特征。nZrO2颗粒呈类球状。nZrO2加入测试介质中出现较严重的聚集现象(图1(A)),而当有HA存在时,nZrO2在测试介质中的聚集现象有所减缓(图1(B))。TEM结果说明HA的存在可减小nZrO2在水相介质中的聚集性。
图2展示了在不同时刻不同浓度的HA对不同悬浮浓度的nZrO2在水相介质中表面电位的影响。由图2(A)可见,在不加HA的情况下,在测试时间内(0~96 h),1 mg/L nZrO2在测试介质中的ZP值处在−18.1与−20.4 mV之间。当有1 mg/L HA存在时,在测试时间内(0~96 h),nZrO2的ZP值处在−21.9与−23.7 mV之间;当有10 mg/L HA存在时,nZrO2的ZP值处在−22.2与−23.5 mV之间;当有40 mg/L HA存在时,nZrO2的ZP值处在−23.3与−24.5 mV之间。通过比较分析可得出,在有HA存在时1 mg/L nZrO2在测试介质中的ZP值比无HA存在时的ZP值更负。同时,随着HA浓度的增加,nZrO2的ZP值越负。
由图2(B)可见,在不加HA的情况下,在测试时间内(0~96 h),50 mg/L nZrO2在测试介质中的ZP值处在−19.0与−20.6 mV之间。当有1 mg/L HA存在时,在测试时间内(0~96 h),nZrO2的ZP值处在−23.0与−23.8 mV之间;当有10 mg/L HA存在时,nZrO2的ZP值处在−24.8与−28.2 mV之间;当有40 mg/L HA存在时,nZrO2的ZP值处在−25.9与−27.9 mV之间。通过比较分析明显可得出,在有HA存在时50 mg/L nZrO2在测试介质中的ZP值比无HA存在时的ZP值更负,且随着HA浓度的增加,nZrO2的ZP值越负。总体而言,HA的存在增加了nZrO2在测试介质中的表面电荷,且增加程度与HA的浓度有关。另外,该影响规律并不依赖于时间的延长。
在不同浓度的HA存在下,nZrO2悬浮颗粒物经96 h后的尺度变化如图3所示。由图3(A)可见,在不加HA的情况下,在测试时间内(0~96 h),1 mg/L nZrO2在测试介质中的DH值处在315与366 nm之间。当有1 mg/L HA存在时,在测试时间内(0~96 h),nZrO2的DH值处在246与260 nm之间;当有10 mg/L HA存在时,nZrO2的DH值处在237与256 nm之间;当有40 mg/L HA存在时,nZrO2的DH值处在233与245 nm之间。通过比较分析可得出,在有HA存在时1 mg/L nZrO2在测试介质中的DH值比无HA存在时的DH值要小。同时,随着HA浓度的增加,nZrO2的DH值逐渐向小尺度方向移动。由图3(B)可见,在不加HA的情况下,在测试时间内(0~96 h),50 mg/L nZrO2在测试介质中的DH值处在260与307 nm之间。当有1 mg/L HA存在时,在测试时间内(0~96 h),nZrO2的DH值处在219与238 nm之间;当有10 mg/L HA存在时,nZrO2的DH值处在217与235 nm之间;当有40 mg/L HA存在时,nZrO2的DH值处在217与233 nm之间。通过比较分析亦可得出,在有HA存在时50 mg/L nZrO2在测试介质中的DH值比无HA存在时的DH值要小,同时发现HA在不同浓度时对nZrO2的DH值影响差别较小。
总体而言,HA的存在减小了nZrO2在测试介质中的聚集尺度,也意味着HA的存在减轻了nZrO2在水相中的聚集程度,这与TEM表征结果一致。另外,该影响规律并不依赖于时间的延长。如前所述,HA以浓度依赖的方式减小了nZrO2在水相中的表面电位,说明HA提高nZrO2在水相中的分散稳定性的

Figure 1. TEM images of nZrO2 without (A) and with HA (B) in the algal culture medium
图1. 在有/无腐殖酸(HA)存在下nZrO2在绿藻培养基中的形貌

Figure 2. Effects of different concentrations of humic acid (HA, 1, 10 and 40 mg/L) on zeta potential (ZP) of 1 (A) and 50 (B) mg/L nZrO2 at different time points
图2. 在不同时刻不同浓度的腐殖酸(HA, 1, 10和40 mg/L)对1 (A)和50 (B) mg/L nZrO2零点电位(ZP)的影响
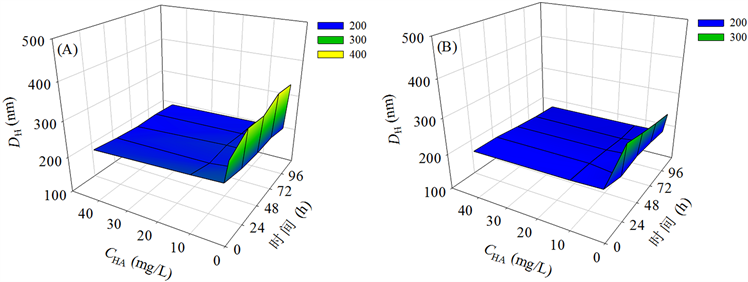
Figure 3. Effects of different concentrations of humic acid (HA, 1, 10 and 40 mg/L) on hydrodynamic diameters (DH) of 1 (A) and 50 (B) mg/L nZrO2 at different time points
图3. 在不同时刻不同浓度的腐殖酸(HA, 1, 10和40 mg/L)对1 (A)和50 (B) mg/L nZrO2水动力学直径(DH)的影响
机理为静电作用。尺度分析结果表明HA也以浓度依赖的方式明显减小了低浓度nZrO2在水相中的粒径大小,说明空间位阻效应也贡献了HA减轻颗粒物聚集性而提高其水相分散稳定性的作用机理。
3.2. HA对nZrO2斜生栅藻生长抑制毒性的影响
图4展示了在有/无HA存在下nZrO2对斜生栅藻的生长抑制毒性。如图4所示,1 mg/L nZrO2刺激了绿藻的生长,而50 mg/L nZrO2对绿藻生长抑制率达到45%,说明nZrO2对绿藻的生长抑制毒性依赖于颗粒物的浓度。ICP-MS的分析结果表明nZrO2在测试介质中的溶解部分的浓度均低于检测线(1 μg/L),说明颗粒物的溶解部分并不是nZrO2产生毒性的原因。当有1 mg/L HA存在时,nZrO2对绿藻的生长抑制率与未有HA存在时比并无显著性的差异。当有10 mg/L HA存在时,1 mg/L nZrO2对绿藻的生长抑制率明显升高,而50 mg/L nZrO2对绿藻的生长抑制率显著的降低,且处理组与单独10 mg/L HA存在时相比生长抑制率并无显著性的差异。类似于1 mg/L HA存在时的规律,当有40 mg/L HA存在时,1 mg/L nZrO2对绿藻的生长抑制率也明显升高,而50 mg/L nZrO2对绿藻的生长抑制率亦显著的降低。
整体而言,随着HA浓度的增加,1 mg/L nZrO2对绿藻的生长抑制率逐渐升高,表明HA以浓度依赖的方式提高了ZrO2对绿藻的毒性。对于50 mg/L nZrO2而言,在有10 mg/L HA存在时的颗粒物对绿藻的生长抑制程度明显要高于有40 mg/L HA存在的条件下。生长抑制毒性测试结果表明HA显著地影响了ZrO2对绿藻的毒性,且影响程度与HA和颗粒物的浓度均有关。另外,物化性质表征结果表明HA的存在可提高ZrO2在水相介质中的稳定性,但HA提高低浓度ZrO2对绿藻的生长抑制率与HA自身诱导的对绿藻的生长抑制率无显著性的差异(图4),说明ZrO2分散稳定性的提高并不是引起该毒性增加的原因。同时发现,虽然有HA的存在,高浓度的ZrO2分散稳定性也明显提高,但相对未有HA存在时,ZrO2的毒性明显降低。这可能是由于HA与ZrO2颗粒物相互作用的增加减少了绿藻细胞对颗粒物的摄取能力。ZrO2在水相介质中表面电位表征结果也证实HA浓度越高,颗粒物的表面电位就越负,而斜生栅藻细胞的表面电位小于零。因此,我们推测在有HA存在时,颗粒物与藻细胞以斥力作用为主,进而减少了细胞对颗粒物的摄取量。
为了进一步阐明HA对ZrO2毒性影响的作用机理,我们测定了SOD的活性变化。SOD可使细胞中活性氧物种(ROS)保持稳态水平,并保护细胞免受ROS的不利影响 [17] 。如图5所示,与对照相比,本文所研究的不同浓度的HA并未引起SOD活性有显著的变化,说明HA对斜生栅藻的毒性与ROS的产
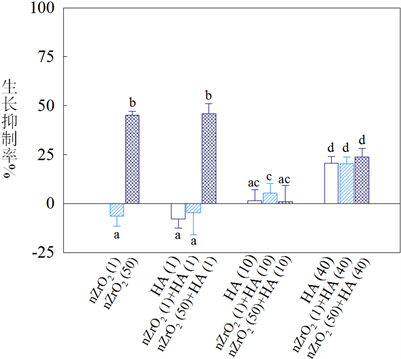
Figure 4. Algal growth inhibition rates of S. obliquus exposed to 1 and 50 mg/L nZrO2 at the concentration of 1 and 50 mg/L of suspensions, in the absence and presence of three different humic acid (HA) concentrations (1, 10, and 40 mg/L). Data within all columns in each figure with a letter in common are not significantly different at p < 0.05 level
图4. 在不同浓度的腐殖酸(HA, 1, 10和40 mg/L)存在下1和50 mg/L nZrO2对斜生栅藻的生长抑制率。相同字母代表数据间无显著性差异(显著性水平p < 0.05)

Figure 5. Activities of SOD in S. obliquus after 96 h of exposure to 1 and 50 mg/L nZrO2 at the concentration of 1 and 50 mg/L of suspensions, in the absence and presence of three different HA concentrations (1, 10, and 40 mg/L). Statistical significance versus control group: *p < 0.05 and **p < 0.001
图5. 在不同浓度的腐殖酸(HA, 1, 10, and 40 mg/L)存在下1和50 mg/L nZrO2 对斜生栅藻的SOD活性。处理组与对照组进行统计上的显著性差异比较(显著性水平*p < 0.05和**p < 0.001)
生无关。同时,生长抑制毒性测试的结果发现较高浓度(10和40 mg/L)的HA对绿藻有生长抑制作用,结合SOD的分析结果可得出HA对绿藻的毒性与其自身的遮光效应有关。此外,发现1 mg/L nZrO2对SOD活性没有显著性的影响,而50 mg/L nZrO2显著性地提高了SOD的活性(p < 0.05),说明nZrO2可通过诱导产生ROS引起绿藻细胞的氧化应激效应,进而产生了生长抑制毒性作用。当有HA存在时,1 mg/L nZrO2对SOD活性亦没有显著性的影响,这说明HA提高nZrO2的生长抑制毒性与氧化应激效应无关,只与HA自身产生的毒性作用有关。当有1 mg/L HA存在时,50 mg/L nZrO2依然显著地提高了SOD活性,而当有10和40 mg/L HA存在时,50 mg/L nZrO2对SOD活性并没有显著性的影响,说明高浓度HA的存在显著地降低了高浓度nZrO2诱导的SOD活性。这也说明HA可通过减轻高浓度nZrO2诱导的绿藻细胞氧化应激效应而降低颗粒物的细胞毒性作用。综上,HA可显著地影响nZrO2对斜生栅藻的毒性,且影响机理与HA自身的遮光效应和其可调节颗粒物诱导的氧化应激作用有关。
4. 结论
研究发现HA以浓度依赖的方式降低了nZrO2在水相介质中的表面电位。同时HA的存在降低了悬浮颗粒的水动力学直径大小。物化性质分析表明整个实验过程中HA显著地提高了nZrO2的水相稳定性。另外,HA的存在增加了低浓度的nZrO2对斜生栅藻的生长抑制毒性,而降低了高浓度的nZrO2对斜生栅藻的生长抑制毒性。HA影响nZrO2绿藻毒性的机理与HA自身的遮光效应及抑制颗粒物诱导的氧化损伤效应有关。
基金项目
本文得到国家自然科学基金(41601519; 21407080)、江苏省自然科学基金(BK20150891; BK20140987)及南京信息工程大学人才启动经费(2015r011)资助。