1. 引言
颈内动脉粥样硬化斑块所致的狭窄或闭塞是缺血性脑卒中的重要原因,现有治疗方法中血管内介入治疗是快速有效的疗法,颈动脉支架置入(Carotid artery stenting, CAS)已成为脑血管重建术的主导技术,被越来越多地用于治疗颅外段颈内动脉中重度狭窄,据报道其对于中风的防治和风险与颈动脉内膜剥脱术相当 [1] [2] 。然而CAS后并发症—支架内血栓形成一旦发生若不及时采取措施使血管再通将产生严重后果,尤其是急性支架内血栓形成(Acute in-stent thrombosis, AIST)不及时使血管再通,将导致非死即重残的结局。为了探索CAS术后并发症的防治方法,我们回顾性分析1例反复短暂性脑缺血发作(Transient ischemic attack, TIA)的患者经CAS术后AIST临床特点及治疗经过(此病例已经隐去患者姓名,不涉及隐私,且事前已经得其同意),并复习相关文献,探讨最佳治疗方法。
2. 资料与方法
2.1. 临床资料
65岁女患,因“发作性头晕伴右侧肢体麻木、乏力20天”于
2017 年 4 月 24 日
入住我科。患者入院前20天内突发发作性头晕、右侧肢体麻木、乏力,每次持续几分钟后恢复,无头痛、抽搐及意识障碍,反复发作多次,曾到某市中医院住院,查头CT显示“左侧顶枕叶区域稍低密度影”,住院治疗后仍反复发作而转我院神经内科。既往有高血压病史7年余,不规则服用降压药;有“带状疱疹”病史已治愈;否认心脏病及糖尿病病史。入院查体神清合作,BP182/104 mmHg,心肺腹及神经系统查体均无异常。入院诊断:1) TIA,2) 高血压病3级,极高危组。入院后:血常规、心肝肾功能、血糖、凝血功能均正常,血钠147 mmol/L↑(参考值135~145 mmol/L)、肌酸激酶234 U/L↑(参考值26~145U/L)、乳酸脱氢酶209 U/L↑(参考值114~162U/L)、总胆固醇7.31 mmol/L↑(参考值3.60~5.20 mmol/L)、甘油三酯5.38 mmol/L↑(参考值0.23~1.23 mmol/L)、低密度脂蛋白胆固醇 4.16 mmol/L↑(参考值2.70~3.10 mmol/L)。入院后即服阿司匹林肠溶片0.1 g/d、硫酸氢氯吡格雷片75 mg/d双联抗血小板聚集(简称双抗)及阿托伐他汀钙片10mg/d降脂稳定斑块等治疗。患者
4 月 25 日
6:30突发失语,右侧上下肢肌力0级,右侧巴氏征阳性,余神经无异常,持续约半小时后恢复正常,考虑TIA再次发作,此后连续发作TIA 3次,查头CT(图1(A))排除脑出血后加用低分子肝素钙5000 IU H bid抗凝治疗,拟行全脑血管造影术(Digital subtraction angiography, DSA)。
2.2. 方法
2.2.1. 术前准备
术前常规检查血尿便常规、凝血功能、心肝肾功能、血糖、心电图、胸片、经颅多普勒、颈部超声均符合DSA要求。DSA包括主动脉弓、双侧颈总动脉、双侧椎动脉造影,术后神经系统未见异常体征。拟择期行CAS治疗。
4 月 26 日
上午10时查头MR显示左侧基底节区缺血性病灶(图1(B)~(D)),当日16:00患者再次突发失语并意识模糊,瞳孔等大等圆,直径3 mm,右侧上下肢肌力0级,右侧巴氏征阳性,长达2小时仍无恢复,考虑为左侧颈内动脉急性闭塞所致的急性缺血性中风(Acute ischemic stroke, AIS),NIHSS评分16分,拟急诊动脉溶栓及CAS治疗。
2.2.2. CAS手术过程
CAS于
4 月 26 日
19:00开始,手术后在台上观察30分钟,21:20下手术台,21:40回到病房。其过程如下① 镇静、局麻后予3000IU肝素全身肝素化;② 右股动脉穿刺,置入8F动脉鞘。③ 将90 cm的
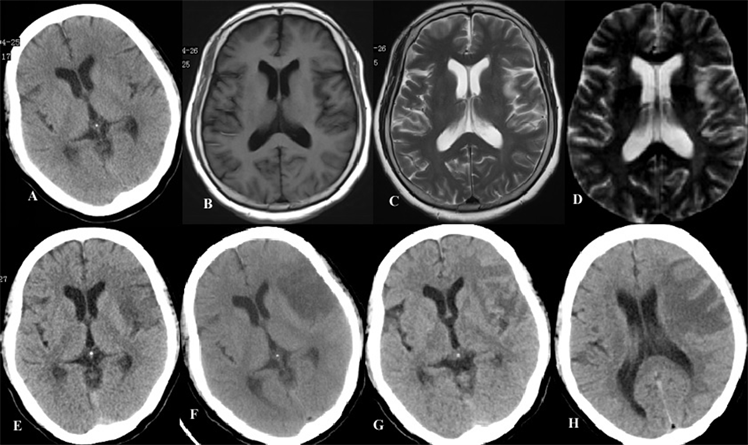 A为TIA后头CT,B、C、D为AIS前MRI显示腔隙性脑梗死,E为PMT术前头CT示基底节区低密度影,F为PMT + CCT术48 h后头CT示左侧颞额顶叶、岛叶急性脑梗死,G、H为术后12天头CT示左侧额颞顶叶、左侧岛叶脑梗死范围较之前缩小
A为TIA后头CT,B、C、D为AIS前MRI显示腔隙性脑梗死,E为PMT术前头CT示基底节区低密度影,F为PMT + CCT术48 h后头CT示左侧颞额顶叶、岛叶急性脑梗死,G、H为术后12天头CT示左侧额颞顶叶、左侧岛叶脑梗死范围较之前缩小
Figure 1. Patient’ head CT and MRI
图1. 患者头CT与MRI表现
8F波士顿科学导引导管(MP XF 90 cm)、长100 cm的5F日本TERUMO椎动脉造影管及长260 cm的交换导丝进行组合,将导引导管送入左颈总动脉上段,DSA显示左侧颈内动脉C1段重度狭窄并次全闭塞(图2(C))致左侧颈内动脉供血区缺血。④ 在侧位路径图引导下将保护伞装置通过狭窄段,并置于狭窄段上方至少距离2 cm的直段,打开保护伞,造影证实保护伞与颈内动脉壁完全贴合。⑤ 用球囊(3.0 × 20 mm)预扩狭窄段。⑥ 撤出球囊导管,在路径图指引下沿保护伞导丝将美国EV3锥形支架(8-6 × 40 mm)输送系统准确跨狭窄段释放支架。⑦ 造影复查支架成形效果及保护伞的前向血流情况。⑧ 支架成形术效果良好(残余狭窄 < 20%,管腔直径较术前增加76%) (图2(D)),保护伞外无充盈缺损,回收保护伞。⑨ 造影检查颅内血管情况。⑩ 撤出导引导管,保留动脉鞘,包扎好回病房。
2.2.3. 术后处理
1) 常规处理及观察
术后NIHSS评分8分,意识恢复,但不能言语。继续补液及抗凝治疗,由于出现颈动脉窦反应,心率62次/分,BP80/50 mmHg,以小剂量多巴胺维持血压至略高于正常水平。术后2小时即
4 月 26 日
23:50患者烦躁,浅昏迷,双侧瞳孔不等大,右侧直径约1.5 mm,左侧直径约2.0 mm,直接、间接对光反射迟钝,部分恢复的右侧上下肢肌力降至0级,NIHSS评分23分。急查头CT无出血,但有低密度影(图1(E)),提示左侧颈内动脉AIST并闭塞,尽管CT已有低密度影,但尚在时间窗内,拟立即行左侧颈内动脉溶栓取栓术治疗。
 A、B为术前左颈内动脉C1段重度狭窄,C为术前左颈内动脉C1段重度狭窄并次全闭塞,D为CAS术后左侧颈内动脉C1段成形效果,E、F示左侧颈内动脉C 1~7段巨大血栓形成,G示左侧大脑中动脉M1段远端通畅,H示PMT术后血管再通,I示CCT导管放置于支架内,J为术后12天头颈CTA示CAS处仍有狭窄,但血流通畅
A、B为术前左颈内动脉C1段重度狭窄,C为术前左颈内动脉C1段重度狭窄并次全闭塞,D为CAS术后左侧颈内动脉C1段成形效果,E、F示左侧颈内动脉C 1~7段巨大血栓形成,G示左侧大脑中动脉M1段远端通畅,H示PMT术后血管再通,I示CCT导管放置于支架内,J为术后12天头颈CTA示CAS处仍有狭窄,但血流通畅
Figure 2. DSA findings of the left carotid artery of the patient before and after operation
图2. 患者术前术后左侧颈动脉DSA表现
2) 动脉溶栓及经皮机械取栓(percutaneous mechanical thrombectomy, PMT)
4 月 27 日
1:20 DSA显示左侧颈内动脉C1-7段巨大血栓形成(图2(E) (F)),左侧大脑半球缺血。立即经椎动脉管分5次予血小板糖蛋白IIb/IIIa受体拮抗剂替罗非班(50 μg/ml) 50 ml进行接触性动脉溶栓,每次间隔5分钟后造影,半小时后见左颈内动脉仅有模糊显影(图2(F)),动脉溶栓不成功。立即进行经PMT治疗,沿椎动脉管送入微导丝微导管至左侧大脑中动脉M1段造影见远端通畅(图2(G)),撤出微导丝微导管,沿椎动脉管送入Solitair取栓器(6 × 20 mm)至左侧大脑中动脉M1段处取出血栓,时间已是凌晨2:20,左侧颈内动脉全段完全通畅,左侧大脑前动脉、大脑中动脉及其分支显影良好(图2(H)),但见支架内有不规则白色血栓(图2(I))。
3) 持续接触性溶栓(Continuous contact thrombolysis, CCT)
为防止血栓继续扩大再次闭塞血管,将较柔软的TERUMO椎动脉管(微导管留置于颈内动脉起始段易滑脱移位)置于左侧颈内动脉支架内血栓处持续泵入替罗非班(50 μg/ml) 3 ml/h进行CCT治疗(图2(I)),并带管返回病房,NIHSS评分18分,双侧瞳孔等大等圆,直径约3.0 mm,给予清除氧自由基、脱水降颅压、改善脑代谢、营养神经及对症支持治疗,CCT持续26小时后复查经颅多普勒提示左颈内动脉通畅,停止CCT,撤出导管,拔除动脉鞘并加压包扎,恢复双抗治疗。
2.2.4. 国内外文献检索
以“颈动脉支架置入术(Carotid artery stenting, CAS)”、“急性支架内血栓形成(Acute in-stent thrombosis, AIST)”、持续接触性溶栓(Continuous contact thrombolysis, CCT)或置管溶栓(Catheter-directed thrombolysis, CDT)检索1960年至2017年10月期间的国内维普中文生物医学期刊、CHKD数字图书馆期刊数据库、万方数据库及美国国立图书馆(PubMed)相关文献报道。
3. 结果
3.1. CAS术前结果
4 月 25 日
DSA:右侧颈内动脉C1段狭窄约65%,左侧颈内动脉C1段狭窄约90%(图2(A)和图2(B)),左侧椎动脉开口狭窄约60%。
4 月 26 日
上午脑MRI提示左侧额颞顶叶多发急性腔隙性脑梗塞(图1(B)~(D));CAS术前左侧颈内动脉供血区缺血(图2(C)),NIHSS评分16分。
3.2. CAS术后结果
4 月 26 日
21:10见CAS成形术效果良好(残余狭窄 < 20%,管腔直径较术前增加76%) (图2(D)),血流通畅,支架贴壁良好,未见造影剂外渗。21:40患者神清,运动性失语,右上肢肌力0级,右下肢肌力2级,NIHSS评分8分。
4 月 26 日
23:50患者神志不清,躁动。查体:BP190/110mmHg,浅昏迷,双侧瞳孔不等大,右侧直径约1.5 mm,左侧直径约2.0 mm,直接、间接对光反射迟钝,右侧上下肢肌力0级,右侧巴氏征阳性,NIHSS评分23分。头CT未见出血(图1(E)),DSA显示左侧颈内动脉AIST,C1-7段巨大血栓形成并闭塞,动脉溶栓失败(图2(E)~(G))。
3.3. PMT结果
PMT术后左侧颈内动脉全段完全通畅,左侧大脑前动脉、大脑中动脉及其分支显影良好,未见造影剂外渗,血管再通达到TIMI3级(图2(H))。支架内可见不规则白色血栓(图2(I))。
3.4. CCT结果
将TERUMO椎动脉管放置于左侧颈内动脉支架内血栓处持续泵入替罗非班(50 μg/ml) 3 ml/h进行CCT治疗(图2(I)),带管返回病房。术后患者清醒,双侧瞳孔等大等圆,直径约3.0 mm,直接、间接对光反射灵敏,右上肢肌力0级,右下肢肌力3级,NIHSS评分18分。CCT持续26小时后经颅多普勒提示:左侧颈内动脉及左侧大脑前动脉、大脑中动脉血流通畅,流速正常。
3.5. 后续治疗结果
经双抗、清除氧自由基、脱水降颅压、改善脑代谢、营养神经及对症支持治疗后病情稳定好转。2017年4月28日头部CT见左侧颞额顶叶、岛叶急性脑梗死(图1(F))。术后5天患者血压稳定于正常范围,语言及右下肢肌力均开始恢复,于
2017 年 5 月 8 日
复查头CT显示:左侧额颞顶叶、左侧岛叶脑梗死较之前范围缩小(图1(G)和图1(H));多层三维螺旋计算机断层扫描血管成像(Multidetector three-dimensional computed tomography angiography, 3D CTA)显示左侧CAS处仍有狭窄,但血流通畅(图2(J))。当时患者能说部分单词,右上肢肌力1级,右下肢肌力4级,左侧肢体肌力5级。术后第12天,患者能说部分句子,理解他人语言,右上肢肌力2级,右下肢肌力4+级,NIHSS评分5分,出院回当地治疗。随访6个月,患者仅右上肢肌力恢复至4+级,右下肢肌力5−级,生活基本自理。
3.6. 国内外文献检索结果
3.6.1. 国内文献检索结果
以“颈动脉支架置入”及“急性支架内血栓形成”检索国内各大数据库,内共检到7篇索相关论文,其中5篇出现了AIST并发症。增加持续接触性溶栓或置管溶栓检索词则无相关报道。
2011年赵星辉等 [3] 报道59例2006年4月~2011年3月间的CAS高危病例,置入65枚颈动脉支架,发生术中栓塞事件3例,均经微导管及时动脉溶栓开通闭塞血管,2例痊愈,1例因严重肺部感染死亡。2013年陈英道等 [4] 报道1例78岁男患CAS术后并发AIST,虽经术前双抗治疗3天后行CAS治疗,但术后20分钟即出现AIST并闭塞,于术后1小时10分行微导管动脉溶栓开通闭塞血管,因患者家属不同意再置入支架,再次发生AIST导致了大面积梗死,重度残疾。伍建军等 [5] 分析2003~2013年间156例CAS患者的临床及DSA资料,其中7例术中发生了AIST,发生率为4.5%。7例AIST患者均为男性,年龄41~81岁,平均年龄68岁;其中6例颈内动脉重度狭窄近乎闭塞,1例颈内动脉中度狭窄;5例术中仅单次出现颈内动脉闭塞,另2例术中反复出现AIST (1例2次;1例3次),共10次AIST需紧急处理。2014年张汉义等 [6] 分析12例AIS患者急诊CAS加局部溶栓治疗,其中1例出现AIST致大面积脑梗死而死亡。2016年胡伟等 [7] 回顾分析5例患者均在术前用双抗加阿托伐他汀20 mg治疗5天后再行CAS治疗,均在CAS后6分钟内发生AIST,进行性加重。其中4例经过球囊扩张治疗后血栓消失,1例经过动脉溶栓治疗后再通。
3.6.2. 国外文献检索结果
在美国国立图书馆(PubMed)以Carotid artery stenting (CAS) + Acute in-stent thrombosis (AIST)检索共查到18篇相关文献,而以Carotid artery stenting (CAS) + Continuous contact thrombolysis (CCT)或置管溶栓(Catheter-directed thrombolysis, CDT)均未查到相关报道。
早在2001年Chaturvedi等 [8] 报告了男女各1例均因CAS术前术后未使用抗血小板药物治疗,发生AIST而死亡。其中63岁女患8年前有过左大脑后动脉卒中,术前服用阿司匹林(剂量范围从81 mg到1300 mg),左侧颈动脉内膜剥脱术后11天出现右侧偏身瘫痪,DSA发现内膜剥脱部位出现狭窄,行CAS后发生AIST,立即给予75万单位尿激酶溶栓不成功,阿司匹林也未再使用,病情加重,12小时后头CT显示大量的出血性转化而死亡。另外1例57岁男患有高血压、糖尿病、冠心病、充血性心力衰竭和病态肥胖症,左眼反复发作性失明,予肝素治疗,DSA时停用肝素,DSA见左侧颈内动脉起始段严重狭窄。由于患者患有充血性心力衰竭和病态肥胖症而不能进行颈动脉内膜剥脱术,以CAS代之,支架置入顺利,左侧颈内动脉起始段重构完美。术前无抗血小板药物治疗,术后继续亚治疗量肝素治疗。术后2天部分凝血活酶时间32.7秒,术后3天出现右侧肢体乏力,患者开始服用阿司匹林,DSA见AIST已致颈动脉闭塞。当时认为溶栓治疗无效,没有用血小板糖蛋白IIb/IIIa抑制剂。随后患者出现弛缓性右侧偏瘫和意识障碍,CT显示巨大的左侧大脑中动脉区域梗死并产生占位效应,死于CAS术后11天。2005年Okazaki等 [9] 报道左侧颈内动脉C3段闭塞的45岁女患在CAS术后4小时后出现AIST,立即再次行CAS治疗,局部注射尿激酶24万单位,置入冠脉支架S670并后扩成形,经此处理后逆转了该次中风。术后给予肝素、噻氯匹啶治疗,7天后仍然出现病情恶化,脑血管造影显示左侧颈内动脉C3段再次发生AIST。经过多次再开通努力:CAS、输注肝素、奥扎格雷钠都没有成功,之后使用自膨式冠脉支架与第一次的支架重叠70%放置并再次后扩方达到再通目的。2006年Masuo等 [10] 报道1例71岁男患因左侧颈内动脉严重狭窄CAS术后3天后突然出现右侧偏瘫并失语,急诊DSA显示AIST并完全闭塞,立即行CAS获得再通,但残留少量血栓,经过后续治疗其右侧偏瘫和失语完全恢复。2007年Iancu等 [11] 报道了1例左侧颈动脉闭塞且右侧颈内动脉狭窄90%的70岁男患在CAS后发生了支架内再狭窄,再次行CAS治疗,置入药物洗脱支架过程中出现了AIST,经过局部溶栓和球囊扩张后很快恢复。同年Kurisu等 [12] 报道1例72岁男患右侧CAS术后7天突发左侧偏瘫,急诊DSA显示右侧颈内动脉AIST致完全闭塞,通过经静脉注射组织型纤溶酶原激活剂(1300,000 IU)并再次CAS后血管恢复再通。2008年Duk等 [13] 报道1例64岁男患经双抗15天并充分术前准备后行左颈总动脉CAS术中AIST,立即局部注射替罗非班0.4 μg/kg/min,持续30 min后血栓消失。随后静脉给予0.1 μg/kg/min维持治疗。Miyakoshi等 [14] 2009年采用3D CTA随访23例CAS术后支架内血栓形成情况,随访时间为2,4,8、12周、6,12个月,发现10例(43.5%)患者于2周时可见支架内亚急性血栓形成,到12周时逐渐消失,提示小血栓的形成可以逐渐化解。2010年Iancu等 [15] 再次报道2例CAS术中快速AIST导致血流动力学及神经功能改变,通过血栓内溶栓而再通,其中1例还再次进行了CAS治疗。2012年Stotts等 [16] 于报道1例因肝素诱发血小板减少症而致AIST。2013年Park等 [17] 报道1例67岁男患因右侧颈内动脉起始部70%狭窄合并同侧眼段未破裂动脉瘤,经CAS及动脉瘤栓塞后出现AIST,经动脉内注射阿昔单抗10mg后血栓消失。2013年Kanemaru等 [18] 报道1例77岁的膀胱癌男患经保护性三联抗血小板治疗(简称三抗,triple antiplatelet therapy,TAPT),即阿司匹林 + 氯吡格雷 + 西洛他唑三药组合,后行CAS,无任何围手术期并发症,然而6天后出现无症状性支架内血栓。在抗血小板治疗基础上增加阿加曲班抗凝治疗,血栓逐渐变小消失,没有出现血栓性症状。同一年Nii等 [19] 于报道1例男性64岁的AIS患者在经过充分双抗治疗行右侧颈内动脉CAS术后12天后再次出现左侧肢体瘫痪加重,急诊DSA发现右侧颈内动脉亚急性支架内血栓形成,立即采用抽吸导管抽吸后再通。2017年初Miyakoshi等 [20] 报道了1例84岁的AIS男患在经过双抗加阿加曲班及他汀类药物治疗15天后行右颈内动脉CAS,次日B超发现较小的AIST,第7天发现该血栓增大,因此于当天进行第二次CAS,此后TAPT,支架内血栓仍然在增大,连续输注肝素后使凝血酶原时间延长到50到65秒才使血栓停止增长,14天后停用肝素,继续观察血栓没有进一步发展。现将2001~2017年在美国国立图书馆(PubMed)检索到的文献总结如表1。
4. 讨论
目前心血管介入方面根据支架置入术后至血栓发生的时间,将支架内血栓形成分为急性期(<24 hr)、亚急性期(24 hr~31 d)、晚期(31 d~1年)和非常晚期(>1年) [21] ,脑血管介入亦可沿用此分期,而常见且危害性大者以AIST为主。颈内动脉C1段狭窄或闭塞导致的AIS多发生在动脉粥样硬化已造成局部血管严重狭窄的基础上,临床上很难用药物溶栓再通,常需急诊CAS来治疗该部位的急性闭塞达到持续再通的

Table 1. CAS and the clinical features and perioperative period of thrombus formation in the stent
表1. CAS及支架内血栓形成病例临床特征及围手术期情况
效果。然而AIS患者往往处于高凝状态,我们报道的这例患者亦然,CAS术中术后均可发生支架内血栓形成,尤其是AIST一旦发生会产生灾难性的后果,如何防止AIST的发生和发生后如何快速开通血管显得十分重要,涉及到术前预处理、术中操作及术后应对策略一系列问题。
4.1. AIST产生的原因与术前药物治疗
众所周知血栓形成的三个主要因素是血管壁改变(内皮细胞损伤、抗栓功能减弱),血液成分改变(血小板活化、凝血因子激活、纤维蛋白形成),血流改变(血流缓慢、停滞、漩涡形成)。其中血液成分改变如血小板及血脂直接影响血液黏度,导致血流缓慢、停滞;CAS术中术后出现的AIST主要是血管壁改变,内皮细胞损伤加上高凝状态导致抗栓功能减弱,形成易栓症。2016年Moulakakis等 [22] 认为颈动脉AIST的主要原因有:抗血小板治疗终止或时间不够、抗血小板药物抵抗、遗传性和获得性血栓性疾病。从以上检索文献来看,抗血小板药物治疗终止或时间不够长确实是常见而首要考虑的因素,这对于择期手术是容易解决的问题,因为有足够的时间作详细的术前评估与预处理,有助于预防AIST的发生;而对于急诊手术者来说则无法做到,我院这例患者入院时总胆固醇7.31 mmol/L↑、甘油三酯5.38 mmol/L↑、低密度脂蛋白胆固醇4.16 mmol/L↑,高脂血症直接导致血液黏度增高,由于已经发生急性脑梗死,来不及充分抗血小板治疗,行急诊CAS后接着发生了AIST。鉴于急诊手术的紧迫性和风险性,我国最近指南 [23] 要求急诊手术前给予负荷量双抗(即阿司匹林300 mg及氯吡格雷300 mg)治疗以避免AIST的发生,术后每天双抗连续治疗至少1个月,甚至3~6个月,此后长期服用阿司匹林。本文所报道的病例由于CAS术前已用双抗3天并加用了肝素抗凝治疗1天,因此没有给予负荷量双抗治疗,术后AIST的治疗积极取栓及采用血小板糖蛋白IIb/IIIa受体拮抗剂替罗非班CCT治疗,逆转了致死性结局,不失为一种大胆的治疗策略。
但产生AIST的原因并非如此简单,检索文献中部分CAS患者尽管术前用了双抗甚至三抗(TAPT)治疗,且时间超过了两周,仍然难以避免AIST的发生。因此,抗血小板药物抵抗、遗传性和获得性血栓性疾病是不得不考虑的方面。为了及时判断双抗的疗效,除了通过观察临床AIST事件,还可以通过实验室检测有无阿司匹林或氯吡格雷抵抗,或遗传性和获得性血栓性疾病(易栓症)。如通过检测阿司匹林对血小板聚集抑制率来判断是否存在阿司匹林抵抗:常规服用阿司匹林7天后,采用光学比浊法分别以二磷酸腺苷(ADP)和花生四烯酸(AA)为诱导剂,同时出现下述两项标准即是阿司匹林抵抗,只符合一项则判定为阿司匹林半抵抗:① 在10 μmol/LADP浓度下测定血小板最大聚集率 ≥ 70%;② 在0.5 mg/mLAA浓度下测得血小板最大聚集率 ≥ 20%。阿司匹林抵抗除与年龄、性别、高血压、糖尿病、高血脂等因素有关外,与基因多态性关系更为密切。氯吡格雷抵抗或称“治疗反应变异”,除了外在因素,如患者生活习惯(吸烟、饮酒)、用药依从性及药物相互作用等外,还有内在因素,主要是个体遗传差异所致。其中药物代谢酶的基因多态性是影响氯吡格雷药效的主要因素,也是近年来国内外研究最多的热点课题 [24] 。有研究 [25] 显示抗血小板药物抵抗现象普遍存在,抵抗的机制主要有反应途径中各代谢物及受体的基因多态性,人体对药物吸收率的不同,各种基础疾病的影响,同时服用其他类型药物对抗血小板药物的影响等,故根据个体化特征及疾病分层制定用药方案极其重要。增加阿司匹林剂量并未减少其抵抗的发生,阿司匹林、氯吡格雷联用能达到更好抑制血小板聚集的效果。本文所报道的这例是否有阿司匹林和氯吡格雷抵抗,因受条件限制没有进一步检测。
此除双抗外,其他药物治疗也有助于预防AIST的产生,如抗凝药物、补液治等。Stotts 等 [16] 于2012年报道1例肝素诱发血小板减少症和AIST,其治疗方法是对肾功能正常的患者应给予阿加曲班或来匹卢定或达那肝素治疗,而对肾功能不全的患者应给予阿加曲班治疗 [26] 。Miyakoshi [20] 等报道控制性抗凝治疗可以防止在CAS后的AIST复发。2014年张汉义等 [6] 分析12例AIS患者急诊CAS加局部溶栓治疗,其中8例术后第一个24 h给予替罗非班泵入,同时给予双抗治疗,未出现AIST。张汉义等认为急诊CAS术后发生AIST的风险大,主张除进行标准的肝素化治疗外,术后一般持续使用替罗非班24小时,并同时进行双抗治疗方可有效防止AIST。Kanemaru K [18] 报道1例77岁的膀胱癌男患经保护性TAPT后进行CAS,无任何围手术期并发症,然而6天后出现无症状性颈内动脉支架内亚急性血栓形成。在抗血小板治疗基础上增加阿加曲班抗凝治疗,随后血栓逐渐变小消失,没有出现血栓性症状。恶性肿瘤被认为是一个获得性易栓状态与血栓形成风险显著相关,对于有这些危险因素的CAS病例,应注意AIST的发生,建议反复检查。本文病例术后使用替罗非班行CCT治疗26小时,有效防止AIST的再发生,进一步说明抗凝药物在CAS术后治疗的必要性。
4.2. AIST的血管内治疗策略
国内资料 [5] 显示CAS术中术后AIST的发生率约为4.5%,且年龄跨度大,中老年均可发生,男性多见,建议CAS术后AIST治疗策略为采用微导管溶栓 + 血栓抽吸术恢复血流。伍建军等 [5] 认为CAS术中AIST致颈内动脉闭塞不可避免,特别是颈内动脉重度狭窄,近乎闭塞病例,熟练掌握急性颈内动脉闭塞的原因及相应治疗策略,有助于减少CAS术后AIST的严重并发症,提高CAS术的安全性。但临床上处于高凝状态的患者即使经动脉溶栓及抽吸血栓术暂时恢复了血流,往往会再次发生AIST致颈内动脉闭塞 [4] [5] [6] [8] [9] [15] [20] 。
国外有资料显示 [14] CAS术后2周时支架内亚急性血栓形成发生率约43.5%,比国内发生率更高,12周时逐渐消失,提示形成的小血栓经治疗后可以逐渐化解。国外专家 [19] 认为快速侵入性检查治疗是防止灾难性事件发生的最佳措施,快速诊断和促进颈动脉再通才能减少脑梗死和获得近期远期较好神经功能结果。目前促进颈动脉快速再通的技术有PMT和血栓抽吸两种方法配合药物溶栓治疗,此外还有外科手术及血管再成形术,但往往不及PMT速度快。国内外多数CAS术后AIST病例的治疗是通过CAS术后再次CAS治疗 [10] [11] [12] [15] [20] ,但这种方法不仅治疗费用高,而且有再次发生AIST的风险 [9] [11] ,对于我国普通百姓来说不仅难以承受高昂的费用,而且在心理上更难以接受再次CAS手术的风险。我们采取动脉内溶栓+PMT+CCT的治疗方案快速开通颈内动脉,持续支架内抗凝治疗,防止了AIST的再发生,获得了近期远期较好疗效,随访6个月时患者仅遗留轻微的手指欠灵活后遗症,对生活影响较少,相对于CAS术后再次CAS治疗节省了一大笔费用,减轻了患者的负担,且达到了预期的疗效。因此,动脉内溶栓 + PMT + CCT的治疗方案值得进一步探索与推广。
总之,CAS治疗前预先进行抗血小板、抗凝治疗及术后发生并发症时选择恰当的术式对获得理想的预期结果起决定作用。血管内治疗技术性因素所致的AIST主要通过不断地实践、熟练掌握CAS技巧来解决。一旦发生AIST,快速侵入性检查治疗是防止灾难性事件发生的最佳措施,动脉内溶栓 + PMT + CCT不惜为一种好的治疗方案。