1. 引言
滇重楼(P. polyphylla var. yunnanensis)百合科重楼属(Paris L.)多年生草本植物。滇重楼主要分布在云南,四川、贵州一带。生长在海拔1400 m~3100 m的常绿阔叶林,云南松林、竹林、灌丛或草坡中常见 [1] 。滇重楼根茎中甾体皂苷是其主要药用活性成分,主要为异螺甾烷醇类的皂苷元和糖基,包括以薯蓣皂苷和偏诺皂苷为主的十多种皂苷元 [2] [3] 。现代药理研究表明滇重楼根状茎具有清热解毒、消肿散瘀、凉肝定惊等功效,主治蛇虫咬伤、跌打损伤等症,此外,还有抗癌、止血、祛痰、抑菌、抗早孕等作用 [4] [5] [6] ,是“云南白药”、“热毒清”、“宫血宁”和“季德胜蛇药片”等著名中成药的主要原料。
一直以来,随着滇重楼的需求量逐年增加,人为对滇重楼野生资源的过度采挖使,同时滇重楼繁殖率低,种植粗放,品种基源混乱、栽培地域混乱、收获时节混乱,使野生滇重楼资源日益减少、已近枯竭,已严重威胁到以其为原料的医药工业的可持续发展 [7] [8] 。据云南白药调查资料显示,分布于中国境内的野生滇重楼80%已被开发利用 [9] 。滇重楼资源再生性严重破坏,种群出现了严重的衰退甚至面临灭绝的威胁 [10] 。滇重楼已被列入国家濒危植物保护行列。丰富的种质资源遗传多样性是育种的前提和先决条件,滇重楼野生种质消亡不仅极大影响其优良品种的选育,还将导致其对环境适应能力的降低,不利于其种群的生息繁衍。因此,开展不同产地野生滇重楼种群的遗传多样性研究,对探讨滇重楼濒危机制,建立合理的滇重楼种质资源保护策略以及滇重楼优良品种选育等具有重要意义。
本研究以云南省不同地区15个滇重楼居群作为试验材料,开展了遗传多样性分析,从分子水平上为今后开展滇重楼种质资源保护及优良种质选育提供依据。
2. 材料与方法
2.1. 材料
于2012年搜集分布于云南省11个地州共15份种质资源,各居群间间隔 ≥ 50 km (表1)。每份种质采集8~10个单株,采集健康叶片用硅胶干燥保存,带回实验室中待用。
2.2. 试验方法
2.2.1. DNA的提取
每个居群的所有样本各称取0.5 g叶片,用植物基因组DNA提取试剂盒(Promega, USA)提取基因组DNA。用1%的琼脂糖凝胶电泳检测提取DNA的纯度和完整性,并测定DNA浓度(ND-1000 UV Spectrophotometer,美国),根据浓度统一稀释为50 ng/μL。
2.2.2. AFLP分子标记
AFLP 实验流程按照Vos 等的方法进行 [11] 。基因组DNA(50 ng/μL)用两种限制性内切酶(MseI和EcoRI)在37℃保温4 h进行双酶切;限制性内切酶消化后,用T4DNA连接酶在16℃保温3 h将酶切片段连接到双链MseI和EcoRI接头上(MseI 接头序列为:
5'-GACGATGAGTCCTGAG-3'/5'-TACTCAGGACTCAT-3' EcoRI接头序列为:
5'-CTCGTAGACTGCGTACC-3'/5'-AATTGGTACGCAGTCTAC-3');连接产物用预扩增引物进行预扩增。预扩增反应程序为:65℃变性5 min后30个循环,每个循环包含94℃变性30 s,56℃退火50 s,72℃
表1. 滇重楼种质来源
延伸1 min。循环结束后再72℃延伸5 min。4℃终止。预扩增引物序列为: E00-AAC 5'-GACTGCGTACCAATTCAAC-3、E00-ACA 5、-GACTGCGTACCAATTCACA-3';预扩增产物稀释15倍后进行选择性扩增。选择性扩增反应程序为:94℃变性2 min后13个循环,每个循环包含94℃变性30 s,65℃ (touchdown method = 0.7℃ each cycle,72℃ 60 s,72℃ 1 min)后23个循环94℃变性30 s,56℃退火30 s,72℃延伸1 min。循环结束后再72℃延伸5 min,4℃终止。扩增产物用6%变性聚丙烯酰胺凝胶分离;银染、扫描保存图片。从64对AFLP选择性引物组合(见表2)中最终选用了3对均能产生谱带清晰、多态性强的组合进行样品的选择性扩增(E-AAC/M-CAA,E-AAC/M-CAC,E-ACA/ M-CAT),得到AFLP的DNA指纹图谱。
2.2.3. 数据分析
按凝胶同一位点上DNA带的有无进行统计,有带的记为“1”,无带的记为“0”,建立0-1矩阵。利用POPGENE 32和AMOVA软件进行居群遗传参数分析,计算多态位点百分率(PPL)、观测等位基因数(Na)、有效等位基因数(Ne)、Shannon信息指数(I)、Nei’s、基因多样性指数(He)、群体基因多样性(Ht)、群体内基因多样性(Hs)、居群间基因流(Nm)、群体总的遗传多样性(Ht)、居群内的遗传多样性(Hs)、群体间的遗传分化系数(GST);利用分子方差分析(AMOVA)也可以揭示滇重楼的遗传结构组成;根据Nei’s遗传距离(D)和遗传一致度(I),用NTSYS-pc 2.1软件对滇重楼居群进行UPGMA聚类分析和主坐标(PCoA)分析。
3. 结果与分析
3.1. AFLP各引物组合的扩增条带多态性分析
利用AFLP分子标记三对选择性引物组合一共产生了14,260条带(见表3),扩增总位点498个位点,

Table 2. Primer combinations of selective amplification
表2. 选择性扩增引物组合表

Table 3. Amplification result of 3 AFLP primer combinations
表3. 3对AFLP 引物组合的扩增结果
其中388个为多态位点,多态位点百分率为78.31%,平均每对引物扩增出的多态位点为129个位点。结果表明:引物组合E-AAC/M-CAC扩增的总点数最多含5017条带,但多态性较弱,而引物组合E-ACA/M-CAT扩增多态百分率最高为85.71%。
3.2. 遗传多样性分析
滇重楼遗传多样性相关指标水平存在差异(表4),在物种水平上多态位点百分率(PPL)为88.15%,有效等位基因数(Ne)为1.4995,Nei’s基因多样性为0.2849和Shannon信息指数(I)为0.4158。在居群水平上,PPL范围在42.75%~66%,最高为巧家(QJ),最低则是通海(YX),表明其杂合程度较高。有效等位基因数(Ne)可以较好地反映在居群中起作用的等位基因的数目,从而了解居群中等位基因的丰富程度。居群中有效等位基因数(Ne)范围1.2475~1.3788之间,Ne较高的为临翔(LC)、永胜(YS)和巧家(QJ),而相对较低的有永善(YA)富宁(FN)通海(YX)。Nei’s基因多样性指数(Nei’s)和Shannon信息指数(I)均能反映种群间遗传多样性,Nei’s和I的平均值分别为 0.1821、0.2742。在居群间,临翔(LC)、墨江(MJ)和镇沅(ZY)等居群Nei’s及I值均高于其他居群,表明这些居群具有丰富的遗传多样性,而通海(YX)和永善(YA)等居群的遗传多样性最低。在居群水平上,云南省15个地区的滇重楼遗传多样性较为丰富,但在物种水平上,滇重楼的遗传分化水平偏低。
3.3. 遗传变异分析
滇重楼居群间遗传变异Popgene分析结果(表5)。群体总的遗传多样性(Ht)为0.2519,而居群内的遗传多样性(Hs)为0.1868,据此计算出的群体间遗传分化系数Gst为0.2583,即居群间的遗传变异占总变异的25.83%,而居群内的遗传变异为74.17%,表明滇重楼的遗传变异主要来源于居群内,而居群间也存的分化程度很低。居群间基因流(Nm)为0.7178,表明居群之间遗传交换较多。
表4. 基于AFLP的滇重楼不同居群遗传多样性
表5. AFLP标记对滇重楼居群基因多样性Nei’s分析
3.4. 聚类分析和主坐标分析
滇重楼不同居群间的遗传变异可以揭示其相互间的进化关系。基于AFLP三对引物在云南省15个地区的滇重楼扩增片段,计算滇重楼居群间的遗传相似系数。根据Nei’s遗传距离(D)和遗传一致度(I) (表4),用NTSYS-pc 2.1软件对15个滇重楼居群进行UPGMA聚类分析(图1),进一步阐明滇重楼居群间的遗传关系。
从遗传的一致度分析,滇重楼个居群的亲缘关系都比较接近,15份滇重楼种植资源之间均有较高的遗传相似度。从聚类图中可以看出,当GSC值为0.9时,可以将滇重楼种质明显分为2大类群,其中维西(WX)就单独归为一类,剩余十四个居群为一大类群。当GSC值为0.92时,可以将滇重楼种质明显分为3大类群,第I是最大的一个类群,包括8个居群,其GSC值介于0.86~0.97之间。该类群中,GSC值最相近的是永胜(YS)和通海(TH),其次是富宁(FN)和屏边(PB)。该类群在GSC值约为0.932处可明显分为2亚类,其中墨江(MJ)单独为一类。富宁(FN)、屏边(PB)、临翔(LC)、禄劝(LQ)、永胜(YS)、通海(YX)和石屏(SP)为一亚类。GSC介于0.88~0.97之间。
第II类群包括6个居群,GSC介于0.89~0.97之间,又可以在GSC为0.93时分为两个亚类,永善(YA)单独为一亚类,其余弥渡(MD)、镇沅(ZY)、永平(YP)、巧家(QJ)、宣威(XW)为一类。
为了更直观的表示滇重楼种质间的相互距离,对15个滇重楼居群AFLP的结果进行主坐标PCA (Principal coordinate analysis)分析,结果显示,PCA1、PCA2和PCA3分别占总变异的9.12%、17.60%和9.87%,前两个主坐标代表总变异的26.72%,前三个主坐标点总变异的36.59%。由第一、第二主坐标进行PCA分析的二维图(图2)可以看出,将滇重楼各居群分布较为散乱。由第一、二、三主坐标进行的 PCA 分析三维图(图3)可以比较清晰地看出,滇重楼居群分为三大类,与根据AFLP的聚类分析结果,不用地区的滇重楼种质资源基本以地理位置和海拔分布作为不同类群的划分,当然也有小部分例外。说明原始物种的起源进化和生态环境变化对滇重楼的遗传多样性影响较大,这与滇重楼基于AFLP标记的遗传多样性分析研究结果相一致。
4. 讨论
AFLP分子标记研究发现在物种水平上多态位点百分率(PPL)为88.15%,有效等位基因数(Ne)为1.4995,Nei’s基因多样性为0.2849和Shannon信息指数(I)为0.4158。在居群水平上,Nei’s和I的平均值分别为0.1821、0.2742。PPL范围在42.75%~66%,最高为巧家(QJ),最低则是通海(YX),表明其杂合程度较高。有学者认为He、PPL这些指标比较重要,能反应出物种在种群水平的遗传多样性 [12] 。物种遗传多样性水平是其进化历史事件、分布区大小、生物学特性、生态条件及人为干扰等因素综合作用的结果 [13] 。滇重楼分布广泛分布于温带和热带地区,在我省主要分布在阔叶林或者灌木下。从生物学特性来看,滇重楼为多年生都年生草本,虫媒花,属异花授粉植物 [14] ,有利于维持较丰富的遗传变异。因而其遗传多样性较为丰富。
种群遗传结构是通过物种群体间和群体内的遗传分化来体现的,种群遗传分化系数是评价种群遗传结构的重要参数。两种手段得到的结果进行分子方差分析(AMOVA)都表明引起滇重楼的遗传变异的主要
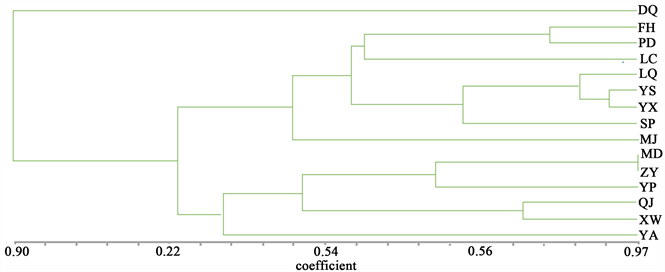
Figure 1. Dendrogram by UPGMA cluster for 15 populations of P. polyphylla var. yunnanensis based on AFLP
图1. 基于AFLP的15个滇重楼居群的UPGMA聚类图
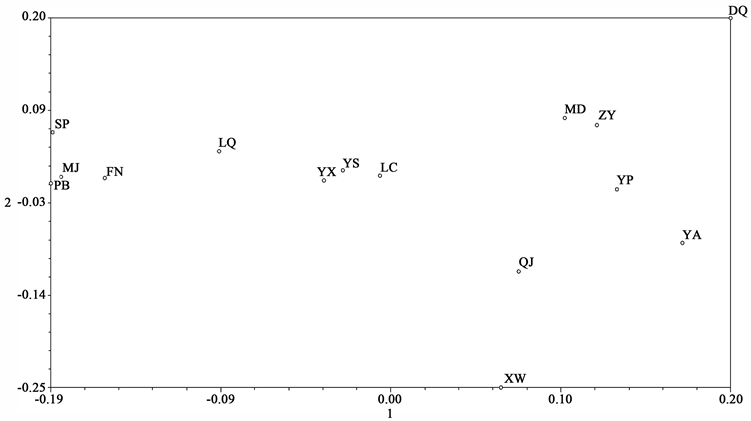
Figure 2. Two-dimensional PCA plot from P. polyphylla var. yunnanensis based on AFLP analysis
图2. AFLP标记对滇重楼不同居群PCA二维图
因素来源于居群内,结果表明滇重楼居群内的变异较大。一般认为是交配系统、种子传播方式、生活史、地理分布等因素共同作用的结果。据《重楼属植物》滇重楼的植物学特性来看,具有吸引传粉者的特征,同时在资源收集过程中观察到有昆虫采蜜的行为。Nybom [15] 对116种植物的种群遗传分化系数(GST)进行统计比较平均值得出,异交植物的GST为0.27,自交异交植物的为0.65,混合交配的为0.40,而本次研究结果滇重楼的GST为0.2583,与异交类型交配值最为接近,同时发现滇重楼整体分化系数较低。
地理因素对遗传分化的主要影响主要表现在两个方面:一是由于花粉流的距离有限,空间隔离在一定程度上决定了居群间基因交流水平 [16] 。因此,在理想条件下,空间距离越近,居群间基因交流越频繁,遗传分化水平越低;二是地理因素如经纬度、海拔高度对生态因子有着规律性影响,从而控制居群分化。上述为滇重楼整体遗传分化水平较低的原因。
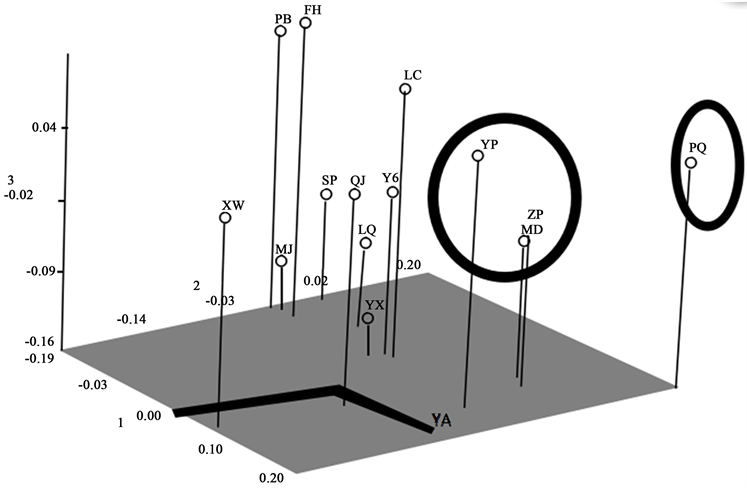
Figure 3. Three-dimensional PCA plot from P. polyphylla var. yunnanensis based on AFLP analysis
图3. AFLP 标记对滇重楼不同居群PCA三维图
云南的地貌,以云南元江谷地和云岭山脉南段的宽谷为界,云南全省大致可以分为东西两大地形区 [17] 。云南东部平均海拔在2000米上下为滇东、滇中高原,云南西部为横断山脉纵谷区,高黎贡山。对AFLP的数据进行分析发现,滇重楼地理分布特征与云南地貌特征有一定的联系,地貌特征形似或者地貌分布相近的居群基本都可以聚到一起。何俊等从113条ISSR引物中筛选出14条引物用于6个滇重楼居群共153个个体的PCR扩增 [18] 。发现滇重楼野生居群内的遗传多样性的不足,相对而言,滇重楼在物种水平上还保存有较高的遗传多样性。遗传变异主要存在居群内。指出滇重楼生境遭受破坏和其自身的生物学特性是其目前遗传多样性维持在较低水平的主要原因 [19] 。
虽然,滇重楼遗传多样性较为丰富,但是近几年来,人为生产生活对滇重楼分布区干扰和破坏,导致了滇重楼产地破碎化、片段化程度十分严重,呈斑块状分布,物种多样性差异明显,物种分化水平下降。在本研究结果中,发现三个遗传多样性较低的居群通海(YX)、墨江(MJ)和宣威(XW)均未受到任何的保护管理,应采取优先保护的措施,由于这几个地区均属于云南省主产区,野生居群存的个体数目均较少,建议将它们就地保护。同时考虑遗传多样性较高的居群个体,还要尽可能的保护各不同居群所包含的遗传多样性,以促进基因的广泛交流,达到通过提高物种多样性而增强其生存力的目的。由于滇重楼世代周期长,繁殖能力低,幼苗存活率低,种群年龄结构呈衰退型,加之生境片断化,建议辅以人工杂交和繁育,对其杂交繁育后代进行评估后回归引种进入其原分布区中适宜的生境,帮助其建立能持续发展的居群。
综上所述,滇重楼保护应该从两方面着手,一方面非常有必要制定有效措施对滇重楼植物的野生资源进行重点保护,禁止乱采乱挖,使其种质资源能得以延续。具体方式:1) 尽可能减少人为活动,降低人类对其的干扰程度,控制人为活动。2) 可在滇重楼集中分布的自然保护区进行就地保护,为滇重楼植物的生存及繁殖创造良好的生境条件;另一方面要积极研究出可行的人工繁殖及栽培方法,通过人工栽培,自给自足。例如:迪庆(DQ)地区的种质资源株型中等,皂苷含量丰富,可以在高海拔冷凉地区推广该地区种质资源。屏边(PB)地区株型较高,叶型、花型偏大,皂苷含量同样较高。可以在低海拔,湿润多雨的常绿阔叶林地区推广该地区种质资源。
致谢
感谢国家自然基金“内生菌促进滇重楼皂苷类活性成分积累的机理研究”(81473310);“滇重楼结构发育与皂苷积累的光照效应”(31560085)对本实验室给予的资金支持;诚谢实验室老师给予专业的指导以及同学给予的支持与陪伴;感谢给予转载资料、文献的所有前辈!
NOTES
*通讯作者。