1. 引言
目前随着工业的发展和农业生产的现代化,自然环境受重金属污染越来越严重。重金属有污染范围广、持续时间长、污染隐蔽、不可逆性,不易在物质循环和能量交换中分解,只能发生各种形态之间的相互转化,能被生物体富集并沿食物链转移等特点。
青檀(Pteroceltis tatarinowii Maxim.)分布较广,相对集中分布于华北、华中、华东各地,广西和粤北也有分布 [1] 。青檀的韧皮纤维是我国文房四宝之一——宣纸的高级原料,是第三纪古热带植物区系的植物,也是我国特产的单种属植物,对研究古代植物区系、古地理及古气候有重要价值。到目前为止科学家们对土壤干湿交替对青檀幼苗生理及生长的影响 [2] 、水培青檀幼苗对NaCl胁迫的生理响应 [3] 、青檀天然群落土壤成分及其对青檀生长的影响 [4] 、盐胁迫对青檀幼苗生长及生理特性的影响 [5] 等方面进行了研究,关于铅对青檀幼苗生理生态特性的研究则较匮乏。本文对铅胁迫下青檀幼苗冠幅、株高、叶绿素含量、SOD酶活性、MDA含量、可溶性糖等进行了分析,为进一步认识青檀抗铅污染的生理机制提供依据。
2. 材料与方法
2.1. 幼苗培养
2014年3月从广西崇左市岜盆乡白头叶猴自然保护区采回青檀幼苗,于自然光下培养,全天日照长度多数为11 h,温度在15℃至30℃范围,3月至5月降雨较少。待长势正常后,选取长势良好且相近的植株进行Pb胁迫处理。五个处理分别为0.001 mg/L,0.010 mg/L,0.100 mg/L,1.000 mg/L,1.500 mg/L质量浓度的硝酸铅溶液,各个质量浓度梯度的PH值均调为7,空白对照用等量蒸馏水进行浇灌,每个处理3株幼苗。浇灌量为300 mL/d,试验过程每隔4天弃去旧液,更换一次新鲜营养液。在处理60天后分别取样。
2.2. 试验方法
2.2.1. 叶绿素含量、SOD、MDA、可溶性糖测定
对整个植株的所有根、茎、叶分别进行采集,用去离子水清洗干净,在测定过程中根、茎的称取量为0.50 g,叶为0.25 g,叶绿素含量采用80%丙酮浸提,分光光度法进行测定 [6] ;SOD活性测定采用氮蓝四唑法 [7] [8] ;用硫代巴比妥酸法测定丙二醛含量 [7] [9] ;蒽酮法测定可溶性糖含量 [7] [10] 。
2.2.2. 株高、冠幅的测定
在开始处理后,用卷尺测量各个植株的冠幅与株高,之后每隔10 d观察植株的长势和长相,分别记录当天每个植株的生长状况。以胁迫后冠幅、株高与胁迫前冠幅、株高的差作为各浓度对冠幅、株高的影响。
2.3. 数据分析
数据分析采用Excel软件进行统计处理和绘图分析。
3. 试验结果与分析
3.1. 铅胁迫对青檀幼苗冠幅、株高的影响
3.1.1. 铅胁迫对青檀幼苗冠幅的影响
林冠截获太阳光进行光合作用,光合作用能力的大小决定着植株的生长状况,单株植物的冠幅林冠参数,是影响群落光合作用的重要因子 [11] 。在不同质量浓度梯度的硝酸铅胁迫下,青檀幼苗冠幅的变化如图1所示,对数据进行方差分析结果如表1,冠幅增长随着铅处理浓度的增加变小,在铅处理浓度为0.100 mg/L时冠幅没有变化。各铅处理浓度下冠幅的增长值均低于对照组的值,说明铅胁迫对青檀幼苗的冠幅增长有抑制作用;当铅处理浓度为1.500 mg/L时,胁迫后期出现叶子泛黄、干枯,甚至脱落,所以出现冠幅负增长的情况;低处理浓度的铅胁迫对青檀幼苗的冠幅增长有明显抑制作用,高处理浓度的铅胁迫已经危害到了青檀幼苗的生长。
3.1.2. 铅胁迫对青檀幼苗株高的影响
株高常常作为预测变量,广泛应用于生态学研究中生物量的估算 [11] 。从植物株高的变化可以了解植株的生长力。在不同铅处理浓度胁迫下青檀幼苗株高的变化如图2所示,对数据进行方差分析如表2。当铅处理浓度大于0.010 mg/L时危害到了青檀幼苗的生长。当处理浓度为0.010 mg/L时对青檀幼苗的株高有抑制作用,株高变化及其显著;在处理浓度为0.100 mg/L以上时青檀幼苗的生长严重受限,株高出现零增长;处理浓度为0.001 mg/L时,青檀幼苗的株高变化差异显著。

Figure 1. Effects of lead stress on tree crown width of Pteroceltis tatarinowii. Maxim. seedlings
图1. 铅胁迫对青檀幼苗冠幅的影响
表1. 铅胁迫对青檀幼苗冠幅的影响
表中:**表示冠幅前后变化差异及显著,*表示冠幅前后变化差异显著,NS表示冠幅前后变化无差异。
表2. 铅胁迫对青檀幼苗株高的影响
表中:**表示株高前后变化差异及显著,*表示株高前后变化差异显著,NS表示株高前后变化无差异。
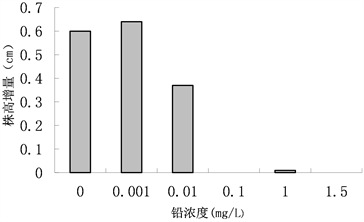
Figure 2. Effects of lead stress on plant height of Pteroceltis tatarinowii. Maxim. seedlings
图2. 铅胁迫对青檀幼苗株高的影响
3.2. 铅胁迫对青檀幼苗不同部位叶绿素的影响
光合作用为植物生长发育提供物质和能量,是植物生长发育的基础 [12] 。植物主要是靠叶绿素进行光合作用,从而进行一些干物质的积累,为植物本身的生长发育提供所需的营养与能量,主要表现为个体长大、成熟等现象。叶绿体中主要靠叶绿素来承担收集、传递和转换光能的重任,所以叶绿素含量对于光合作用起着十分重要的作用。因此,在铅胁迫的背景下青檀幼苗叶绿体的含量高低体现了青檀抗铅胁迫能力的大小。
不同铅处理浓度下青檀幼苗叶、茎中叶绿素含量如图3所示。在叶中,经过胁迫处理的植株叶绿素含量均比对照组低。在茎中,叶绿素含量总体上随着处理浓度的增加变小,当处理浓度为1.5 mg/L时,叶绿素含量有所升高。但经过铅胁迫处理后茎中叶绿素含量均比空白对照的含量低。在各铅离子浓度胁迫下青檀幼苗叶、茎中的叶绿素含量均低于对照组的值,说明在铅离子胁迫下不利于青檀幼苗的光合。
3.3. 铅胁迫对青檀幼苗丙二醛含量的影响
植物器官衰老或在逆境下遭受伤害,往往发生膜脂过氧化作用,丙二醛(MDA)是膜脂过氧化的最终分解产物,其含量可以反映植物遭受逆境伤害的程度。重金属是脂质过氧化的诱变剂,浓度越高,脂质过氧化产物MDA积累越多,两者密切相关 [13] 。铅胁迫下青檀幼苗各部位MDA含量的变化如图4所示,在叶子中,当处理浓度为0.001 mg/L时,MDA含量比空白组稍微低些;处理浓度为0.1 mg/L时,MDA含量最高,为0.826 umol/g∙Fw;茎中,MDA含量在各处理浓度下的区别不大,当铅离子浓度为0.1 mg/L时,其值最大,为0.428 umol/g∙Fw;根中,在各个铅处理浓度下MDA含量均明显比空白对照组高,当处理浓度为0.01 mg/L时,MDA含量为0.823 umol/g∙Fw。通过对不同部位MDA含量的比较,可得,在处理浓度为0.1 mg/L时,叶中MDA含量最大,可见此浓度下,叶子受铅胁迫的伤害最大,根次之;在其他处理浓度下,根中MDA含量均比叶、茎高,可知,铅胁迫对根的伤害最大。
3.4. 铅胁迫对青檀幼苗可溶性糖含量的影响
可溶性糖是构成植物体的主要组成成分之一,也是植物进行新陈代谢的原料和贮存物质。不同生长环境可以影响植物中可溶性糖含量。因此对植物中可溶性糖含量的测定,可以了解和鉴定植物品质的高低。铅胁迫对青檀幼苗可溶性糖含量的影响如图5所示,相同浓度的铅离子胁迫下青檀幼苗可溶性糖含量在根中较高,叶中较低;随着铅离子浓度的增大,根、叶中可溶性糖虽有所增大,但区别不大;在茎中,低处理浓度和高处理浓度时,可溶性糖含量较高,当处理浓度为1.5 mg/L时,可溶性糖含量最大,为0.212 ug/g,当处理浓度为0.1 mg/L时,可溶性糖含量最小,为0.097 ug/g。
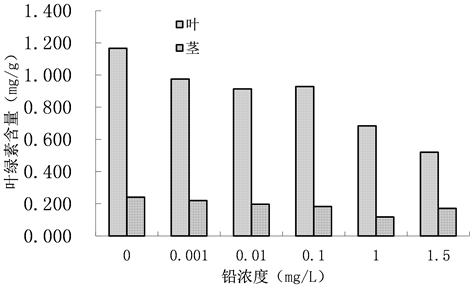
Figure 3. Effects of lead stress on chlorophyll in different part of Pteroceltis tatarinowii. Maxim. seedlings
图3. 铅胁迫对青檀幼苗不同部位叶绿素的影响
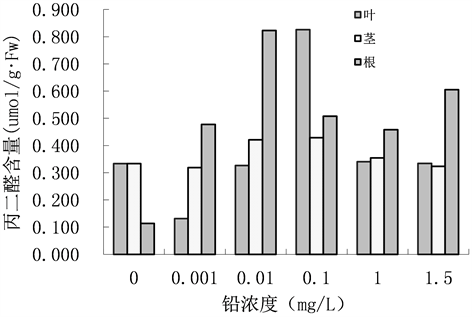
Figure 4. Effects of lead stress on malondialdehyde content of Pteroceltis tatarinowii. Maxim. seedlings
图4. 铅胁迫对青檀幼苗丙二醛含量的影响

Figure 5. Effects of lead stress on soluble sugar of Pteroceltis tatarinowii Maxim. seedlings
图5. 铅胁迫对青檀幼苗可溶性糖含量的影响
4. 讨论
研究表明重金属污染对植物的生长会产生一定的影响 [14] 。在不同的铅处理浓度胁迫下冠幅与株高的增量均低于对照组;不同铅含量对青檀幼苗叶子及茎中的叶绿素积累有不同程度抑制作用,在各铅浓度胁迫下青檀幼苗叶、茎中的叶绿素含量均低于对照组的值;说明低浓度对青檀幼苗的光合作用有明显抑制作用。
丙二醛含量可以反映植物遭受逆境伤害的程度。对不同部位MDA含量进行比较得知,根中MDA含量最高,可见铅胁迫对根的伤害最大。
生长环境可以影响植物中可溶性糖含量。可溶性糖作为植物的一种抗寒保护物质已经被公众所认可,且在多种抗寒植物中也证实了抗寒性与可溶性糖含量呈正相关的关系 [15] [16] [17] [18] [19] 。相同质量浓度的铅胁迫下,青檀幼苗可溶性糖含量在根中较高,叶中较低;可见在铅胁迫下,青檀幼苗根的抗寒性最强。
基金项目
广西高校科学技术研究重点项目:重金属对白头叶猴保护区优势植物胁迫机制的研究(2013ZD073)。
NOTES
*通讯作者。