1. 引言
放射性脑坏死是脑肿瘤放疗后的严重并发症之一,最早由Fischer和Holder于1930年提出 [1] 。主要表现头痛,恶心与呕吐,嗜睡以及神经体征的恶化,严重威胁病人的生命。近年来逐渐引起临床医师重视。现报道了我院诊治的1例病例,结合文献分析总结了放射性脑病的发病机制和治疗方法。
2. 病例报告
患者 男,46岁。因“一过性意识丧失、右上肢抽搐1小时”于2015年8月21日入院,行颅脑增强MRI示右侧额叶异常强化病变,考虑胶质瘤可能性大(图1)。患者于2015年9月15日于山东大学齐鲁医院行手术切除,术后病理示:右侧额叶胶质母细胞瘤。术后放疗30次,累积剂量66 Gy,同步替莫唑胺化疗。2016年10月27日复查结果:右侧岛额颞叶区见多个类圆形或不规则型强化病灶,周围水肿区无强化,占位效应明显,中线结构向左移位(图2)。此时距首次放疗结束12个月,本例患者头痛症状没有自行缓解或稳定,考虑排除假性进展。DTI显示右侧纤维束明显减少、稀疏,走行尚可。入院诊断
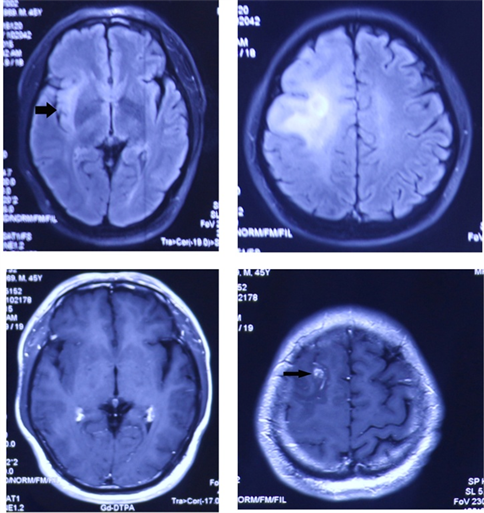
Figure 1. Pre-operation brain MRI showing: abnormal lesions are located in frontal lobe and insular lobe. Lesion located in frontal lobe showed thin contrast-enhanced
图1. 术前颅脑MRI (2015.8.21)显示:右额叶、右岛叶异常病灶(大箭头所指),右额叶病灶少量强化(小箭头所指)
考虑肿瘤复发。2016年11月3日在全麻下行右额颞岛叶肿瘤切除术和右额叶肿瘤切除术。术后病理:右额叶肿瘤、颞叶肿瘤,胶质母细胞瘤(WHO IV级)。免疫组化标记结果:瘤细胞GFAP (+)、Vimentin (+)、S-100 (部分+)、Syn (−)、P53 (+)、EMA (−)、Ki-67 (约30%)。2016年11月26日行第2次放疗,放疗30次,累积剂量60 Gy。2017年2月患者因头痛入院,入院后给予脱水降颅内压等对症治疗。住院期间间断出现左下肢活动障碍。复查颅脑MRI结果:右侧岛额颞叶区见大片状长T1长T2异常信号,压水呈等信号,DWI以等低信号为著,增强扫描呈环形强化,病变较前增大,最大截面6.8 * 4.1 cm,病变周围可见水肿,且水肿范围较前增大。右侧侧脑室受压变窄,右侧部分脑室经大脑镰下疝入左侧(图3)。此时距第2次放疗结束1.5月,患者出现严重脑水肿,并且侧脑室旁占位效应明显,头痛症状加重且伴有间断左下肢活动障碍。MRI显示病变部位与照射野的范围基本一致,表现为典型的“肥皂泡”征,考虑放射性脑坏死。1月后患者出现视物模糊并逐渐加重,偶有头痛、头晕,间断出现左下肢活动障碍,拒绝手术治疗。同年8月因癫痫发作再次入院,呈持续昏迷状态,不久发生临床死亡。
3. 讨论
放射性脑坏死是脑放射性脑病的一种类型,最早由Fischer和Holder于1930年提出 [1] 。其主要致病因素包括放射总剂量、分次剂量、照射次数、照射面积,此外尚与合并化疗、动脉硬化、高血压等因素有关 [2] [3] 。当重复照射或应用更高剂量时,放射性坏死发生率增加。(放射剂量超过62 Gy时放射性坏死的发生率增加2倍,剂量超过78 Gy时发生率增加4倍。)胶质母细胞瘤通常在经过标准放化疗和普通化疗后1年内发生复发或坏死。本例患者经两个放射疗程,在第1疗程结束12个月后复查颅脑MRI,显示:手术部新出现强化病灶,同侧岛叶、后毗邻的额、颞叶出现异常病灶。经手术病理证实为肿瘤复发。而在第2放疗2个月后MRI显示病变部位与照射野的范围基本一致,表现为典型的“肥皂泡”征,受照
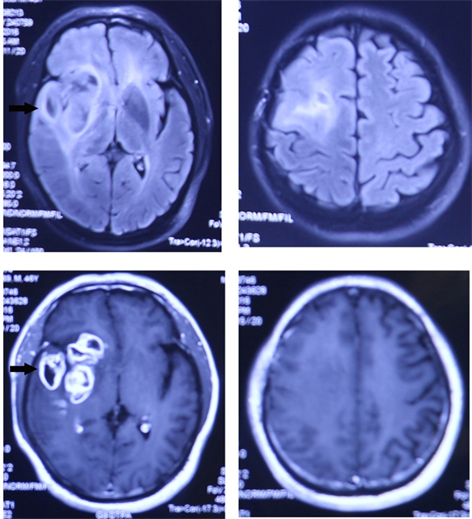
Figure 2. In 12 months after operation, brain MRI showing: abnormal lesions located in frontal lobe and insular lobe, are contrast-enhanced
图2. 术后12个月颅脑MRI (2016.10.27)显示:右额叶、右岛叶异常病灶,右岛叶、颞叶病灶强化明显(箭头所指)
射部位呈现病灶并大脑镰下疝形成,诊断为放射性脑坏死。
关于放射性脑坏死的发病机制主要有以下几种学说:血管损伤、胶质细胞损伤、神经元损伤、自身免疫反应和炎症反应。放射性脑坏死临床特点是:1) 起病多发生在放疗后数月到数年。2) 主要致病因素是局部照射量过大。本例患者根据磁共振表现诊断为多中心性胶质瘤。多中心性胶质瘤部分病灶不能显示、肿瘤浸润范围不能确定以及局部放疗易出现放疗空白区复发等原因,倾向采取全脑放射治疗,该病人两次、多部位放疗增加了放射性坏死的几率 [4] 。3) 临床症状及体征与照射部位相一致。4) 颅内压增高:坏死组织及周围水肿导致颅内压升高。本例患者表现为头痛、恶心、呕吐、癫痫发作等症状,并且逐渐出现左下肢活动不灵、双眼视物模糊。
临床上该病需与以下疾病相鉴别:1) 脑肿瘤复发:PET检查有助于鉴别放射性脑坏死与脑肿瘤复发。临床上有报道应用氟代脱氧葡萄(F18-FDG)进行脑组织病变部位显影,认为在坏死区18F-FDG摄取率较低,而在肿瘤复发区摄取率较高 [5] 。DWI目前应用比较广泛,肿瘤复发时ADC值较放射性坏死低。肿瘤复发的ADC比值(增强区ADC值与对侧脑ADC值的比)往往较低。DTI中的重要指标各向异性分数FA,肿瘤内纤维束破坏及细胞损害导致扩散减弱,从而各向异性比正常白质偏低。放射性坏死的各向异性甚至比复发性肿瘤更低,因为在坏死区域几乎没有正常的轴突或细胞。2) 假性进展:假性进展发生时间较放射性脑坏死早,一般在放疗后数周到3个月内。大多数患者没有症状,部分由于短暂脱髓鞘引起并发症。许多研究表明其具有自限性,是可自愈的。
根据病灶大小、部位、水肿程度、占位效应等因素差异,针对放射性脑坏死的治疗,目前主要包括药物治疗和手术治疗。本患者给予了脱水药物和皮质激素治疗,可以缓解头痛、肢体活动障碍等症状。血管内皮生长因子(VEGF)在增加血管通透性、水肿和坏死方面均有可能发挥作用。研究表明抗VEGF单克隆抗体贝伐单抗对放射性脑坏死治疗有作用 [6] 。本患者加用了类似药物,效果较明显。手术治疗可缓解占位效应,减轻水肿,降低颅内压,从而使临床症状得以改善 [7] 。本例患者有头痛,间断左下肢活动障碍并逐渐出现视物模糊等症状,存在手术指征,建议手术治疗,与患者及家属沟通后拒绝手术。文献中也有采用高压氧治疗(HBOT)的报道。目的是增加脑实质的氧浓度,以刺激血管生成,恢复局部血液供应 [8] 。国外学者报道激光间质热疗(LITT)是一种治疗局灶性脑放射性坏死的安全措施,能有效控制脑水肿并且在短期随访中有明显的临床改善 [9] 。
本文仅报道了一例典型放射性脑病,资料有限,不能代表放射性脑病的普遍性特点,下一步需要收集大量相关病例,探讨放射性脑病的诊治。目前在放射性脑坏死与肿瘤复发鉴别方面还没有统一标准,需进一步完善相关检查技术 [10] ,进而增加诊断准确性。对于放射性脑坏死的治疗,目前还缺乏有效治疗方法,根据患者的放疗敏感性,选择合适放射剂量非常重要。
基金项目
山东省自然科学基金(ZR2014HL044);滨州医学院科研启动基金(BY2015KYQD29)。