1. 引言
水污染已成为近年来最严重的环境问题之一,不断威胁着人类健康和社会的可持续发展,日益严重的水污染危机使得半导体光催化技术引起了广泛的关注 [1]。钨酸铋(Bi2WO6)由[Bi2O2]2+层和[WO4]2−层交替重叠组成,这种独特的层状结构形成的内建电场,使得电子和空穴能够有效的分离,有利于其光催化活性的提升 [2]。然而,对可见光的利用效率偏低、载流子的迁移速率较低、电子空穴复合几率较高仍然限制着钨酸铋材料在实际水处理中的应用 [2] [3] [4]。
构建合适的掺杂体系是一种有效提高材料光催化性能的手段。将合适的阳离子或阴离子引入到主晶格中,通过增加电子或空穴密度来改变半导体的电化学性质,这能够有效地调节半导体材料的能带结构,促进光生电子和空穴的分离 [5] [6]。同时,钨酸铋层间隙易发生嵌入、剥离和交换,有利于掺杂体系的构建 [7]。金属的掺杂通常能够起到较好的效果,但金属掺杂会降低体系的热稳定性并且更容易成为电子空穴的复合位点,相较于金属而言,非金属掺杂则更能够避免这类问题 [8]。硫(S)和氧(O)同为氧族元素,它们有着相同的最外层电子数,因此在掺杂时,硫可以较容易取代氧的位置进入晶格 [9]。Chang等人以硫脲为硫源制备得到S掺杂(BiO)2CO3,其中硫掺杂调整了材料的能带结构,形成的内建电场提高了电子空穴的分离效率 [10]。
在本部分工作中,我们通过一步水热法实现了硫掺杂钨酸铋的制备,并通过调控投料中硫脲的量来实现不同量掺杂的钨酸铋。硫掺杂的钨酸铋相比于改性前,对水体中污染物双酚A的降解能力得到明显提升。我们通过荧光光谱和电化学实验来研究材料中光生电子和空穴的复合和迁移效率,进而阐明在光催化体系中活性变化的原因。
2. 材料与方法
2.1. 试剂及仪器
试剂:五水硝酸铋(Bi(NO3)3∙5H2O),二水钨酸钠(Na2WO4∙H2O),硫脲(CH4N2S),双酚A (BPA)均购自上海阿拉丁试剂有限公司。异丙醇(TBA)、甲醇(MeOH)和四氯化碳(CCl4)均购自国药集团化学试剂有限公司。所用试剂均为分析纯,无其他处理直接使用。
仪器:BrukerAxs D8 Discover X射线衍射仪,Philips Tecnai G2 20扫描电子显微镜,Shimadzu UV-2550紫外可见漫反射分光光度计,Hitachi F4600荧光光谱仪,上海朗珀UV 2008紫外可见分光光度计,Bruker Tensor 27傅里叶变换红外光谱仪。
2.2. 材料的制备
以BWO-3%制备为例,在一次合成中,将1 mmol的五水硝酸铋[Bi(NO3)3∙5H2O]加到30 mL的乙二醇(EG)中,超声使其溶解。再向其中加0.5 mmol二水钨酸钠(Na2WO4∙2H2O)和0.015 mmol硫脲(CH4N2S)超声溶解。将溶液装入50 mL反应釜中,在180℃条件下水热反应24小时,所得沉淀用去离子水反复离心、洗涤,然后放入恒温干燥箱中干燥12小时,得样品BWO-3%。同样,通过改变硫脲的加入量(0,0.025和0.035 mmol),分别得到样品BWO,BWO-5%,BWO-7%。
2.3. 光催化活性测试
样品的光催化活性通过模拟太阳光催化降解双酚A来评价,所用灯源为500 W氙灯(北京中教金源)。步骤如下:称取0.01 g材料至石英光催化管,加入40 mL双酚A溶液(20 mg/L)超声使其均匀分散。后将溶液转移至暗处磁力搅拌30 min使材料表面和底物分子达到吸附脱附平衡。随后将溶液转移至光源处进行光催化反应,每1 h取一次样,反应4小时。液样经离心后取上清液,通过紫外分光光度计测试其吸光度。记录双酚A吸收峰强度的变化,利用朗伯比尔定律得出其浓度的变化趋势。样品的光催化活性测试在室温下进行。
2.4. 捕获剂实验
参与光催化反应过程的活性物种通过向催化体系中加入不同活性氧物种的捕获剂来实现。其中四氯化碳(CCl4)、甲醇(CH3OH)、氮气(N2)、叔丁醇(TBA)分别为电子(e−)、空穴(h+)、超氧自由基(·O2−)、羟基自由基(·OH)的捕获剂。捕获剂浓度为底物摩尔浓度的1000倍,在暗吸附之前加入体系中。均用紫外分光光度计测试其吸光度。
3. 结果与讨论
3.1. 材料的成分
图1为样品的X射线衍射图谱,从图中可以观察到,与Bi2WO6的标准图谱(JCPDS-39-0256)相比较,
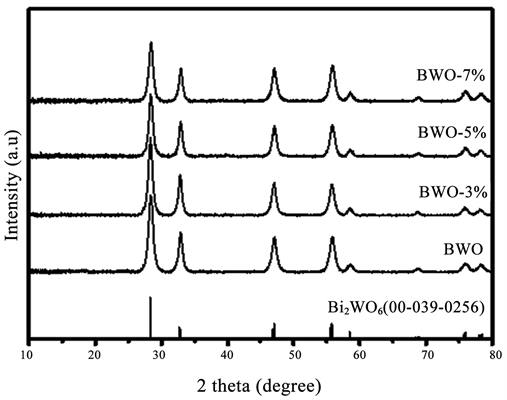
Figure 1. XRD patterns of the samples in range of 10 - 80˚
图1. 样品的XRD图谱
样品BWO、BWO-3%、BWO-5%、BWO-7%的全部衍射峰均可以和Bi2WO6标准谱图一一对应,无其它的杂质峰出现,说明所合成得到的样品为纯度较高的Bi2WO6。且所有样品的峰型尖锐,说明在同一体系下合成的钨酸铋的均具有较好的结晶性。
3.2. 材料的形貌
图2中(a)(c)(e)为样品BWO的SEM图,(b)(d)(f)为样品BWO-5%的SEM图。从图中可得,样品均为大小均一的纳米粒结构,对比BWO和BWO-5%的SEM图发现,两者的结构,形状,大小及聚集程度均类似,说明硫掺杂不会改变样品的形貌。
3.3. 掺杂体系的表征
图3为定量分析的红外光谱图(样品:KBr = 1.5:100,wt%),图中从上至下分别为Bi2S3,BWO,BWO-3%,

Figure 2. The SEM spectra of the as-obtained samples: BWO (a, c and e), BWO-5% (b, d and f)
图2. 所制备样品的SEM图谱:BWO (a,c和e)和BWO-5% (b,d和f)
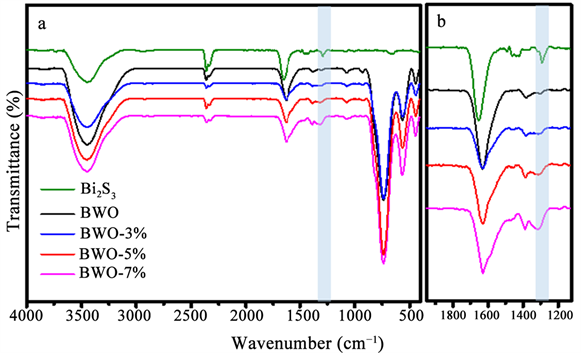
Figure 3. FTIR spectra of the as-obtained samples
图3. 所制备样品的FTIR图谱
BWO-5%,BWO-7%。从图中可得,随着原料中硫脲的逐渐增多,材料在1284 cm−1处的特征峰强度逐渐上升。1284 cm−1处的特征峰能够归属于Bi-S键的伸缩振动。说明在合成过程中随着硫源的逐渐增加,所得材料中Bi-S键逐渐增强,证明了硫掺杂体系的存在。
3.4. 材料的光响应性
光吸收边缘和带隙可以通过紫外–可见漫反射光谱得出。图4为样品的紫外–可见漫反射光谱,由图可知,硫掺杂并对本体钨酸铋材料可将光响应性影响较小,所有样品可见光区具有较强的吸收,且对光的响应性相似。对于半导体催化剂的禁带宽度可以通过Kubelka-Munk方程进行计算:
。其中,α为吸收系数;h为普朗克常数;v为光频率;Eg为禁带宽度;A为常数1。公式中n由半导体的光跃迁类型所确定,对于Bi2WO6半导体的n值为1。如图4(b),计算得材料的禁带宽度均为Eg = 2.3 eV。由此可知,硫掺杂并没有明显改变材料的光响应性,掺杂前后各样品的带隙并没有发生明显变化。
3.5. 载流子特性
图5(a)为样品的荧光光谱图。在光的照射下,半导体材料中的电子受激发与空穴分离发生跃迁,但是仍然有一部分电子会回到基态与空穴复合,电子与空穴复合的过程中部分能量会以荧光的形式散失,因此通过荧光的强弱能够判断电子–空穴复合的几率。由图可知,相比于样品BWO,改性后的样品BWO-3%,BWO-5%,BWO-7%的荧光峰均有不同程度的降低。这一现象说明,通过硫掺杂的钨酸铋材料中电子–空穴复合的几率降低。但随着掺杂量的升高,信号峰强度先降后升,其中BWO-5%的电子-空穴复合几率最低,出现这种现象可能的原因是硫掺杂所形成的内建电场更有利于电子–空穴的有效分离,但是过量的S原子可能作为电子–空穴的复合位点,增加电子–空穴复合几率,因此适量的硫掺杂能够有效提高电子空穴的分离效率。
材料在光的激发下产生的载流子密度能够通过光电流响应进行分析。图5(b)为材料的光生电流响应谱图,从图中可以得到样品的光生电流强度从大到小依次为BWO-5% > BWO-3% > BWO-7% > BWO。其中,与样品BWO相比,改性后的样品BWO-3%,BWO-5%和BWO-7%的光生电子强度要明显提升,说明硫掺杂能够有效的提高材料产生载流子的能力,可能的原因是硫掺杂所形成的内建电场更有利于电子空穴的有效分离,使得光生电子更容易被激发。而相比于BWO-5%,更多硫掺杂量的BWO-7%的光生电流强度下降,可能的原因是过量的硫原子会成为电子空穴的复合位点,使得材料产生的光生载流子减少。

Figure 4. UV-vis absorption spectra (a) and corresponding (ahv)2 versus hv curve (b) of BWO and BWO-5%
图4. 样品BWO和BWO-5%的紫外–可见漫反射光谱(a)和对应的(ahv)2对hv曲线(b)
3.6. 材料的光催化活性
材料的光催化活性通过对双酚A的降解来评价。图6(a)为所制备样品对双酚A (BPA, 20 mg/L)的降解速率图。从图中可得,相较于BWO,BWO-3%,BWO-5%的光催化活性得到明显提升,而BWO-7%的光催化活性明显降低。其中,催化活性最好的样品为BWO-5%,当光照4 h后,有80%的双酚A被降解。可能的原因是硫掺杂提高了材料中电子空穴的分离效率,使更多的光生载流子参与反应。但是过量的硫原子能够作为电子空穴的复合位点,使光催化活性降低。图6(b)为反应的–ln(Ct/C0)-t图。对于一级反应,−dc/dt = kt。则积分式为–ln(Ct/C0) = kt。因此–ln(Ct/C0)-t图中斜率即为反应速率常数k。k值大小反映了化学反应进行的快慢。如图c所示,BWO,BWO-3%,BWO-5%和BWO-7%的反应速率常数k分别为0.15,0.28,0.41和0.09 h−1。因此,适量硫掺杂能有效提高样品的光催化活性,其中硫掺杂量为5%时光催化活性最高。

Figure 5. Steady state PL spectra (a) and phoyocurrent-time response (b) of the samples
图5. 样品的稳态荧光图谱(a)和光生电流响应谱图(b)
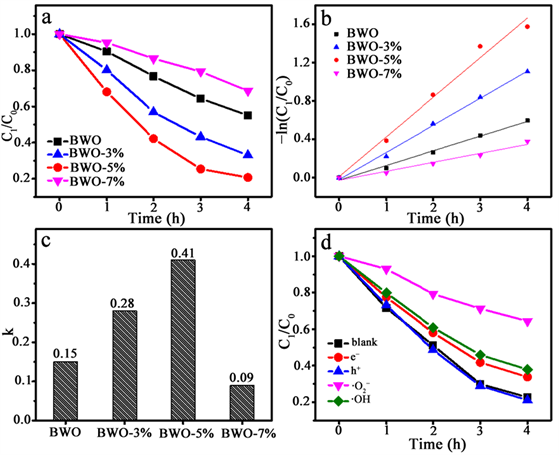
Figure 6. Photocatalytic activities for degradation of BPA in the presence of as-prepared products under visible light irradiation (a), psedo-first order fitting (b), reaction rate constant (c) and trap experiments (d)
图6. 不同样品在可见光下对BPA溶液的降解活性图(a),相应的动力学线性拟合图(b),相应的降解反应速率常数(c)和捕获剂实验(d)
降解过程中不同活性物种的作用通过在反应过程中加入对应的捕获剂实验来研究,其中CCl4、CH3OH、N2和TBA分别为e−、h+、·O2−和·OH的捕获剂。图6(d)为样品BWO-5%对于降解BPA的捕获剂图。从图中可以看出,对于样品BWO-5%,在加入h+的捕获剂后BPA的降解效率没有明显的变化,表明h+不是BPA降解过程中的活性物种。而在加入e−和·OH的捕获剂后,BPA的降解速率受到部分的抑制,表明e−和·OH参与到BPA降解过程中。在加入·O2−的捕获剂后,BPA的降解速率受到明显的抑制,说明·O2−为BPA降解过程中起到主导作用的活性物种。
4. 结论
本工作以硫脲为硫源,通过一步水热法制备得到了硫掺杂的钨酸铋材料,并通过调控原料中硫脲的量实现了不同量的掺杂。以双酚A为降解对象研究了所制备材料的光催化性能。实验结果表明,5%硫掺杂量的钨酸铋具有最佳的光催化活性。其中,可能的原因是硫掺杂形成的内建电场有利于电子空穴的分离,提高了材料中载流子的密度和分离效率,从而提高了材料的光催化性能。