1. 引言
艾滋病(AIDs)亦称获得性免疫缺陷综合症,是由人类免疫缺陷病毒(HIV)感染引起的以T细胞免疫功能缺陷为主的一种危害性极大的传染性疾病。自1981年美国疾病控制中心确认首例艾滋病以来,艾滋病感染人数一直呈爆发式增长。根据联合国艾滋病规划署最新报道的艾滋病2018年疫情数据,目前全球仍有约3690万人感染HIV,其中2017年新增感染者约为180万人,并约有94万人死于与AIDS有关的疾病 [1] 。目前,已被美国FDA批准用于抗HIV临床治疗的药物已超过30种,然而大多数药物存在着抗耐药性差、药代动力学性质不佳或毒副作用大等问题。设计开发高效、低毒且具有良好抗耐药性和药代动力学性质的抗HIV药物至今仍是药物化学领域中极具挑战性的课题。
根据基因差异HIV分为HIV-1与HIV-2两种亚型,全球大部分地区的艾滋病患者均为HIV-1感染,我国艾滋病患者几乎全为HIV-1感染 [2] 。逆转录酶(Reverse Transcriptase, RT)在HIV-1复制过程有着必不可少的作用。针对这一靶标,药物化学家开发了HIV-1逆转录酶抑制剂(Reverse Transcriptase Inhibitors, RTIs)。RTIs分为核苷类逆转录酶抑制剂(Nucleoside Reverse Transcriptase Inhibitors, NRTIs)和非核苷类逆转录酶抑制剂(Nonnucleoside Reverse Transcriptase Inhibitors, NNRTIs)。作为高效抗逆转录病毒疗法(Highly Active Anti-Retroviral Therapy, HAART)的重要成分,NNRTIs具有结构多样、靶点明确、作用机制清楚、高效低毒、副作用小以及可与其他药物协同作用等显著优点,近年来一直是抗HIV药物研发的热点 [3] 。目前,文献报道的NNRTIs种类繁多,其中二芳基嘧啶类化合物(DAPYs)作为第二代NNRTIs因具有高效低毒和抗耐药株活性良好而备受关注 [4] 。该类化合物的代表性药物依曲韦林TMC125和利匹韦林TMC278于2008年相继通过美国FDA批准进入临床治疗。
本研究以TMC125为先导化合物,基于DAPYs的构效关系,用药物化学中常见的3,4-亚甲二氧苯基双环片段替换经典DAPYs的左翼设计得到一个结构新颖的新化合物。
2. 目标化合物的分子设计
2.1. DAPYs的构效关系总结
据文献报道,DAPYs与RT结合呈“U”形 [5] ,通过构象调整来与氨基酸变异的RT形成稳定的复合物。对DAPYs的一系列研究表明:1) DAPYs中二芳基嘧啶结构的存在使得分子具有较好的构象柔性和位置适应性,它可使分子以活性构象与RT稳定结合,表现出较好的HIV-1野生株和耐药株抑制活性 [5] ;2) DAPYs中嘧啶环与右翼对氰基苯基的连接基NH能和Lys101氨基酸骨架中的羰基氧形成氢键,嘧啶环1位上的N作为氢键受体与Lys101氨基酸侧链NH2也可形成氢键。氢键作用区使DAPYs能够在活性空腔中正确定位。DAPYs中嘧啶环2-位对氰基苯胺基结构的存在对其抗HIV活性起着重要作用 [5] ;3) DAPYs中间嘧啶环5位和6位上的取代基可作用于HIV-1RT结合口袋的进入通道,该进入通道发现于2012年 [6] ,作用于该部分的构效关系较为复杂,还需进一步研究;4) DAPYs中嘧啶环与左翼的连接基可以是单原子,如NH,O,CH2,也可以是双原子 [7] ;5) DAPYs中嘧啶环4-位上的左翼芳环与Tyr181、Tyr188、Phe227以及Trp229氨基酸芳香侧链之间产生π-π堆积和疏水作用,通过干扰RT的构象而起作用。嘧啶环4-位的左翼芳环取代基对化合物的抗HIV活性和药代动力学性质有重要影响,是结构改造的重点之一。
2.2. 目标化合物的分子设计
基于DAPYs的构效关系,考虑到3,4-亚甲二氧苯基片段在许多药物中均为重要的药效团 [8] [9] [10] ,本研究以TMC125为先导化合物,在嘧啶环的4位引入体积更大的3,4-亚甲二氧苯基,期望引入的该基团能对HIV-1 RT活性腔穴中的Tyr181和Tyr188的构象起较强的干扰作用,又能与氨基酸残基Trp229发生范德华作用,从而提高目标化合物对HIV-1野生株及变异株的抑制活性。同时,该化合物保留了DAPYs的完整骨架,其左翼苯环上骈合了1,3-二氧戊环结构,有望具有良好的抗HIV-1活性。对其进行结构改造(如图1)。
为了从理论上验证设计的合理性,本研究利用SYBYL Surflex-Dock程序作为分子对接软件,将目标化合物1对接到TMC125/HIV-1 RT复合物结构(PDB:3MEC)中(图2)。结果发现1 (图2(a))与二芳基嘧啶类HIV-1抑制剂TMC125 (图2(b))的作用模式相似,即均以U型构型与HIV-1 RT结合。目标分子
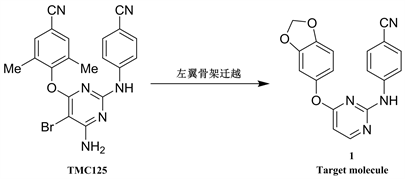
Figure 1. Molecular design of target molecule 1
图1. 目标化合物1的分子设计

Figure 2. Molecular docking of target molecule 1
图2. 目标分子1的分子对接
左翼3,4-亚甲二氧基苯基正好位于HIV-1 RT的芳香性氨基酸残基Tyr181,Tyr188和Trp229等形成的疏水空腔中,并形成π-π堆积作用,同时引入的含氧杂环有可能在一定程度上提高目标化合物的水溶性,改善TMC125水溶性差的缺点。右侧linker NH上的氢原子与Lys101羰基上的氧原子形成氢键作用,嘧啶母环一位的N原子也与Lys101上的氢原子形成氢键作用。分子对接从理论上验证了分子设计的合理性。
3. 目标化合物1的合成
目标化合物1的合成路线如式1所示:起始原料2-硫代脲嘧啶(2)与碘甲烷发生甲基化反应得到中间体2-甲巯基嘧啶-4-酮(3),3与对氰基苯胺在熔融条件下反应得到中间体2-(对氰基苯胺基)嘧啶-4-酮(4),4在三氯氧磷的作用下发生氯代反应得到关键中间体2-(对氰基苯胺基)-4氯-嘧啶(5),中间体5的具体合成过程在本课题组已发表的文献 [7] 中有详尽介绍,在此不再赘述。最后,5与芝麻酚在无水碳酸钾作碱的条件下于二甲基亚砜溶剂中反应得到目标化合物1。
在1的合成过程中,考察了溶剂、温度和反应时间对反应收率的影响,具体条件筛选如表1所示。

Scheme 1. Synthetic route of target molecule 1
式1. 目标分子1的合成路线

Table 1. Screening of reaction conditions
表1. 反应条件的筛选
经反应条件优化后,合成步骤如下:向25 mL两口圆底烧瓶中依次加入0.116 g (0.500 mmol)中间体5、0.069 g (0.500 mmol)芝麻酚和0.476 g (2.00 mmol)无水碳酸钾和5 mL二甲基亚砜,于氩气保护和搅拌下加热至100℃。30 min后TLC显示已经完全反应。待反应液冷却至室温后将其倒入分液漏斗中,加入30 mL水,再加入30 mL乙酸乙酯萃取产物。有机层用饱和食盐水(2 × 25 mL)洗涤。将有机相用无水硫酸钠干燥后抽滤,滤液经旋干后得到0.175 g粗品。将粗品用柱层析纯化,得到0.166 g白色固体,收率89%。1H NMR (400 MHz, DMSO-d6) δ 10.13 (s, 1H),8.41 (d, J = 5.1 Hz, 1H),7.83~7.70 (m, 2H),7.63~7.52 (m, 2H),7.00 (d, J = 8.4 Hz, 1H),6.95 (s, 1H),6.75~6.66 (m, 1H),6.52 (d, J = 4.7 Hz, 1H),6.11 (s, 2H);13C NMR (100 MHz, DMSO-d6) δ 169.80, 159.96, 159.09, 148.02, 146.58, 145.00, 144.67, 132.74, 119.55, 118.44, 114.42, 108.30, 104.21, 102.55, 101.88, 99.67。MS (ESI+):333.71 (M+H)+。
4. 结论
以经典的二芳基嘧啶类HIV-1抑制剂TMC125为先导化合物,将其左翼苯基替换为3,4-亚甲二氧苯基设计得到具有双环左翼的目标化合物1,该化合物未见文献报道。采用SYBYL Surflex-Dock程序进行分子对接验证了设计的合理性。关键中间体2-(对氰基苯胺基)-4-氯嘧啶与芝麻酚反应发生亲核取代反应得到目标化合物1,收率为89%。采用核磁共振氢谱(1H NMR)、核磁共振碳谱(13C NMR)和质谱(MS)表征了其结构。后续研究中该化合物的抗HIV活性评价将在比利时鲁汶大学进行。
基金项目
国家自然科学基金(No. 21877087, No. 21602164);武汉市国际科技合作项目(No. 2017030209020257);武汉工程大学第十二期大学生校长基金(No. 2017006)。
NOTES
*通讯作者。