摘要:
目的:探讨橄榄体脑桥小脑萎缩临床特征及诊断。方法:通过对1例橄榄体脑桥小脑萎缩病人的临床表现、诊断进行分析,并进行文献复习。结果:橄榄体脑桥小脑萎缩早期症状可不典型,结合该患者症状及MR“十字征”做出诊断。结论:橄榄体脑桥小脑萎缩误诊率高,预后差,应引起临床医生重视。
Abstract:
Objective: To investigate the clinical features and diagnosis of cerebral apoplexy atrophy. Methods: The clinical manifestations and diagnosis of a patient with olivine pons cerebellar atrophy were analyzed and literature review was conducted. Results: The early symptoms of cerebral apoplexy atrophy can be atypical, combined with the patient’s symptoms and MR “cross-sign” to make a diagnosis. The olivine pons cerebellar atrophy has a high misdiagnosis rate and poor prognosis, which should be paid attention to by clinicians.
1. 引言
橄榄体脑桥小脑萎缩(OPCA)是以小脑性共济失调和脑干损害为主要临床表现的中枢神经系统变性疾病,是多系统萎缩(MSA)亚型之一。OPCA临床表现复杂多样,早期症状常不典型,误诊率高,且治疗方法有限,预后较差。结合近期我科诊治1例OPCA,并文献复习,报告如下。
2. 病例报告
患者,女性,61岁。患者10月前无明显诱因出现行走不稳,下肢无力,伴头晕,逐渐出现言语不清,行动迟缓,不能完成写字等精细动作。5天前行走不稳、言语不清加重。既往:高血压10余年;脑梗死病史5年,未遗留后遗症。无吸烟饮酒史。无家族史。查体:T:36.5℃,P:76次/分,R:16次/分,BP (卧位):169/98 mmHg,BP (立位):142/85 mmHg,神志清,面部表情僵硬,构音障碍,对答切题,计算力、定向力可,深浅感觉正常,双侧轮替试验阳性,指鼻试验欠稳准,四肢肌力5级,肌张力正常,腱反射活跃,Babinski征、Chaddock征、Oppenheim征阴性。患者血常规、血凝、生化、传染标志物等未见明显异常。颅脑CT:双侧幕上脑白质脱髓鞘。颅脑MRI (如图1,图2):多发腔隙性软化灶(双侧放射冠基底节、丘脑);脑桥、小脑、延髓萎缩。头颈部CTA:头臂干分叉处及双侧颈内动脉粥样硬化。肌电图:未见明显异常。临床诊断:橄榄体脑桥小脑萎缩 脑梗死 高血压。入院后给予抗血小板、降压、改善循环等对症治疗,症状未见明显好转,住院7天后出院。
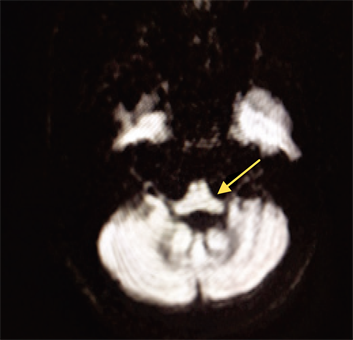
Figure 1. Pons, cerebellar atrophy (arrow)
图1. 脑桥、小脑萎缩(箭头处)
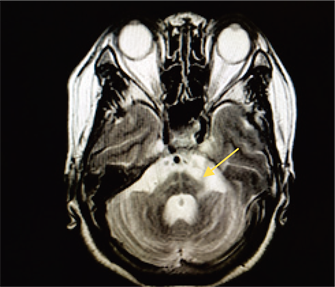
Figure 2. T2 image Pons “cross sign” (arrow)
图2. T2像可见脑桥“十字征”(箭头处)
3. 讨论
橄榄体脑桥小脑萎缩(OPCA)是一种原因不明的中枢神经系统变性疾病,属于多系统萎缩(MSA) 3个亚型之一,也称为MSA-P型。该病1891年由Menzel最早报道,1900年由Dejerine、Thomas首次命名。OPCA的病理改变主要表现为小脑、脑桥、下橄榄核萎缩,神经细胞减少和胶原细胞增生、脊髓后束、皮质脊髓束、脊髓小脑束和橄榄脊髓束变性 [1] 。病理诊断的特异性标志是胶质细胞和神经细胞胞浆内及核内的包涵体 [2] 。
OPCA可分为两种类型:1) 家族型,青中年起病(多<30岁),多为常染色体显性遗传;2) 散发型,多中老年起病(多>50岁)。本例患者无家族史,60岁以后发病,为散发型。OPCA以小脑性共济失调和脑干损害为主要表现,可伴有帕金森病症状、自主神经功能障碍、锥体束征等,起病隐匿,临床症状复杂多样。早期多为小脑功能障碍,如站立不稳、左右摇摆、共济失调、头晕、眼震、构音障碍等。杜文津等 [3] 研究152例OPCA患者中,小脑症状占首发症状的64.3%、所有症状体征的50.6%。行走步态不稳最常见,常伴有小脑性构音障碍及眼球运动障碍。OPCA患者可出现帕金森病运动症状,如行动迟缓,宽基底步态,面部表情减少,精细动作不能完成等。OPCA多伴有自主神经功能障碍,如直立性低血压、弛缓性膀胱(尿失禁或潴留)、性功能障碍及出汗障碍等 [4] 。有研究 [5] 表明无论是否以锥体外系或小脑受累为主要临床表现,自主神经症状总是在之前或与之同时出现。早期的肛门括约肌肌电图及脑干诱发电位有利于本病的诊断 [6] 。本例患者以小脑功能障碍起病,表现为行走不稳、下肢无力,伴头晕,逐渐出现言语不清、表情僵硬、精细动作不能完成等症状,伴体位性低血压,查体见构音障碍、轮替试验及指鼻试验阳性,符合OPCA的临床表现。
OPCA诊断金标准仍为病理诊断,目前难以活体取材,因此其他辅助检查更具意义。其中颅脑MRI对后循环成像清晰、分辨率高、无创、便于随访,在OPCA诊断上具有重要价值。有研究 [7] 报道37例OPCA患者MRI,34例(92%)可见小脑萎缩,23例(72%)可见脑干萎缩,10例(28%)可见额、顶叶萎缩。可见MRI对OPCA患者小脑、脑干病变部位发现率较高。OPCA头颅MRI 主要征象有:① 脑干萎缩、形态变细,尤以脑桥腹侧变平、前后径缩小更明显;② 小脑萎缩,半球小叶沟、裂增宽加深,呈“枯树枝状”;③ 脑池及脑室扩大,以桥前池增宽最为明显;④ 脑实质一般无异常信号;⑤ 晚期T2WI上可出现脑桥的十字形高信号影即“十字征”,被认为对OPCA的诊断有决定性意义 [8] 。Savoiardo等 [9] 首先报道“十字征”,认为其产生机制是脑桥核及桥横纤维变性,胶质增生致含水量增加,而由齿状核发出的构成小脑上脚的纤维和椎体束未受损害。本例患者颅脑MRI可见脑桥、小脑体积缩小、脑沟增宽,T2WI上脑桥内见“十字征”,脑室、脑池、脑沟增宽,符合OPCA影像学特征。Horimoto等 [10] 把“十字征”的演变过程分为6期:0期为正常;I期为脑桥开始出现垂直的高信号影;II期为出现清晰的垂直的高信号影;III期为继垂直线后开始出现水平高信号影;IV期为清晰的垂直线和水平线同时出现;V期为水平线前方的脑桥腹侧出现高信号,或脑桥基底部萎缩引起腹侧脑桥体积缩小。有报道42例OPCA,观察发现16例OPCA患者在起病的2~3年内均逐渐出现垂直的高信号影(I期);5年内71%的患者出现“十字征”(IV期);7年内所有患者达V期。本例患者MRI垂直线和水平线清晰,且腹侧脑桥体积缩小,按照Horimoto分期达Ⅴ期。但也有文献 [11] 报道,在MSA的其他两型:黑质纹状体变性(SND)和Shy-Drage综合征(SDS)中也有“十字征”类似征象。
OPCA目前尚无特效疗法,以对症治疗为主。多数预后不良,过半数患者在出现运动症状5年内瘫痪,平均生存时间6年左右,仅20%患者病程超过12年。患者晚期活动受限,需长期卧床,主要死因多为肺部感染、泌尿系感染、褥疮、深静脉血栓等。
OPCA早期诊断困难,易与帕金森病等混淆,有文献 [12] 报道误诊率高达55%。早期单纯小脑症状时,难与其他特发性小脑共济失调相鉴别,如有4年内出现自主神经功能障碍或帕金森样症状有助于提示诊断 [13] 。本例患者于外院诊断为脑梗死,对症治疗后未见好转。本文通过分析1例OPCA患者病例,并结合文献复习,以期提高临床医生对此病的认识。
申明
该病例报道获得病人家属知情同意。
NOTES
*第一作者。
#通讯作者。