1. 引言
碳酸二苯酯(DPC)是合成制造塑料聚碳酸酯的主要中间体,在工业生产中有很广泛的用途。国内外DPC的主要合成路线有光气法 [1] 、酯交换法 [2] 、苯酚氧化羰基化法等。现阶段国内生产DPC的主要途径为光气法,但光气为有毒有害气体,会对环境造成污染,且由于其强腐蚀性会腐蚀生产设备,导致生产成本大大增加。酯交换法由于副产物较多,导致产物分离工艺复杂,反应耗能较大。苯酚氧化羰基化法 [3] 是由苯酚、CO、O2在催化剂的作用下一步制得DPC的绿色合成线路,它具有转换率高,污染小等优势。近年来过渡金属氧化物负载的贵金属催化剂因良好的低温氧化还原性能成为科研热点。锰氧化物 [4] 拥有较好的储氧和放氧能力,能够在不同价态之间转换从而进行快速的氧化还原反应,使锰氧化物 [5] 成为较为优质的载体材料。银具有价格相对低廉、易加工低温活性较好等优点,可以作为很好的掺杂金属。本文制作三种不同形貌Ag-MnO2载体并利用H2-TPR、TEM和XRD测试手段对催化剂的形貌、组成和氧化还原性进行了表征。并以金属钯为活性组分,将钯负载于载体后,对其进行活性测试。
2. 实验部分
2.1. 载体的制备
海胆状Ag-MnO2载体的制备:称取2.74 g过硫酸钾并溶解完全,将2.8 g MnSO4固体和1.74 g硫酸钾固体加入已溶解好的过硫酸钾溶液中,等待完全溶解后加入0.31g硝酸银固体,在60℃水浴锅中缓慢加热0.5 h后静置12 h。真空抽滤,得到白色固体,依次使用蒸馏水,乙醇洗涤三次。将产物在400℃条件下干燥12 h,将其记为Ag-MnO2 urchin。
线状Ag-MnO2载体的制备:将0.338 g MnSO4∙H2O和1.68g NaHCO3分别溶于140 mL去离子水中,在MnSO4溶液中加入14 mL乙醇搅拌均匀,将两种溶液混合继续搅拌,随后,将2.642 g (NH4)2SO4加入到上述混合溶液中继续搅至溶解,在50℃条件下维持6 h。将反应得到的白色沉淀收集,抽滤并用无水乙醇洗涤,所得产物在90℃下干燥12 h。将一定量MnCO3固体溶于去离子水中,投入0.05 M的高锰酸钾溶液,在600℃下搅拌30 min。将所得的混合溶液转入不锈钢反应釜中,170℃下反应14 h。将反应釜中的物质抽滤、洗涤、干燥。将0.03 g AgNO3溶于蒸馏水中配成0.01 M的AgNO3溶液,随后加入上述方法制备的二氧化锰粉末搅拌1 h,取硼氢化钠0.5 M作为还原剂加入到上述混合液中,继续搅拌1 h,将得到的固体样品离心洗涤,在60℃烘箱中干燥12 h,将其记为Ag-MnO2 wire。
棒状Ag-MnO2载体的制备:将1.25 KMnO4和0.53 g MnSO4∙H2O固体溶解在80 mL去离子水中,搅拌30 min后移至100 mL反应釜中制得MnO2,在温度为160℃条件下反应12 h。将0.05 g AgNO3溶于蒸馏水中配成0.01 M的AgNO3溶液,随后加入上述二氧化锰粉末搅拌2 h,取一定量水合肼作为还原剂加入到上述混合液中,继续搅拌2 h,最后将得到的产物离心洗涤,在800℃烘箱中干燥12 h,制备的棒状银锰氧化物记为Ag-MnO2 rod。
2.2. 催化剂的制备方法
选用PdCl2作为活性Pd源,Pd负载量为载体质量的0.5%。准确称取所需质量的PdCl2,加入一定体积的去离子水中,用盐酸调pH值直至PdCl2完全溶解形成棕色溶液,加入载体搅拌30 min后用1 mol/L的NaOH溶液调节至pH值为9~10,搅拌30 min后滤出载体。用上述方法得到的催化剂用去离子水洗涤3次,并在烘箱110℃环境下烘干12 h后在马弗炉中300℃焙烧3 h即制得催化剂。
2.3. 催化剂的表征仪器
催化剂的物相及晶型由德国BRUKER公司生产的D8ADVANCE型X射线衍射仪(XRD)测得。辐射源是CuKα射线,管流和管压分别为40 mA和40 kV,扫描范围为10˚至80˚,扫描速率为每分钟10˚。
催化剂的氧化还原性采用美国Micromeritics公司生产的Auto Chem 2920化学吸附仪进行检测:将U型石英管中放置样品70 mg,在一定温度的氮气保护下(30 mL/min)通入样品及1 h后降低至25℃。待检测信号平稳后,在H2/Ar(1:9)的还原气混合气环境下,以8℃/min的速度升温至800℃并用TCD检测信号进行检测,即所得催化剂氧化还原性的H2-TPR图谱。
催化剂的表面形貌FEI Tecnai G2 F30型高分辨透射电镜(TEM)测得,观察样品的微观形貌、颗粒大小。将少量样品研成粉末,并分散于无水乙醇中超声分散30分钟然后,滴加适量于电镜承载样品的铜网上,待自然晾干后将铜网放入电镜中进行观测。仪器参数2.04Å分辨率,放大率30万倍,加速300 kV电压。催化剂表面元素的类别及含量由能量色散X射线光谱仪(EDAX)探测。
2.4. 催化剂的活性测试
氧化羰基化反应在250 ml的高压间歇反应釜中进行。苯酚50.0 g、4A分子筛2 g、四丁基溴化铵(TBAB) 1 g以及制备的催化剂2 g加入到反应釜中。将CO和O2(CO/O2 = 9/1)充满整个反应釜,总压为5.5 MPa,加热反应釜。在75℃下反应4 h,搅拌器转速为600 r∙min−1。反应结束后,产物在GC-8000型(北京)气相色谱仪中通过毛细管柱进行分离,采用氢火焰进行检测分析,利用面积校正归一法计算DPC收率 [6] 。
3. 结果与讨论
3.1. XRD表征
图1为不同银锰氧化物的XRD图,d为未掺杂Ag的锰氧化物α-MnO2平滑后的XRD曲线。通过与标准谱图(JCPDS42-1349)比对,a、b、d样品在2θ = 28˚,37˚,41˚,50˚,59˚均出现衍射峰,与K2−xMn8O16的特征衍射峰位置一致,说明银的加入未改变海胆及线状MnO2晶型。在a、b、c样品中均在65˚出现了Ag(220)和Ag(311)晶面的衍射峰,这说明Ag粒子在锰氧化物的表面形成了固定的晶相。相比于纯的K2-xMn8O16,AgMnOx-urchin、AgMnOx-wires样在37˚的峰强有稍许增强,表明在这些样品中银锰之间形成了相互作用。
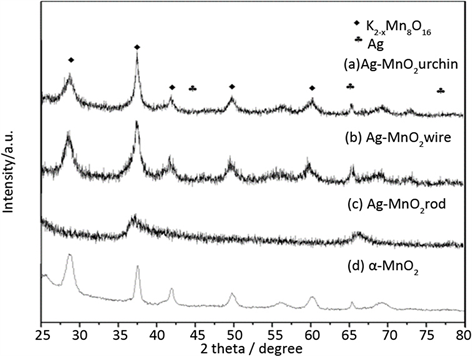
Figure 1. XRD spectra of different supports
图1. 不同载体的XRD图谱
3.2. 载体H2-TPR表征
图2为不同形貌锰氧化物和α-MnO2的H2-TPR谱图,从图可以看出,4个样品都出现了两个强的峰,温区较低归属于Mn4+的还原峰 [7] ,高温区的为Mn3+还原峰。在α-MnO2样中,Mn4+的还原峰出现在330℃~410℃的温区。相比于α-MnO2,Ag-MnO2 urchin、Ag-MnO2 wire和Ag-MnO2 rod的Mn4+还原峰向低温区产生了不同程度的偏移,这说明银的参杂增强了α-MnO2的氧化还原性能。而苯酚氧化羰基化合成DPC一般在温度为50℃~100℃下反应速率较快,其中反应的活性组分为Pd2+,低温下氧化还原性的提高有利于Pd2+的氧化再生,提升催化剂的性能。Ag-MnO2 urchin、Ag-MnO2 wire和Ag-MnO2 rod的Mn4+还原峰分别出现在285℃~305℃、290℃~310℃和295℃~340℃,其中Ag-MnO2 urchin有更好的氧化还原性。

Figure 2. H2-TPR profiles for different morphology of AgMn oxides and MnO2
图2. 不同形貌银锰氧化物和MnO2的H2-TPR谱图
3.3. 载体TEM表征
图3~图5的TEM图像为不同形貌银锰氧化物透射电镜图。从图3中可以看出,Ag-MnO2 urchin银锰氧化物形貌为海胆状,其直径约为1~2 μm,其中银粒子很好的镶嵌在二氧化锰载体表面海胆型结构的触须上,微晶尺寸约为40至80 nm。图4 Ag-MnO2 rod为棒状的银锰氧化物,其直径约为40 nm,从b中可以看出粒径约为20 nm纳米银粒子不规则的分布在MnO2纳米棒表面。图5为线状Ag-MnO2 wire形貌及银粒子的分布情况,直径大约为25~35 nm半球形、小颗粒的银粒子均匀地分散在线状MnO2表面,其粒径大约为8 nm。比较三种不同类型的Ag-MnO2载体的形貌及Ag在锰氧化物上分布的情况,可以看出微观结构较复杂Ag-MnO2 urchin载体能促进Ag与锰氧化物更好地结合。

Figure 3. TEM of Ag-MnO2 urchin
图3. Ag-MnO2 urchin透射电镜图

Figure 5. TEM of Ag-MnO2 wire
图5. Ag-MnO2 wire透射电镜图
3.4. 催化剂的活性评价
将三种形貌催化剂应用于氧化羰基化,反应结束后抽滤,洗涤后,将滤渣进行二次反应,所得活性评价如表1。不同形貌锰氧化物载体的催化剂催化活性和催化剂寿命并不相同。Ag-MnO2 urchin催化活性更高,这是因为其特殊结构能使银较好的镶嵌在二氧化锰表面;但催化能力下降较快,是因为Ag-MnO2 urchin形貌较为复杂,在氧化羰基化的反应条件下微观形貌会有所改变导致的。银的加入能提高二氧化锰的还原性,故银掺杂的二氧化锰的催化活性高于α-MnO2载体的催化活性。

Table 1. The catalytic performance of different morphologies of Pd/AgMnOx and Pd/α-MnO2 catalyst
表1. 不同形貌Pd/AgMnOx和Pd/α-MnO2催化剂的催化性能
4. 结论
载体形貌的差异导致载体的氧化还原性能的差异,高的氧化还原性能对于氧化羰基化中Pd2+的氧化再生至关重要。本文制作了不同形貌的银锰氧化物载体,探究了载体形貌对苯酚氧化羰基化的影响。RXD表征显示银的掺杂并没有改变海胆、线状α-MnO2的晶型。TEM表征看出,海胆状载体的特殊结构使银锰结合更为紧密,通过H2-TPR图谱得出,银的掺杂不同程度增强了α-MnO2的氧化还原性,氧化还原性的强弱具体表现为:Ag-MnO2 urchin > Ag-MnO2 wire > Ag-MnO2 rod > α-MnO2。在不同载体负载活性组分钯后,经过活性测试结果,发现银的掺杂提升了催化剂活性。不同形貌的Pd/AgMnOx催化剂在苯酚氧化羰基化反应中的催化活性分别为:海胆状20.4%;线状18.7%;棒状15.8%。
致谢
本人由衷感谢学校,感谢武汉工程大学绿色化工过程教育部重点实验室提供的实验环境与科研氛围,同时也感谢诸位老师的悉心指导。