1. 引言
鲍曼不动杆菌广泛分布于医院环境,主要引起菌血症、尿路感染、继发性脑膜炎、手术部位感染、医院或呼吸机相关的肺炎等感染,特别是对于重症监护病房的病人来说具有较高的致死率 [1] 。由于近年来抗生素等药品的广泛应用,使得鲍曼不动杆菌耐药性迅速增强,直至今天鲍曼不动杆菌对几乎所有的抗菌药物产生了耐药性 [2] [3] 。而医院用水量及产生的废水量都很巨大,水环境较为复杂。鲍曼不动杆菌的适应性极强,而医院的这种水环境为细菌的繁殖提供了非常有利的条件。此外,医院排出的废水、废弃物中的鲍曼不动杆菌并未完全灭活,仍具有一定的感染性。
生物膜是由浮游细菌引起,由微生物聚集成多细胞结构中形成的,可以粘附于多种物质的表面。生物膜的形成可以保护细菌较少的受到外界环境变化的影响,可以阻止抗菌药物进入并伤害生物膜深层的细菌,为细菌提供了生理优势和防御条件 [4] [5] 。鲍曼不动杆菌的生物膜结构使它更难以被灭活。
由于细菌生物膜的存在难以灭活,因此用一些新的高效的治疗方法来处理生物膜,其中包括大气压力等离子体射流。等离子体是由电子、离子和中性粒子组成的电离气体,可产生大量的荷电和活性物质 [6] 。这些等离子体活性物质可引起脂质、蛋白质、DNA等的破坏,导致细胞结构的破坏 [7] 。
至今为止,关于等离子体失活鲍曼不动杆菌生物膜及其相关机理的研究很少。本研究中,利用等离子体射流对鲍曼不动杆菌生物膜进行了灭活实验,通过细胞可培养能力、代谢能力、和胞内ROS含量等对等离子体失活效果和对生物膜相关生物学性能进行了评价 [8] 。
2. 实验材料与方法
2.1. 氦气等离子体射流
大气压等离子体射流的装置示意图如图1所示。石英管的总长度为80 mm,内直径为2 mm,外直径为4 mm。玻璃管的一头为封闭,另一头通入2 mm外径的铜棒,铜棒的总长度为100 mm,铜棒上接高压脉冲直流电源。电源的电压为0~30 kV可调,频率为0~2 kHz,脉宽为1~5 μs可调。外围利用聚四氟乙烯作为外壳包裹,喷口为一个外径6 mm,内径4 mm的石英玻璃管。
氦气(99.99%)以500 L/h的流量从两个进气口进入放电区。Tektronix MSO 5104数字示波器配备了高压探头(Tektronix P6015A)和电流探针(Tektronix P6021)用于检测放电时的电压和电流。氦气等离子体射流的发生光谱通过光谱仪(AvaSpec-2048)检测。
2.2. 鲍曼不动杆菌生物膜的制备
实验中所用的鲍曼不动杆菌由安徽医科大学第一附属医院提供。将鲍曼不动杆菌菌株(A. baumannii)在37℃和220转/每分钟搅拌条件下,在LB培养液中培养24 h。将培养好的菌液通过稀释调配至1 × 107细菌/ml。为了制备生物膜,以1:100的比例将细菌悬浮液与LB混合,并将其培养在硼硅酸盐片上,然后将硼硅酸盐片置于24孔板(polystyrene, Costar 3524, Corning, NY, 1 slice/well)中,然后,在37℃的环境中静置培养24 h [9] 。培养时间结束后,将硼硅酸盐片取出,用无菌盐水冲洗生物膜,以达到去除浮游生物和附着的细菌的目的。最后,将硼硅酸盐片置于37℃的恒温培养箱中,去除生物膜表面的水分。
2.3. 等离子体处理
将等离子体射流喷嘴固定在生物膜上方6 mm处,此时的等离子体射流可以覆盖整个生物膜。等离子体处理时间分别为5 min、15 min、30 min。同时将一个没有经过等离子体处理的空白样品作为对照组,以消除干燥引发的抗菌作用。
2.4. 可培养性
利用平板涂布法培养细菌 [10] ,然后根据LB琼脂平板上生长的CFU的计数,评估了鲍曼不动杆菌生物膜的可培养发育能力。将等离子体处理后的鲍曼不动杆菌生物膜置于1 ml去离子水(dH2O)中。然后将100 μl的稀释液滴入LB琼脂平板中。将琼脂平板放在37℃的恒温培养箱中孵育24 h。根据计算培养后的菌落数量来判定对鲍曼不动杆菌生物膜的抑菌效果。
2.5. 细胞代谢能力
将处理后的生物膜加入有800 μl无菌水的离心管中,离心管在超声波清洗仪中超声1分钟,超声强度为50 kHz。通过超声的方法使细菌从生物膜中分离,在离心管中形成细菌悬浮液。染色时,用10%的刃天青染色剂与细菌悬浮液均匀混合,在37℃的避光环境中以每小时90转的转速培养3.5小时。之后,将刃天青与细菌悬浮液的混合液移至96孔酶标板中,每个孔内移入200 μl。并且在孔板中加入没有细菌的dH2O作为对照样品。
刃天青(7-hydroxy-3H-phenoxazin-3-one 10-oxide)是一种已知的蓝色的非荧光染料。使用刃天青染料染色鲍曼不动杆菌生物膜时,刃天青染液进入生物膜中的活细胞时,因为活细胞还具有代谢能力,刃天青可以与其中的多种还原酶反应,从而被还原成粉色的试卤灵,之后细胞中的还原酶继续将试卤灵还原成白色的二氢试卤灵。而死亡的细菌不再拥有新陈代谢的能力,因此细胞不能产生还原酶与刃天青发生反应,刃天青不再被还原 [11] 。以此为依据,可以根据刃天青染色细菌后的荧光强度的变化来判断其新陈代谢能力。本文中使用全自动定量绘图酶标仪(Ex/Em分别为560/590 nm)测定染色后的荧光强度值。分析数据得到等离子体处理不同时间后生物膜中的鲍曼不动杆菌代谢能力的变化。
2.6. 胞内活性氧(ROS)
细胞内活性氧的含量使用全自动定量绘图酶标仪来测定。
H2-DCFDA染料与dH2O的稀释比例为1:499,稀释混合后的染料与离心管里的细菌悬浮液分别加100 μl进入96孔酶标板,使之在孔内混合均匀。在37℃的避光环境中静置培养25分钟后以同样的波长使用全自动定量绘图酶标仪来测量其数据 [12] 。
之所以可以用2,7-二氯二氢荧光素双乙酸探针(H2-DCFDA)染色来测定鲍曼不动杆菌细胞内活性氧的含量是因为该染色剂进入细胞内后会被细胞酯酶脱乙酰化形成一种非荧光化合物,随后该化合物被细胞内活性氧(ROS)氧化成2,7,二氯荧光素(DCF),所以不同状态下的细胞其荧光强度不同。
2.7. 统计分析
每项实验至少重复三次,一式三份。CFU计数结果改为log 10∙ml−1。采用t检验确定显着性,Ap值的显着性水平小于0.05。经过至少9次试验,计算得到的平均值和标准差(SD),误差条表示平均值的标准偏差。
3. 结果与讨论
3.1. 等离子体射流特征
等离子体射流输入电压为15 kV,频率为2 kHz,电流峰值约为1 A,等离子体的平均功率约3.8 W。利用光谱测量(OES)检测氦气等离子体主要活性物质种类和相对强度 [13] 。在200~1050 nm波长处的观测结果如图2所示:主要由He发射谱线,OH谱线(306~310 nm),以及激发的原子氧(777.2和844.6 nm)。活性物质在细胞失活中起着重要的作用。因此,等离子体射流产生的活性氧能有效地破坏微生物结构,达到良好的失活效果。
3.2. 可培养发育能力
鲍曼不动杆菌的可培养发育能力可以根据琼脂平板上形成的细菌菌落单位(CFU)来计算。图3表示常压脉冲等离子体处理0~30 min后生物膜中具有可培养性的鲍曼不动杆菌菌落单位(CFU/ml)的变化。未经等离子体处理的生物膜,其中的鲍曼不动杆菌数量为7.37 ± 0.143 log10CFU/ml。随着处理时间的增长,5 min后生物膜中的菌种数量为5.95 ± 0.167 log10CFU/ml。随后,当处理时间达到15 min时,生物膜中细菌数量的下降趋势稍有减缓,这时细菌数量为5.16 ± 0.126 log10CFU/ml。等离子体处理时间达到30 min后,细菌数量的变化不再明显,此时生物膜中的菌种群数为3.37 ± 0.118 log10CFU/ml。
Ahmed Chebbi等人研究表明经等离子体处理后的细胞死亡率达到70% [14] 。在本实验中处理30 min后细菌的灭活率可以达到(99.94 ± 0.28)%。
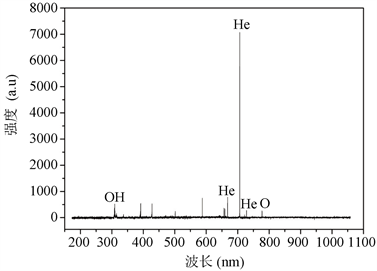
Figure 2. Emission spectra of helium plasma discharge power at 3.8 W
图2. 氦气等离子体放电功率在3.8 W下的发射光谱

Figure 3. Survival curve of Acinetobacter baumannii in biofilm after plasma treatment. *represents an average of nine values ± sd (standard deviation)
图3. 等离子体处理后生物膜中鲍曼不动杆菌的存活曲线。*代表9个值的平均值 ± sd (标准差)
3.3. 细胞代谢能力
由全自动定量绘图酶标仪在Ex/Em为560/590 nm处测得数据,整理并绘制该柱状图。图4表示氦气常压脉冲等离子体处理不同时间后生物膜中具有新陈代谢能力的鲍曼不动杆菌的百分比。未经等离子体处理时100%的细菌都具有代谢能力。等离子体处理5 min后生物膜中48.9%的鲍曼不动杆菌具有新陈代谢能力,由此得到,生物膜中超过一半的细菌失去新陈代谢能力。随着等离子体处理时间的再次增长该百分比的下降趋势减缓。当处理时间达到30 min时,生物膜中仅有20.3%的鲍曼不动杆菌具有新陈代谢能力。
由图3与图4相比可以看出,等离子体处理5分钟后,细菌就灭活了99.99%,但是生物膜中细菌的新陈代谢能力仍有大约50%。由此判断,细菌虽然失去了可培养发育能力,但仍具有代谢能力,即进入了一种可存活但不可培养状态(VBNC)。VBNC状态是细菌面对氧化应激,温度,湿度等环境因素的改变时使用的一种生存方法 [8] [15] 。等离子体射流也是一种外部环境威胁,它能放电产生大量的ROS作用并影响到细胞,对细菌的生存产生了威胁,因此可能这种外部压力会迫使细菌进入了VBNC状态。
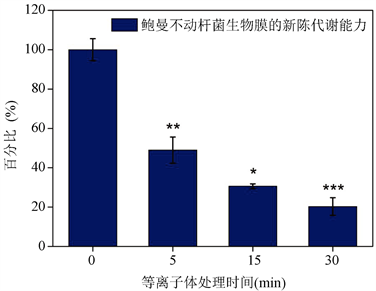
Figure 4. The metabolism of Acinetobacter baumannii in plasma treated biofilms was determined by fluorescence intensity (Ex/Em: 560/590 nm). *represents an average of nine values ± sd (standard deviation)
图4. 用荧光强度(Ex/Em:560/590 nm)测定等离子体处理后生物膜中鲍曼不动杆菌的新陈代谢能力。*代表9个值的平均值 ± sd (标准差)
3.4. 胞内活性氧(ROS)
细胞内活性氧的浓度与细菌失活密切相关。图5,表示等离子体处理后细胞内活性氧浓度(Ex/Em:488/525 nm)的变化。
图5显示随着等离子体处理时间的增长,细胞膜的表面荧光强度呈现出先增强后下降的趋势。等离子体放电会产生大量活性氧进入细胞内部,破坏细胞结构。由于细菌本身对外部环境的刺激具有应激反应,当等离子体处理生物膜时,细菌内部产生胞内ROS以抵抗外部的压力,单个细菌内ROS浓度会迅速上升。随着等离子体处理时间的增长,高浓度的活性氧使得细胞被破坏,因此,总体的活性氧浓度开始降低。
4. 结论
1) 氦气等离子体处理能有效地灭活生物膜中鲍曼不动杆菌,是因为它能产生大量的活性物质可以导致细胞壁裂解。这些等离子体活性物质通过氧化细菌组分导致细胞裂解,在细菌失活过程中起着重要作用。
2) 生物膜中鲍曼不动杆菌的代谢能力与细胞内酶有密切的关系。等离子体产生的活性氧对酶系统的功能有一定的影响。因此,这就是为什么细菌丧失了可培养能力,却拥有新陈代谢能力。
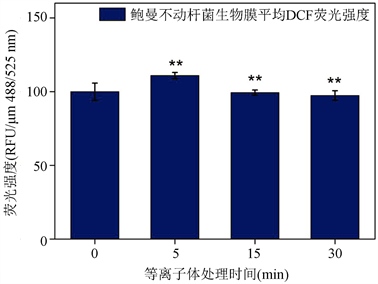
Figure 5. Changes of intracellular reactive oxygen species concentration after plasma treatment. *represents an average of nine values ± sd (standard deviation)
图5. 等离子体处理后细胞内活性氧浓度的变化。*代表9个值的平均值 ± sd (标准差)
3) 等离子体产生的活性氧能够穿透生物膜,并破坏细菌的膜结构。
4) 随着等离子体处理时间的增加,生物膜中的鲍曼不动杆菌不断被破坏。
基金项目
感谢国家自然科学基金资助项目(No. 51541807, No. 51777206);安徽省自然科学基金,1708085MB47,1708085MA13;合肥工业大学博士科研专项资助项目(No. JZ2016HGBZ0769);合肥工业大学博士专业研究基金JZ2016HGBZ0768,JZ2017HGBZ0944。
NOTES
*通讯作者。