1. 引言
水泡状胎块(hydatidiform moles)是一组与妊娠相关的滋养细胞疾病,以雌异配体性或雄性异型或雄性异型的发生(diandric diploid conceptus)分为完全性水泡状胎块(complete hydatidiform moles, CHM)和部分性水泡状胎块(partial hydatidiform moles, PHM)两种类型。CHM、PHM、水肿流产的水肿绒毛、形态结构异常(非胎块)绒毛病变等不同性质的病变在组织学形态上存在一定重叠 [1] - [6] ,并且随着临床影像学检查手段的普遍应用使得大部分怀疑水泡状胎块病人得到手术干预提前,使得部分病例标本,尤其是早期和早早期水泡状胎块缺乏典型的组织形态学改变,进一步加大了诊断和鉴别诊断难度。早期水泡状胎块即使对于具有最好诊断技能的病理医师也是一种挑战 [7]。我们对78例水泡状胎块进行临床病理观察和免疫组化,以期对水泡状胎块进行正确诊断和分型,从而使患者能够得到及时的治疗和干预。
2. 材料与方法
2.1. 材料
78例水泡状胎块标本来自五家医疗单位,37例为我院病理科2010~2017年间存档资料中作者经历病例,41例来自作者受聘的3家医院和1家外检公司诊断病例。临床资料和大体描述来自病理送检单记录。标本均经常规甲醛固定,逐级乙醇脱水,石蜡包埋,常规制片,HE染色,光镜观察。免疫组化资料37例为送检单位诊断原始切片,41例另选有代表性蜡块1个,切片3张,行HE和p57及ki-67免疫组化染色。选取水肿绒毛10例和正常绒毛10例作为对照组。
2.2. 方法
2名病理医生共同阅片。参照2004年WHO分类标准及相关文献病变分为完全性水泡状胎块部分性水泡状胎块 [8]。以末次月经第一日延后2周为起始日,刮宫时间为终止日,完全性水泡状胎块分为经典型(12周以上)、早期(8~12周)和早早期(不足8周)。免疫组化鼠抗人单克隆抗体p57 (克隆号:57P06)、ki-67和SP试剂盒均购自福州迈新生物技术开发有限公司。免疫组化采用SP法,以PBS代替一抗作为阴性对照,以已知阳性病例组织作为阳性对照物。结果判定标准:p57kip2蛋白和ki-67阳性染色定位于细胞滋养层细胞核,以细胞核出现清晰的棕黄色颗粒定为阳性;“-”为无明显阳性细胞;“+”为阳性细胞占5%~25%;“++”为阳性细胞占26%~50%;“+++”为阳性细胞 > 50%。采用SPSS 11.5统计软件,计数资料应用χ2检验,等级资料比较用Ridit分析。
3. 结果
3.1. 一般资料
患者年龄从21~49岁,平均年龄32.7岁。在诊断为水泡状胎块时,CHM的β-HCG平均值301,920.46 mIU/ml (13,000~2,580,000 mIU/ml)较PHM的β-HCG平均值125,806.38 mIU/ml (3680~763,000 mIU/ml)高;CHM的平均孕周为10 + 3 W,PHM为10 + 4 W。
3.2. 病理改变
1) 完全性水泡状胎块46例,其中经典型16例,早期22例,早早期8例。巨检经典型可见明显水泡,水泡1~5 mm大小,透明,间有纤细的纤维组织连接,状似葡萄。早期和早早期水泡不明显或无水泡。镜检经典型绒毛为单一水肿绒毛,绒毛内无血管或很少血管,中央池形成,滋养细胞增生明显,大部分环绕绒毛,也见于绒毛间,且有不典型性,不见妊娠囊、羊膜、脐带和胚胎。早期绒毛呈复杂球茎状突起(花椰菜样),绒毛间质非水肿性或轻度水肿,可呈嗜碱性粘液样,富于细胞,常见间质凋亡和核碎裂,绒毛间质内可见迷宫样的未成熟性血管网,绒毛和绒毛板下灶状的CT和ST增生,并有非典型性滋养细胞(图1)。早早期与早期的病变相比较,间质嗜碱性粘液样更明显,血管生成呈细胞索,常见环形滋养细胞出芽和增生,核碎裂和凋亡百分比更高(图2)。
2) 部分性水泡状胎块32例,镜检有两种水肿和间质纤维化绒毛,绒毛外缘不规则,锯齿状,形成小圆而规则的假包涵体,滋养细胞轻度局限性增生,间质中可见分支小管状毛细血管网,较少扩张,常含有核红细胞,可见胚胎/胎儿成分(图3)。
3) 水肿绒毛部分绒毛水肿,水肿程度不等,部分没有水肿,水肿绒毛无滋养细胞增生,无水肿绒毛可见增生,但增生细胞位于绒毛一段,有一定极性。免疫组化p57阳性,而ki-67阳性指数低于10% (图4)。
3.3. p57蛋白表达的检测
p57蛋白阳性染色定位于细胞滋养层细胞核,阳性细胞核出现清晰的棕黄色颗粒,每例随机计数10个绒毛的阳性数和细胞滋养层总数,求其百分比(图5)。78例水泡状胎块的p57检测结果见表1、表2。
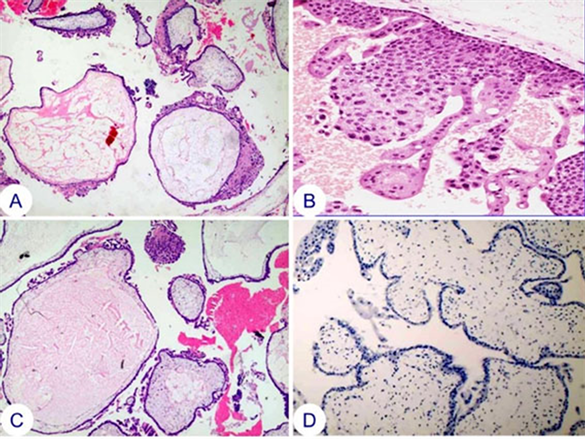 经典型。A. 弥漫性绒毛水肿;B. 弥漫性滋养细胞增生;C. 绒毛间质血管消失;D. p57阴性。
经典型。A. 弥漫性绒毛水肿;B. 弥漫性滋养细胞增生;C. 绒毛间质血管消失;D. p57阴性。
Figure 1. Complete hydatidiform
图1. 完全性水泡状胎块
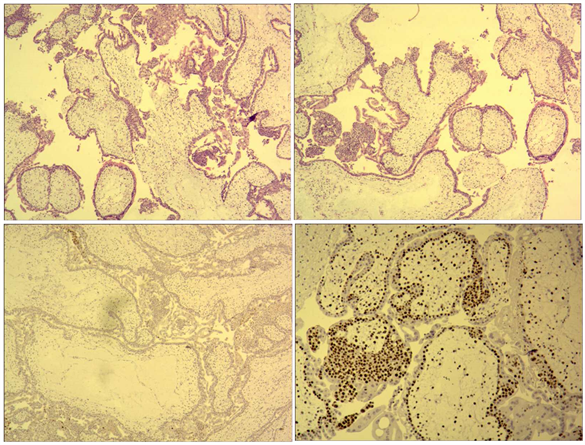 早早期。A. 弥漫性绒毛水肿不著,绒毛间质血管消失,可见细胞成分;B. 弥漫性滋养细胞增生;C. p57阴性;D. 细胞滋养层ki-67阳性指数80%以上。
早早期。A. 弥漫性绒毛水肿不著,绒毛间质血管消失,可见细胞成分;B. 弥漫性滋养细胞增生;C. p57阴性;D. 细胞滋养层ki-67阳性指数80%以上。
Figure 2. Complete hydatidiform
图2. 完全性水泡状胎块
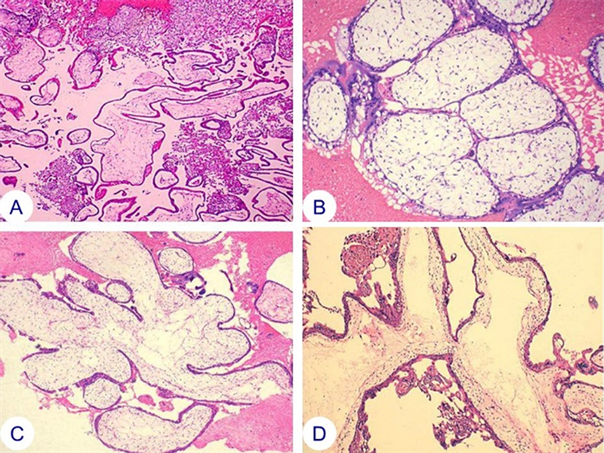 A. 部分绒毛水肿,部分无水肿;B. 水肿绒毛息肉状,C. 水肿绒毛不规则分枝,D. 水肿绒毛有中心池绒毛的滋养细胞结节状增生,细胞有异型性。
A. 部分绒毛水肿,部分无水肿;B. 水肿绒毛息肉状,C. 水肿绒毛不规则分枝,D. 水肿绒毛有中心池绒毛的滋养细胞结节状增生,细胞有异型性。
Figure 3. Partial hydatidiform moles
图3. 部分性水泡状胎块
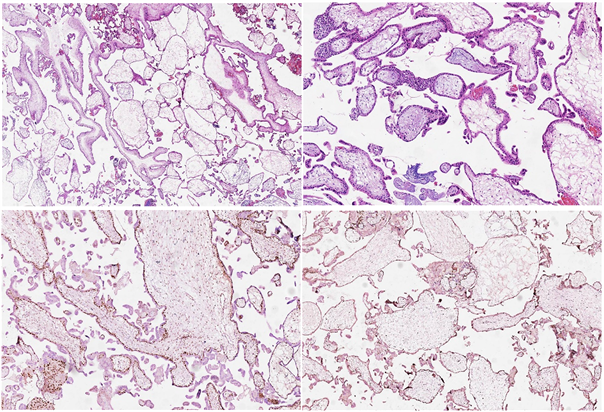 A. 部分绒毛水肿,部分水肿不明显,间质血管消失,几无细胞成分;B. 增生的滋养细胞位于一端,有一定极性;C. p57阳性;D. 细胞滋养层ki-67阳性指数极低,仅1%~2%。
A. 部分绒毛水肿,部分水肿不明显,间质血管消失,几无细胞成分;B. 增生的滋养细胞位于一端,有一定极性;C. p57阳性;D. 细胞滋养层ki-67阳性指数极低,仅1%~2%。
Figure 4. Hydropic abortion
图4. 绒毛水肿

Table 1. Comparison of pathological diagnosis to p57 genetic expression
表1. 组织病理诊断与p57基因表达比对
*Fisher确切概率法获得。

Table 2. Comparison of pathological types of CHM to p57 genetic expression
表2. 完全性水泡状胎块分型与p57基因表达比对
*Fisher确切概率法获得。
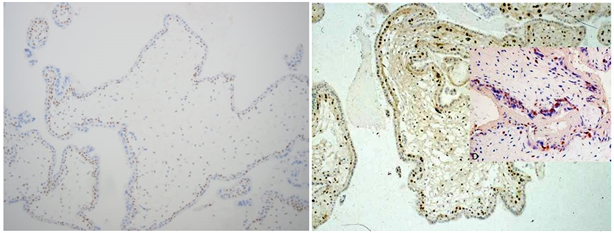 A. 完全性水泡状胎块p57阴性;B. 部分性水泡状快p57阳性检查
A. 完全性水泡状胎块p57阴性;B. 部分性水泡状快p57阳性检查
Figure 5. Detection of p57
图5. p57检测
3.4. ki-67表达的检测结果
ki-67阳性染色定位于细胞滋养层细胞核,阳性细胞核出现清晰的棕黄色颗粒,每例随机计数10个绒毛的阳性数和细胞滋养层总数(图6),求其百分比。ki-67检测结果见表3、表4。
3.5. 统计学结果
如表1所示,p57在部分性水泡状胎块中的阳性率为(92.86%),显著高于完全性水泡状胎块(14.10%) (P < 0.01)。p57蛋白在完全性水泡状胎块的少数病。例中表达,且主要呈弱阳性,在部分性水泡状胎块中的表达以强阳性为主,应用Ridit分析p57在二者中表达强度差异,结果显示,p57蛋白在部分性水泡状胎块中的表达强度显著高于完全性水泡状胎块(P <0.01)。

Table 3. Comparison of pathological diagnosis to ki-67 expression
表3. 组织病理诊断与ki-67表达比对

Table 4. Comparison of pathological types of CHM to ki-67 expression
表4. 完全性水泡状胎块分型与ki-67表达比对
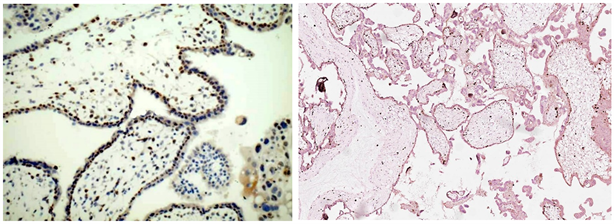 A. CHMki-67阳性60%~80%;B. 绒毛水肿ki-67阳性2%~4%。
A. CHMki-67阳性60%~80%;B. 绒毛水肿ki-67阳性2%~4%。
Figure 6. Comparison of CHM to HA in ki-67 expression
图6. 完全性水泡状胎块与绒毛水肿ki-67表达
如表3所示,ki-67在部分性水泡状胎块中的阳性率为(92.86%),显著高于完全性水泡状胎块(14.10%) (P < 0.01)。ki-67在完全性水泡状胎块的少数病例中表达,且主要呈弱阳性,在部分性水泡状胎块中的表达以强阳性为主,应用Ridit分析ki-67在二者中表达强度差异,结果显示,ki-67在部分性水泡状胎块中的表达强度显著高于完全性水泡状胎块(P < 0.01)。
4. 讨论
水泡状胎块是一组与妊娠相关的滋养细胞疾病,是否为肿瘤性疾病仍有争论,但具有一定的恶变倾向。以雌异配体性或雄性异型的或雄性异型的发生(diandric diploid conceptus)分为完全性水泡状胎块(complete hydatidiform moles, CHM)和部分性水泡状胎块(partial hydatidiform moles, PHM)两种类型 [1] [2] [3]。两者在肉眼、显微镜下的特点、核型及临床表现差别较大。测定血清HCG和彩超影像学检查对水泡状胎块有重要诊断意义。水泡状胎块患者hCG量远较正常值为高且持续为高水平,甚至高达20万mIU/ml,最高可高达1500~2000 KIU/L,清宫后持续不降。平均在清宫后8 W降至不可测出水平,最长不超过12~14 W。完全性水泡状胎块彩色超声检查可见典型的落雪状或蜂窝状回声,不见羊膜及胎儿。而部分性水泡状胎块可见由水泡状胎块所引起的超声图像改变及胎儿或羊膜腔,胎儿常合并畸形。
水泡状胎块以末次月经第一日延后2周为起始日,刮宫时间为终止日,完全性水泡状胎块分为经典型、早期和早早期。近年来随着女性保健意识的提高,患者就诊意识增强,使得大部分怀疑水泡状胎块病人得到手术干预提前,早和早早期患者比数明显增加。经典型水泡状胎块通过传统的组织病理学方法绝大部分可做出诊断。而早期和早早期水泡状胎块的组织学改变不明显,导致病理医生在水泡状胎块的早期诊断上遇到困难 [1] [7]。并使得完全性水泡状胎块和部分性水泡状胎块诊断和分类不明确,尤其对早期和早早期患者,从而造成临床上的治疗方案制定不合理或过度治疗,进一步影响治疗措施的制定。
上世纪70年代,宋鸿钊教授提出通过清宫后随访临床表现和定期检测hCG预测水泡状胎块的预后,随访时间一般2年 [9]。这种预测方法对判断水泡状胎块的预后有一定意义,但存在时间滞后的问题。因此对水泡状胎块的早期诊断并且正确区分类型对临床治疗及疾病预后有很大指导意义。目前,国外的目光已投向利用组织学检查同时进行相关基因表达谱的检测来提高水泡状胎块诊断的准确性 [11]。
p57、倍体分析诊断水泡状胎块可靠且客观。p57又叫有丝分裂抑制因子,为细胞周期抑制因子和肿瘤抑制因子 [1]。该基因来自父亲的等位基因是沉默的,不表达,只有来自母亲的等位基因才表达。由于完全性水泡状胎块缺乏母方基因,p57阴性,而部分性水泡状胎块有父母双方基因,p57呈阳性表达。蜕膜细胞、正常胎盘细胞滋养叶细胞、中间型滋养叶细胞及绒毛间质细胞阳性;而完全性水泡状胎块细胞滋养叶细胞和绒毛间质细胞阴性。因此,免疫组化检测p57可作为早期水泡状胎块妊娠诊断及鉴别诊断的标记物 [1] [2] [3]。Jun等 [10] 应用SP法检测了
5l
例病理形态学是完全性水泡状胎块和7例部分性水泡状胎块,p57蛋白在细胞滋养层(CTs)和绒毛间质(VMs)的细胞核中表达,前者均为1.9%阳性,而后者分别为100%、85.7%阳性。随后美国学者McConnell分析了68例水泡状胎块(HM),对形态学基础上诊断不同类型的HM同时进行了p57K1P2蛋白免疫组化和DNA倍体分析,一致率为65/68 (95.6%),这进一步说明了p57免疫组化染色标记在CM和PMM鉴别中的敏感性和特殊性。
本研究显示,几乎所有完全性水泡状胎块细胞滋养细胞和绒毛间质细胞的核均阴性,p57在完全性水泡状胎块中不表达或呈现弱表达,而在部分性水泡状胎块中,p57的表达明显。经统计学分析,p57表达在二者之间均存在显著性差异(P < 0.01),对早期和早早期CHM的诊断更为重要,可以作为一种重要的辅助意义。
在判读p57阳性时应注意,绒毛间的细胞阳性不影响完全性水泡状胎块的诊断,这是由于这些细胞可能是中间型滋养层细胞,或受到母体激素的影响,发生了母性化;约1%~3%的完全性水泡状胎块绒毛细胞滋养层阳性,有作者认为这种完全性水泡状胎块保留母体染色体6和11 [3] ,或捐卵患者,故p57可阳性。
ki-67是目前在国际上研究较多的一个细胞增殖标记物,是双链的大分子DNA结合蛋白,表达部位在细胞核,是一种针对处于增殖周期的人类细胞核抗原,其表达范围覆盖除G0期以外的各增殖周期细胞,与增生密切相关。因其半衰期短,故可作为反映细胞群体增殖活性的指标 [12] [13]。Kale的研究发现,ki-67阳性指数在自然流产4.7%,部分性水泡状胎块29%,完全性水泡状胎块60%,浸润性水泡状胎块75%,故提出 [12] ,ki-67对正常绒毛、部分性水泡状胎块及完全性水泡状胎块的鉴别诊断具有重要的参考价值。
本研究发现在水泡状胎块增生的绒毛组织中,ki-67主要见于绒毛内层的细胞滋养层细胞,少数IT可见阳性染色,ST均为阴性,但ki-67在CHM中着色程度高于PHM,这种差异在CT中尤为明显,统计分析结果也提示ki-67在CHM与PHM之间均存在显著性差异(P < 0.05)。但是,在完全性水泡状胎块的底线和部分性水泡状胎块的高线有重叠,表明ki-67阳性表达对区别完全性和部分性水泡状胎块应结合p57的表达情况来确定,具有参考价值。而在部分性水泡状胎块和绒毛水肿的鉴别有重要意义,绒毛水肿阳性指数低于10%,甚至1%~5%,而在部分性水泡状胎块高于10%。因此我们认为,ki-67在水泡状胎块中的表达情况对于鉴别部分性水泡状胎块和绒毛水肿更为重要。如果为高表达,表明滋养细胞增生活跃,再次发生宫腔残留、滋养细胞再生、继发侵袭性葡萄胎及绒癌的可能较大,也就是说,在第一次清宫标本ki-67高表达的患者,应进行第二次刮宫,并结合病史、彩超、HCG等情况,进行预防性化疗,因此,认为ki-67可以作为指导预后和预防性化疗的指标。
肿瘤的发生是一个长期的分阶段的、多基因突变积累的过程。正常妊娠的胎盘滋养层细胞具有类似肿瘤细胞的浸润性生长的生物学特性,本研究对p57和ki-67在妊娠滋养细胞疾病中表达的情况及其生物学意义进行研究,发现p57和ki-67的表达可以作为葡萄胎的早期诊断和分类的辅助指标之一,并指导其预后及辅助性化疗和治疗随诊方案的制定。