1. 引言
静止中心是高等植物根尖分生组织的控制中心,位于细胞分裂区和根冠区之间,由一群分裂缓慢的细胞所构成。在模式植物拟南芥中,静止中心通常含4个细胞,其外被一圈干细胞所包围 [1]。这些干细胞通过定期分裂进行自我更新,并同时为根中各组织提供生长发育所需的新细胞来源。静止中心细胞在根尖干细胞的维持和调控中担负重要作用,它们一方面提供维持干细胞特性所需的调控信号,如果任何一个静止中心细胞死亡或功能丧失,会导致与其直接接触的干细胞分化和失去干细胞特性 [2]。另一方面,当干细胞受损时静止中心细胞通过分裂补充新的干细胞,行驶其干细胞修复功能 [3]。由于静止中心细胞在根干细胞及根尖分生组织调控中的重要作用,其自身的调控也是植物学研究,特别是植物发育学研究的一个重要对象。
经多年研究,目前已经发现了一大批参与根尖分生组织和根干细胞调控的基因,如WUSCHEL-RELATED HOMEOBOX5 (WOX5) [4] ,SHORTROOT (SHR) [5] ,SCARECROW (SCR) [6] ,PLETHORAs (PLT1/2/3) [7] ,FEZ [8] ,RETINOBLASTOMA-RELATED (RBR) [9] ,ACR4 [10] 等。但由于其中大多数基因在多种细胞类型中表达,它们在静止中心细胞中的具体功能目前并不十分清楚。
WOX5是目前已知的参与根干细胞调控基因中唯一在静止中心细胞特异性表达的基因。它编码一个同源异型域(homeobox)转录因子家族蛋白,该家族的成员在动植物中广泛分布。WOX5与茎尖分生组织中的干细胞调控基因WUSCHEL同属于一个植物所特有的亚家族,且在功能上可相互替代。WOX5功能缺失导致柱干细胞分化和静止中心细胞分裂 [4] ,而其过量表达可在静止中心下方诱导产生多层未分化细胞。现已查明WOX5在静止中心细胞的特异性表达由其编码序列5’端上游的启动子决定 [4]。
本研究旨在利用WOX5启动子构建一个在拟南芥根尖静止中心细胞中驱动不同目标基因特异性表达的系统,为在该细胞群中开展基因功能研究奠定基础。该表达系统包含两套独立的载体,即驱动载体和目标基因表达载体。驱动载体含WOX5启动子和人工合成转录激活因子GAL4-VP16的编码序列。目标基因表达载体中包含有带多个GAL4结合位点的UAS启动子和目标基因的编码序列。该基因表达系统的特色是它可以用来驱动不同目标基因在静止中心细胞中表达。
2. 材料与方法
2.1. 实验材料
拟南芥(哥伦比亚)野生型和GAL4-GFP增强子诱捕转化株系(Enhaner trap lines)的种子从诺丁汉欧洲拟南芥种质资源中心(http://nasc.life.nott.ac.uk)获得。35SSGVG/UAS::WOX5转基因株系 [4] 的种子和pFP101载体分别由日本奈良科技大学(Nara Institute of Science and Technology) Keiji Nakajima教授和法国格勒诺布尔大学(Université Grenoble Alpe) François Parcy 教授赠与 (http://www.isv.cnrs-gif.fr/jg/alligator/vectors.html)。大肠杆菌菌株DH5α,限制性内切酶及其它分子生物学试剂或试剂盒购自Takara 公司(http://www.takarabiomed.com.cn)。根瘤农杆菌(Agrobacterium tumefaciens)菌株LBA4404购自天根生化科技有限公司(http://www.tiangen.com)。引物合成和测序服务由上海Invitrogen生物技术有限公司(http://www.hbnxyhd.bioon.com.cn)或北京擎科新业生物技术有限公司(http://www.tsingke.net)提供。
2.2. 种子消毒及植物的培养与生长条件
拟南芥种子用10%体积的次氯酸 + 90%体积的纯酒精混合溶液消毒,浸泡10分钟后用酒精洗3~4遍,在无菌台吹干后用无菌牙签点种于用1% (w/v)琼脂固化的1/2 MS培养基上,置于22℃,16 h光照/8 h黑暗的培养箱中萌发。用于显微观察的幼苗留在上述培养箱中直到观察期结束。用于转化,杂交和种子扩繁或转基因位点纯化的幼苗,萌发或观察结束后移栽至营养土中(PINDSTRUOP),置于22℃,16 h光照/8 h黑暗的植物生长室中生长。
2.3. 载体构建
pFP101载体改造:在构建本研究需要的表达载体前,我们先对pFP101进行了改造,具体细节如下:用HindIII + XbaI对pFP101质粒进行双酶切,经电泳和胶回收后,用T4连接酶插入一个人工合成的多克隆位点,改造后的载体命名为pFPL,其中(从5'开始依次)含HindIII,BglII,ApaI,SacI,SacII,SpeI,XhoI,XbaI,BamHI,SalI,PstI单酶切克隆位点,同时失去了原来载体中的CaMV 35S启动子(图1(A))。
驱动载体pFP-WOX5p::GAL4-VP16的构建:以拟南芥(哥伦比亚)野生型基因组DNA为模板,用表1中所列的相关引物通过PCR扩增获得一个4.6 kb的WOX5基因的启动子片段,用In-Fusion无缝克隆方法(In-Fusion HD Cloning Kit,Takara-Clontech)将其从BglII位点插入pFPL,形成的中间载体经测序验证后,再从BamHI位点插入GAL4/VP16的编码序列,后者从GAL4-GFP增强子诱捕转化株系J1511的基因组DNA扩增获得,建成的载体命名为pFP-WOX5p::GAL4-VP16 (图1(B))。
目标基因表达载体构建:本研究构建了3个目标基因表达载体,即pFP-UAS::GFP, pFP-UAS::WOX5-GR和pFP-UAS::FEZ-GR (图1(B))。其中的UAS启动子由J1511基因组DNA扩增而来,用In-Fusion克隆方法将其插入pFPL的BglII位点,形成中间载体pFP-UAS。由pFP-UAS载体的BamHI位点插入小鼠糖皮质激素受体中的激素结合部位的编码序列GR片段形成另一个中间载体pFP-UAS-GR。GR从35S::GVG/UAS::WOX5基因组DNA扩增获得。GFP、WOX5和FEZ的编码系列分别以J1511基因组DNA,35S::GVG/UAS::WOX5基因组DNA和由(哥伦比亚)野生型RNA合成的cDNA为模板经PCR扩增获得。GFP编码序列由BamHI位点插入中间载体pFP-UAS形成pFP-UAS::GFP;WOX5和FEZ的编码系列则由BamHI位点插入pFP-UAS-GR,建成pFP-UAS::WOX5-GR和pFP-UAS::FEZ-GR。与GR融合的目标基因编码蛋白在植物细胞中需要有外源提供的糖皮质激素才可进入细胞核。上述片段扩增所用引物见表1,构建过程中每个片段进入载体后都经测序进行了验证。
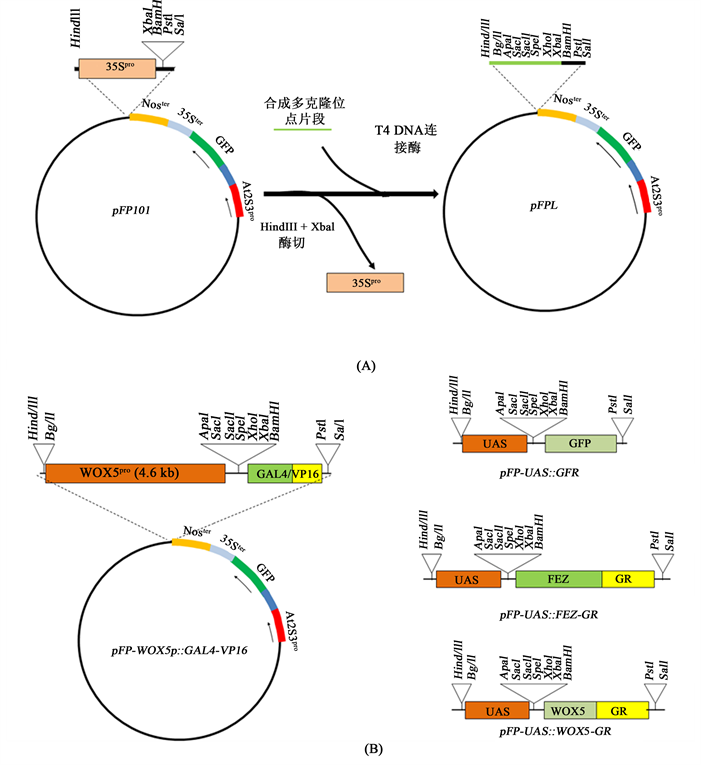 注:A pFPL载体的构建过程及其示意图,其中At2S3pro为拟南芥At2S3基因的启动子 [2] ;35Spro和35Ster分别为烟草花叶病毒(CaMV)35S蛋白编码基因的启动子和终止子;Noster为根癌农杆菌胭脂碱(nopaline)合成酶基因的终止子胭脂碱合酶 (nos)终止子。B植物表达载体示意图,其中WOX5p为拟南芥WOX5基因的启动子,GFP,FEZ,WOX5为编码系列。
注:A pFPL载体的构建过程及其示意图,其中At2S3pro为拟南芥At2S3基因的启动子 [2] ;35Spro和35Ster分别为烟草花叶病毒(CaMV)35S蛋白编码基因的启动子和终止子;Noster为根癌农杆菌胭脂碱(nopaline)合成酶基因的终止子胭脂碱合酶 (nos)终止子。B植物表达载体示意图,其中WOX5p为拟南芥WOX5基因的启动子,GFP,FEZ,WOX5为编码系列。
Figure 1. Schematic maps of expression vectors
图1. 表达载体示意图
2.4. 转化及转基因植株鉴定
植物表达载体通过热激法转化进入土壤农杆菌LBA4404,用花序浸染法获得拟南芥转基因种子 [11] ,后者通过种皮绿色荧光识别筛选,萌发后在苗期用PCR分子检测进一步验证。各载体的转化植株验证时所用引物如下:pFP-WOX5p::GAL4-VP16转化株用WOX5p(JC)-5 + VP16(JC)-3;pFP-UAS::GFP转化株用UAS(JC)-5 + GFP(JC) -3;pFP-UAS::WOX5-GR转化株用WOX5(JC)-5 + GR(JC)-3;pFP-UAS::FEZ-GR转化株用FEZ(JC) -5 + GR(JC)-3。上述引物的序列信息见表2。

Table 1. Primers used in the construction of expression vectors
表1. 载体构建所用引物
*引物中加粗字体标注的为与载体相同的序列,为方便In-Fusion克隆的重组反应而添加。表中所有引物为作者自主设计。

Table 2. Primers used for the confirmation of transgenic lines
表2. 转化植株鉴定引物
*表中所有引物为作者自主设计。
2.5. 显微镜观察
共聚焦显微镜观察:将幼苗根浸于滴加在载玻片上的10 µg/ml碘化丙啶(propidium iodide)溶液中,轻轻盖上盖玻片,用奥林巴斯FV1200共聚焦显微镜观察和拍照,波长设置为激发光488 nm,检测波长510 nm。
光学显微镜观察:(拟南芥)幼苗根用50%乳酸:30% H2O:20%卢戈耳氏溶液(Lugol’s solution)混合液装片,用Nikon ECLIPSE 80i微分干涉相差显微镜观察,用DS-Ri1数码相机和NIS-Elements软件拍照和进行图像处理。
3. 结果与分析
3.1. 载体构建和转基因植株验证与杂交
本研究所构建的载体如图1所示,包括由pFPL,pFP-WOX5p::GAL4-VP16,pFP-UAS::GFP,pFP-UAS::WOX5-GR和 pFP-UAS::FEZ-GR。通过花侵染法获得了每个载体的转基因单株,用种皮GFP蛋白的绿色荧光进行筛选,并用PCR 检测验证。通过杂交获得如下携带驱动载体和不同目标基因表达载体的转基因材料:pFP-WOX5p::GAL4-VP16/pFP-UAS::GFP,pFP-WOX5p::GAL4-VP16/pFP-UAS::WOX5-GR和pFP-WOX5p::GAL4-VP16/pFP-UAS::FEZ-GR。经分子检测验证后开展进一步分析。
3.2. 所构建的基因表达系统的静止中心细胞特异性验证
为了验证所构建的基因表达系统的确具有静止中心细胞特异性,我们用共聚焦显微镜对携带pFP-WOX5p::GAL4-VP16,pFP-UAS::GFP和pFP-WOX5p::GAL4-VP16/pFP-UAS::GFP载体的转基因幼苗的根尖进行了观察,发现只有携带pFP-WOX5p::GAL4-VP16/pFP-UAS::GFP的幼苗在静止中心细胞出现GFP绿色荧光(图2(D),图2(E)),携带pFP-WOX5p::GAL4-VP16或pFP-UAS::GFP的幼苗的静止中心细胞无GFP绿色荧光(图2(C)),表明由pFP-WOX5p::GAL4-VP16驱动的目标基因表达的确具有静止中心细胞特异性。
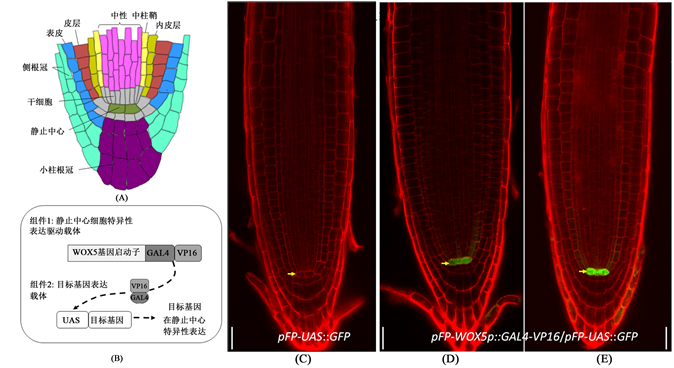 注:A拟南芥根尖分生组织细胞结构示意图,显示静止中心,其周围的干细胞和根中的细胞类型及其空间分布;B所构建的基因表达系统的两个组件及其基因表达驱动过程示意图;C-D:PI染色的幼苗根尖共聚焦照片,显示细胞结构及GFP蛋白的表达部位,其中C为携带pFP-UAS::GFP载体的幼苗的根尖,D和E为携带pFP-WOX5p::GAL4-VP16/pFP-UAS::GFP载体幼苗的根尖。C-D中的标尺线为20微米(µm)。
注:A拟南芥根尖分生组织细胞结构示意图,显示静止中心,其周围的干细胞和根中的细胞类型及其空间分布;B所构建的基因表达系统的两个组件及其基因表达驱动过程示意图;C-D:PI染色的幼苗根尖共聚焦照片,显示细胞结构及GFP蛋白的表达部位,其中C为携带pFP-UAS::GFP载体的幼苗的根尖,D和E为携带pFP-WOX5p::GAL4-VP16/pFP-UAS::GFP载体幼苗的根尖。C-D中的标尺线为20微米(µm)。
Figure 2. Confirmation of QC-specificity of the constructed expression system
图2. 所构建的表达系统的静止中心细胞特异性验证
3.3. 所构建的基因表达系统的功能性验证
为了验证所构建的表达系统在研究基因功能方面的功效,我们选择了两个已知根尖干细胞调控基因,WOX5和FEZ,为目标基因。这两个基因都对根干细胞有正调控功能,但表达区域不同 [4] [8]。WOX5在静止中心细胞中特异性表达,所编码蛋白从静止中心细胞移动进入周围干细胞行驶调控功能 [12]。FEZ主要在柱干细胞及由其分裂产生的子细胞,侧根冠与表皮原初细胞及其分裂产生的侧根冠细胞中表达 [8] ,其主要调控功能是促进柱干细胞和侧根冠原初细胞的不对称性分裂 [8]。我们将携带pFP-WOX5p::GAL4-VP16/pFP-UAS::WOX5-GR和pFP-WOX5p::GAL4-VP16/pFP-UAS::FEZ-GR的幼苗在萌发后第3天分别转移到了含人工合成糖皮质激素地塞米松(英文名dexamethasone,简称DEX)或不含DEX的培养基上培养5天,用共聚焦显微镜和光学显微镜对这些幼苗的根尖进行观察。就pFP-WOX5p::GAL4-VP16/pFP-UAS::WOX5-GR幼苗而言,在不含DEX的培养基上根尖分生组织中的细胞形态,排列方式及其分化状况与野生型幼苗根中的情况非常相似(图3(A)、图3(D)),但在含DEX的培养基上生长时静止中心细胞下方的未分化细胞层数增加(图3(B)和图3(C),图3(E)和图3(F),表3),表明由该表达系统驱动产生的额外WOX5蛋白对柱细胞的分化有进一步抑制作用。除此以外,在含DEX的培养基上pFP-WOX5p::GAL4-VP16/pFP-UAS::WOX5-GR幼苗中静止中心细胞的分裂频率高于在不含DEX的培养基生长的幼苗(表3),表明静止中心细胞中WOX5蛋白过量时也可促进其分裂。pFP-WOX5p::GAL4-VP16/pFP-UAS::FEZ-GR幼苗在不含DEX培养基上生长时其根尖分生组织中的细胞分裂及其分化状况与野生型幼苗中的情况相似(图3、表3),但在含DEX的培养基上生长的幼苗中,静止中心及周围干细胞数量增加,且排列不规则,表明这些细胞的分裂调控出现异常。但光学显微镜观察发现静止中心下方未分化细胞层数并未增加。这些观察结果表明FEZ对静止中心及其周围细胞有促进分裂的功能,但不影响柱细胞分化。由于FEZ在静止中心表达,其对静止中心以外的细胞的调控可能是通过非细胞自主的调控模式的直接调控,或是通过影响静止中心细胞功能而产生的间接影响。
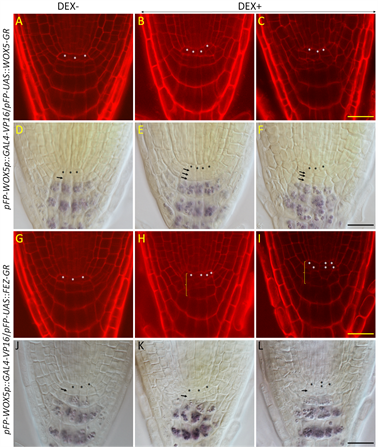 注:共聚焦(A-C & G-I)和光学()显微镜照片,显示pFP-WOX5p::GAL4-VP16/pFP-UAS::WOX5-GR(A-F)和pFP-WOX5p:: GAL4-VP16/pFP-UAS::FEZ-GR(G-I)幼苗根尖的细胞分裂和细胞分化状况。其中A,D,G,J为在无DEX(DEX-)的培养基上生长的幼苗,B,C,E,F,H,I,K,L为在含5 µM DEX (DEX+)的培养基上生长的幼苗。幼苗在无DEX培养基萌发3天后转到含或不含DEX的培养基继续生长5天后观察拍照。静止中心细胞用*标注,光学显微镜照片中箭头标示静止中心下方未分化细胞层,H-I中括号线标示不规则细胞分裂区。标尺线为20微米(µm)。
注:共聚焦(A-C & G-I)和光学()显微镜照片,显示pFP-WOX5p::GAL4-VP16/pFP-UAS::WOX5-GR(A-F)和pFP-WOX5p:: GAL4-VP16/pFP-UAS::FEZ-GR(G-I)幼苗根尖的细胞分裂和细胞分化状况。其中A,D,G,J为在无DEX(DEX-)的培养基上生长的幼苗,B,C,E,F,H,I,K,L为在含5 µM DEX (DEX+)的培养基上生长的幼苗。幼苗在无DEX培养基萌发3天后转到含或不含DEX的培养基继续生长5天后观察拍照。静止中心细胞用*标注,光学显微镜照片中箭头标示静止中心下方未分化细胞层,H-I中括号线标示不规则细胞分裂区。标尺线为20微米(µm)。
Figure 3. Funactional assessment of QC-specific expression of WOX5 and FEZ
图3. WOX5和FEZ基因在静止中心特异性表达后的功能分析

Table 3. Impact of QC-specific expression of wox5 and FEZ on QC and columella stem cells
表3. WOX5和FEZ在静止中心表达后对静止中心和柱干细胞的影响
注:表中数据收集所用幼苗先在1/2MS培养基萌发,萌发后3天转至含或不含DEX (5 µM)培养基上继续生长5天。细胞分裂频率数据通过共聚焦显微镜观察收集,细胞分化频率数据经碘液染色后通过光学显微镜观察数据。每个数据来自于40个单株。
4. 结论与讨论
本研究利用WOX5基因启动子和GAL4-VP14-UAS基因表达激活系统成功构建了一个可在静止中心细胞中特异性地驱动不同基因表达的系统,通过驱动报告基因GFP的表达验证了该表达系统的静止中心细胞特异性,并进一步通过驱动WOX5和FEZ两个已知调控基因的表达展示了利用该系统研究基因功能的可行性及功效。
多细胞生物体内有各种不同的组织和细胞,它们各自的特性和生物学功能在很大程度上取决于在其中表达和发挥作用的基因网络。因此,了解基因功能的细胞特异性是生物学研究的核心内容。由于大多数基因的表达区域跨越不同细胞和组织类型,构建细胞特异性的基因表达系统是研究细胞特异性基因功能的一条重要途径。鉴于静止中心在植物根系发育中的重要作用,本研究所构建的静细胞特异性基因表达系统为研究该细胞类群的调控及其生物学功能,以及根干细胞和根系发育的调控机理提供了一个重要的工具。
此前的研究发现缺失WOX5功能的突变体中出现柱干细胞分化和静止中心细胞分裂的表型 [4] ,表明该基因的正常功能是抑制静止中心细胞分裂和柱干细胞分化。本研究发现如果通过构建的表达系统在静止中心细胞中表达额外的WOX5基因产物,的确可抑制柱干细胞的分化,与上述结论一致。但同时发现额外的WOX5基因产物导致静止中心细胞分裂频率增加,与上述结论相反,这一结果表明WOX5对静止中心细胞分裂的影响与剂量相关且可能存在一个关键阈值,高于或低于这一阈值都可能导致细胞分裂频率升高。Willemsen 等发现FEZ的表达区覆盖柱干细胞及由其分裂产生的子细胞,侧根冠与表皮原初细胞及其分裂产生的侧根冠细胞 [8]。由于其调控功能与表达区基本重叠,推测其调控模式可能是细胞自主性的 [8]。目前不清楚FEZ对静止中心细胞是否有调控功能。本研究发现FEZ在静止中心细胞中表达后可以导致静止中心细胞分裂,表明其具有调控该细胞类群的功能。同时我们还发现FEZ在静止中心表达后导致其周围的干细胞(柱干细胞)不规则分裂,虽然目前无法确定这一种影响是细胞非自主性调控,或是对静止中心细胞调控的间接影响,但该观察为进一步研究FEZ的作用模式提供了一条重要线索。
致 谢
感谢日本奈良科技大学(Nara Institute of Science and Technology) Keiji Nakajima教授提供的35SSGVG/UAS::WOX5种子和法国格勒诺布尔大学François Parcy教授提供的pFP101载体。
基金项目
本研究得到了科技部973前期项目(2014CB160306),重庆师范大学人才基金(12XLR36)的资助。
参考文献
NOTES
*通讯作者。