1. 引言
苯胺是重要的有机化工中间体,广泛用于医药、染料和农药等行业。近几年因苯胺污染导致的环境事故时有发生,苯胺废水的处理已成为国内外水处理领域的研究热点。萃取法、吸附法等物理化学方法能够将废水中的芳香胺化合物富集分离使废水得到净化,但是萃取液或高浓脱附液需要再次处理,不仅增加了处理成本,而且如果处理不当还会导致二次污染 [1] [2]。Fenton氧化、光催化氧化和超临界氧化等高级氧化法已被广泛用于处理含芳香胺化合物废水的研究,由于需要添加药剂、反应条件要求严格,或者氧化效率不高等缺陷,导致难以大规模推广使用。
电化学氧化技术是新兴的废水处理技术,属于高级氧化法的一种,与传统的物理、化学、生物等处理方法相比,电化学氧化具有处理效率高、氧化彻底、降解过程无二次污染等优点。电化学氧化技术绿色清洁、操作简便,是当前最有应用前景的水处理技术之一 [3] [4] ,特别是对难降解的有毒有害有机物有高效的降解能力,能使有机物降解成H2O、CO2、N2等无害小分子物质。在工业化快速发展的今天,有机废水污染造成的环境问题日益突出,电化学氧化作为一种高效率的废水处理技术在工业有机废水处理领域上的研究已取得一定成绩。有研究表明,电化学氧化技术对苯胺化合物具有较好的处理效果 [5] ,但是关于各种工艺条件对苯胺电化学氧化去除率和能耗等的影响规律研究还不够系统。本文对电流密度、废水初始浓度、pH值、反应时间、电解质浓度等工艺条件进行深入研究和探讨,进一步论证了电化学氧化技术的可行性和有效性。
2. 研究方法
2.1. 研究内容
本实验采用石墨片作为电极材料,以500 ml棕色广口贮液瓶作为电解槽,实验装置图如图1所示。实验装置主要有:恒流直流电源、电解槽、铁架台、石墨电极。

Figure 1. Electrochemical degradation of aniline device
图1. 电化学降解苯胺装置图
分别控制电流密度、废水初始浓度、pH值、反应时间、电解质浓度进行单因素实验,用量筒移取200 ml预先配置好的苯胺模拟废水水样与棕色广口瓶中,调节pH到定值,加入一定量电解质。插入电极片,根据电极浸水面积和所需电流密度计算恒电流值并调节好,用导线连接好电源和电极,按实验装置图固定好实验装置,打开电源开始电解实验,记录实验开始时间,每隔30分钟取样1.0 ml测吸光度。
试剂:苯胺(分析纯,阿拉丁试剂有限公司),盐酸(分析纯,阿拉丁试剂有限公司),氢氧化钠(分析纯,国药集团化学试剂有限公司),氨基磺酸铵(分析纯,阿拉丁试剂有限公司),亚硝酸钠(分析纯,阿拉丁试剂有限公司),盐酸萘乙二胺(分析纯,阿拉丁试剂有限公司),氯化钠(分析纯,阿拉丁试剂有限公司)。
仪器:恒流电源(KXN-305D,深圳兆信电子仪器设备有限公司),电子天平(BS110S,北京赛多利斯天平有限公司),紫外可见分光光度计(Spectrumlab753S,上海棱光技术有限公司)。
2.2. 分析方法
本实验采用N-(1-萘基)乙二胺偶氮分光光度法来测定苯胺的浓度。苯胺在酸性条件下和亚硝酸钠发生重氮化反应,之后再与盐酸萘乙二胺发生偶合反应生成红色染料。根据染料在波长454 nm处的吸光度进行定量测量,即可得到苯胺的含量 [6]。
3. 结果与讨论
3.1. 初始浓度对苯胺降解的影响
在pH = 7、电解质浓度为0.05 mol/L、电流密度为10 mA/cm2的条件下,考察不同苯胺初始浓度(50, 100, 150 mg/L)对苯胺降解和能耗的影响,实验结果如图2和图3所示。
由图2可知,苯胺的降解速率随着初始浓度的增加而下降。初始浓度为50 mg/L的水样在电解150分钟后剩余浓度极低,再延长电解时间对降解效果不大,初始浓度为100 mg/L和150 mg/L的水样在电解150分钟后剩余浓度相差不大。结合图3得出,在相同电解时间时初始浓度高的水样的能耗要低。分析主要原因可能是低浓度时溶液中的活性氧化物多于苯胺物质,反应更加充分,使得降解较快;高浓度时由于一定时间内电解产生的活性氧化物有限,不足以与大量的苯胺接触,所以导致降解速率下降,但是电解产生的活性氧化物均起到降解的作用,所以单位能耗较低。

Figure 2. The effect of initial concentration on aniline degradation
图2. 初始浓度对苯胺降解的影响

Figure 3. The effect of initial concentration on energy consumption
图3. 初始浓度对能耗的影响
3.2. 溶液pH值对苯胺降解的影响
在初始浓度为100 mg/L、电流密度为10 mA/cm2、电解质浓度为0.05 mol/L的条件下考察溶液pH分别为3、7、10时对苯胺降解率和能耗的影响。实验结果如图4和图5所示。

Figure 4. Effect of solution pH on the degradation rate of aniline
图4. 溶液pH值对苯胺降解率的影响
由图4可知,在溶液呈酸性和碱性的时候苯胺降解率要比中性时候高,酸性条件比碱性稍微好点,且在电解时间为210分钟后降解速率趋缓。这是由于在酸性条件下,氯化钠由于电解而产生更多的活性氯(Cl2、次氯酸等),这些强氧化性物质促进苯胺的氧化 [7] ;而在碱性条件下,电解产生的羟基自由基具有更高的活性 [8] ,促进苯胺的降解。由能耗关系图5可知,酸性条件下能耗较低。
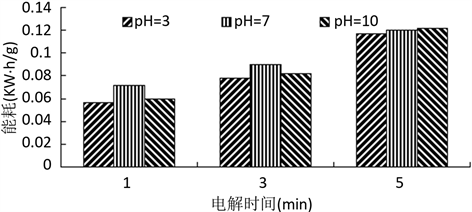
Figure 5. Effect of solution pH on the energy consumption
图5. 溶液pH值对苯胺降解率的影响
3.3. 电流密度对苯胺降解的影响
在初始浓度为100 mg/L、电解质浓度为0.05 mol/l、溶液pH = 7的条件下考察电流密度分别为5、10、20 mA/cm2时对苯胺降解率和能耗的影响,结果如图6和图7所示。
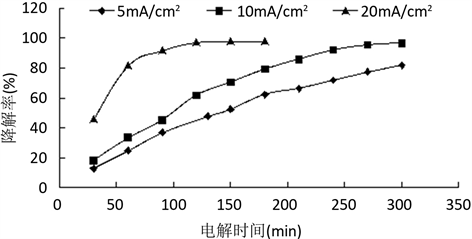
Figure 6. Effect of current density on the degradation rate of aniline
图6. 电流密度对苯胺降解率的影响
由图6可知,相同条件下苯胺的降解率随着电流密度的增加而升高,且当电流密度达到20 mA/cm2时,电解60分钟后降解率已达到81.56%,电解120分钟后几乎接近完全降解达97.22%,之后延长电解时间对降解率贡献不大;电流密度为5 mA/cm2和10 mA/cm2电解到300分钟后其降解率才分别为81.86%和96.68%。从能耗关系图7也可得出,对于电流密度为20 mA/cm2条件下,电解60 min时其能耗最低,增加电解时间只会增大能耗,对降解率改变不大。这是由于随着电流密度的增加,槽压也在增加,氯气、次氯酸和羟基自由基等氧化性物质产生速度快,且溶液中各粒子迁移速度加快 [9] ,从而使降解率升高。
3.4. 电解质浓度对苯胺降解的影响
电解质氯化钠在电解的过程中起着多重的作用,考察电解质氯化钠的浓度对苯胺降解率的影响至关重要。在初始浓度为100 mg/L、电流密度为10 mA/cm2、溶液pH = 7的条件下考察电解质浓度分别为0.05、0.1、0.5 mol/L对苯胺降解率和能耗的影响,结果如图8和图9所示。

Figure 7. Effect of current density on the energy consumption
图7. 电流密度对能耗的率影响

Figure 8. Effect of electrolyte concentration on the degradation rate of aniline
图8. 电解质浓度对苯胺降解率影响

Figure 9. Effect of electrolyte concentration on the energy consumption
图9. 电解质浓度对能耗的影响
由图8和图9的结果可知,苯胺降解率随着电解质浓度的增加而增加,电解质浓度为0.05 mol/L时电解到240分钟后降解率趋缓;电解质浓度为0.1 mol/L时电解180分钟后基本达到最大去除率,增加电解时间对降解率贡献不大;电解质浓度为0.5 mol/L时降解速率非常快,电解30 min后降解率已达95.11%,此时的能耗为0.0054 KW∙h/g,而相当的降解率下电解质浓度为0.1 mol/L时其能耗为0.0504 KW∙h/g,电解质浓度为0.05 mol/L时其能耗为0.12 KW∙h/g。原因是增大电解质氯化钠的浓度不仅增加了溶液粒子的迁移速度,同时氯化钠在电解过程中产生活性氯氧化物,参与苯胺的氧化降解,增加电解质的浓度,即可产生更多的活性氯来参与苯胺的降解,极大的提高了苯胺的降解率。由能耗关系图8知,相同电解时间下,单位能耗随着电解质浓度的增加而降低,可减少能耗。但是,高浓度的氯化钠在电解过程中可能会产生毒性更大的氯代物,所以实验选择氯化钠电解质浓度0.1 mol/L为宜。
4. 结论
电化学氧化法利用阳极直接氧化和电解质间接氧化降解苯胺,不使用化学药剂,在减少成本的同时最大程度减少了三废的生成,具有绿色环保的优势。
电流密度和电解质氯化钠浓度对苯胺降解率的影响较大,电流密度和氯化钠浓度越高,苯胺降解效果越好,能耗越低。
综合考虑去除效果、能耗和电极寿命等因素,电化学氧化处理苯胺废水适宜的工艺条件为:溶液pH = 7、电解质氯化钠浓度为0.1 mol/L、电解时间为150分钟,电流密度为10 mA/cm2,此时对苯胺的降解率可达95%左右,能耗为0.0504 KW∙h/g。
基金项目
国家自然科学基金青年科学基金项目(51308284)。
参考文献