1. 引言
中国大鲵(Andrias davidianus)属脊椎动物两栖纲,有尾目,隐鳃鲵科,鲵属,野生中国大鲵是我国特有的珍稀两栖动物,列为国家二级保护动物,还在科研、教学及物种进化研究等方面有着重要的科学意义。而人工养殖大鲵具有极高的营养及药用价值 [1] 。近年来,随着人工养殖规模的不断扩大,养殖大鲵疾病的爆发也越来越频繁,生产中产生的抗生素和消毒剂的滥用现象 [2]、耐药菌株增加的问题日趋严重,对大鲵的健康养殖带来不利的影响,病菌的流行与传播潜在威胁着其他水生及经济动物。
本次研究着重从重庆某大鲵养殖基地爆发大鲵腐皮病病原着手,通过从病死大鲵患病部位分离细菌,纯化,对其进行表型、分子鉴定,药敏试验,鲫鱼、美蛙、小鼠致病试验和美蛙病理切片制作观察。了解病原体对几种动物的致病性和病原体对药物的敏感性,并从病原体感染美蛙的病理组织观察研究大鲵源致病菌对美蛙组织的侵害与大鲵组织的病理变化是否相同,探讨美蛙作为两栖类水生动物用于大鲵病原菌感染研究的可行性。研究结果以期对大鲵的科学养殖、合理用药提供科学依据,对重庆地区大鲵养殖业的健康持续发展和大鲵细菌病实验室研究存在着重要意义。
2. 材料与方法
2.1. 实验动物
病鲵:重庆某养殖场送检患腐皮病大鲵。健康鲫鱼:重庆荣昌双河某鱼苗养殖中心80尾,平均体长15 cm/尾;健康美蛙:重庆某养殖场40尾,平均体重160 g/尾。小白鼠:购自西南大学荣昌校区动物科提供昆明系小鼠20只,平均体重18 g/只。
2.2. 试剂与器材
麦康凯琼脂、克氏双糖铁琼脂、胰蛋白胨、酵母提取物等购自北京奥博星生物技术有限公司;裂解上清液、Premix Taq (Ex Taq Version 2.0)、Forward Primer (1 × 10−8 mmol/μL)、Reverse Primer (1 × 10−8 mmol/μL)、dH2O,购自上海生工生物技术服务有限公司;药敏试纸购自杭州微生物试剂有限公司;BIOFOSUN自动生化鉴定仪器(上海复星医学科技发展有限公司)/(地点:重庆市璧山区动物疾病预防控制中心)。
2.3. 方法
2.3.1. 大鲵病原菌的分离
从病死大鲵、肝、脾、胰、肾、肌肉病灶等分离接种至LB培养基平板上,28℃培养24 h~48 h。取优势菌纯化,记录并编号TG1、TG2…TGn,保存备用。纯化菌进行革兰氏染色、氧化酶试验、麦康凯培养、溶血试验、过氧化氢试验、克氏双糖等培养特性检测。
2.3.2. 鲫鱼致病性试验
将健康鲫鱼置于大塑料桶中暂养4天,按分离菌数分组,分为试验组、生理盐水对照组、空白对照组,每组10尾。将分离菌分别接种于LB肉汤中,28℃培养24 h,麦氏比浊,将菌液稀释至6×108 cfu/ml,分别对试验组鲫鱼胸鳍肌肉注射接种0.2 ml/尾 [3] ;同时同部位注射等量生理盐水于对照组,空白对照组不注射。观察鲫死亡状况。
2.3.3. 分离菌的鉴定
用PCR扩增16SrRNA和BIOFOSUN生化系统鉴定对分离的可致鲫死亡的致病菌TG-2、TG-5进行鉴定。采用TAKARA公司50 μl反应体系,将TG-2、TG-5菌培养好的单独菌落勾入50 μl的裂解液,提取基因模板,加入引物,在PCR仪中扩增,琼脂糖明胶中电泳。确保基因组提出后将产物送往上海生工生物技术有限公司,对PCR产物进行测序。在NCBI上将测序后的待测菌序列与数据库上的所有序列进行比对,再使用DNASTAR中的Megalign进行进化树的构建,从而鉴定出菌的种类。按操作要求将TG-2、TG-5菌液加入BIOFOSUN-GN-48生化系统鉴定板条,28℃培养24 h,BIOFOSUN微生物鉴定药敏分析仪读取板条,分析报告结果。
2.3.4. 药敏试验
用K-B纸片法 [4] ,将致病菌接种至营养肉汤中,28℃培养24 h,用麦氏比浊管稀释至1.5 × 108 cfu/ml,再用灭菌棉签蘸取菌液均匀涂抹在LB培养基表面,镊子夹取药敏试纸平铺在培养基表面,置温箱28℃培养24 h~72 h,用直尺量取抑菌圈的直径,记录结果。
2.3.5. 小白鼠致病试验
将致病菌接种于LB肉汤中28℃培养24 h,按麦氏比浊管将菌液稀释至2.4 × 109 cfu/ml [3] ,将小白鼠按分离菌数分组,分为试验组、生理盐水对照组、空白对照组,每组5只,试验组小白鼠0.2 ml/只,腹腔注射;同时同部位注射等量生理盐水于对照组,空白对照组不注射。注射后观察记录小鼠的死亡率。
2.3.6. 美蛙致病性试验及脏器病理切片制作
将致病菌接种于LB肉汤中28℃培养24 h,按照麦氏比浊管将菌液稀释至1.5 × 109 cfu/ml [5] 将健康美蛙按分离菌数分组,分为试验组、生理盐水对照组、空白对照组,每组10尾,分别对试验组健康美蛙接种注射,腹腔注射0.2 ml/尾。同时同部位注射等量生理盐水于对照组,空白对照组不注射。注射后观察记录蛙的死亡情况。对死亡蛙进行病理剖检,取严重病变组织,浸入10%福尔马林中固定,洗涤,采用梯度浓度的乙醇脱水,后浸入二甲苯中30 min进行透明,再浸入融化过滤后的石蜡中进行浸蜡包埋,包埋蜡凝固后,修整组织放入切片机中切片,把浸蜡较好的切片展平烘干,HE染色,光学显微镜下观察其组织学变化。
3. 结果
3.1. 大鲵病原菌的分离结果
从患病死亡大鲵病灶肌、肝、脾、胰、肾部分离出优势生长株菌,进一步对其进行革兰氏染色、氧化酶试验、麦康凯培养、溶血试验、过氧化氢试验、克氏双糖铁试验等生化及生理学特征检测,获得6株菌。将其编号为TG-1、TG-2、TG-3、TG-4、TG-5、TG-6 (表1)。

Table 1. Culture characteristics of pathogenic bacteria
表1. 病原菌的培养特性
注:K/A为分解葡萄糖,不分解乳糖,K/K为不分解葡萄糖与乳糖,(+)为产气,(−)为不产气。
3.2. 鲫鱼致病性试验结果
TG-5菌株组死亡鲫鱼体表出血,眼球充血突出,剖检可见血性腹水,肝胰脏颜色变浅,肠道粘膜层充血发红。TG-2菌株组死亡鱼体出血严重,眼球充血突出,鳞片部分掉落。剖检可见大量血性腹水,血水偏黑色,肝胰脏出血,肠道粘膜层充血发红,肌肉组织稍有溃烂。其他几株菌的试验组及对照组无死亡,结果显示TG-2与TG-5菌为致病菌(表2)。
3.3. 16SrRNA测序鉴定结果
将TG-2、TG-5菌株基因组进行PCR扩增,产物经琼脂糖凝胶电泳后显示目的条带大小约为1500 bp (见图1),经上海生工生物工程技术服务有限公司测序,得到大小为1453 pb、1448 pb的序列。将检获得的测序列在NCBI上比对和数据分析。TG-2与TG-5的序列覆盖度最高为99%,TG-2与TG-5的99%的序列的相似度为99%。将NCBI上TG-2与TG-5比对的基因序列在DNASTAR的Megalign进行同源性比对(见图2)。若16SrRNA全长的同源性 ≥ 99%,为同种细菌。若在97%~98.9%,一般为同属不同种。若 < 95%,则为不同属 [6] 。
TG-2与TG-5的最高同源性菌均为KC202278.1号菌,达98.9%、98.5%。TG-2和TG-5的同源性略有不同,其进化树不在一个分支上。综合数据分析为:TG2与TG5均为变形菌门(Proteobacteria),变形菌纲(Proteobacteria),气单胞菌目(Aeromonas),气单胞菌科(Aeromonadaceae),气单胞菌属(Aeromonas)中的嗜水气单胞菌(Aeromonas hydrophila)。

Table 2. Pathogenicity test of crucian carp
表2. 鲫鱼致病性试验结果

Figure 1. 16SrRNA PCR amplification results of TG-2 and TG-5 strains
图1. TG-2、TG-5菌株的16SrRNA PCR扩增结果

Figure 2. Phylogenetic tree of 16SrRNA gene sequence of TG-2 and TG-5
图2. TG-2、TG-5的16SrRNA基因序列系统发育树
3.4. 全自动生化鉴定结果
致病菌TG-2、TG-5均为革兰阴性需氧菌,所以采用BIOFOSUN革兰阴性需氧菌鉴定板,将其培养了24 h后使用BIOFOSUN微生物鉴定药敏分析仪读取板条(见表3、表4、表5)。根据BIOFOSUN-GN48鉴定板说明书 [7] 所知,相似指数S ≥ 0.5,可报告的种鉴定结果。相似指数 < 0.5,无鉴定结果。

Table 3. BIOFOSUN GN-48 identification result of TG-2
表3. TG-2 BIOFOSUN GN-48鉴定结果
注:“+”为阳性,“−”为阴性,“V+”为不相称阳性,“V−”为不相称阴性,“I”为中界。


Table 4. BIOFOSUN GN-48 identification result of TG-5
表4. TG-5 BIOFOSUN GN-48鉴定结果
注:“+”为阳性,“−”为阴性,“V+”为不相称阳性,“V−”为不相称阴性,“I”为中界。

Table 5. Biochemical identification results of TG-2 and TG-5
表5. TG-2、TG-5生化鉴定结果
TG-2的相似指数为0.520,TG-5的相似指数为0.606。两者的指数都大于0.5;因此,TG-2为嗜水气单胞菌DNA第二组,TG-5为嗜水气单胞菌DNA第一组;将48种生化反应对照《伯杰氏系统细菌学手册》气单胞菌种属(Aeromonas),其结果为TG-2嗜水气单胞菌嗜水亚种(Aeromonas hydrophila subsp. hydrophila),TG-5为嗜水气单胞菌无气亚种(Aeromonas hydrophila subsp. anaerogenes)。
3.5. 药敏试验结果
药敏试验结果表明头孢他啶,多粘菌素B对两种菌敏感,其中头孢他啶敏感性最高。TG-2对头孢哌酮,头孢曲松的敏感性也较强(见表6)。

Table 6. Drug sensitivity test results
表6. 药物敏感性试验结果
注:R表示耐药,I表示中介,S表示敏感。
3.6. 小鼠致病试验结果
TG-2组小鼠出现轻微腹胀,肠道充气,壁薄,轻微充血,肝脏肿大出血,有的肝脏部分泛白,肾脏肿大,胃壁较硬。TG-5组小鼠与TG-2组的病理变化相似(见表7)。
3.7. 美蛙致病试验结果
试验组发病蛙皮肤出现不同程度的溃烂,腹部与四肢呈大片红色,肛门和四肢部位明显。TG-2菌株组解剖后腹腔有大量淡黄色腹水,暴露于空气中呈胶冻样,肝脏肿大出血,有的表面有灰白色点状病灶,脾肿大,肾充血肿胀。TG-5菌株组解剖后肝脏肿大表面红黄相间,胃充血,脾肿大,肾边缘泛白(见表8)。
3.8. 病理切片观察结果
接种TG-2与TG-5菌发病致死蛙的各脏器组织病理变化明显,但两株菌致死蛙病理症状之间无明显差异。通过对美蛙肝正常与病理组织切片的比较观察,可见(见图3):镜检肝细胞绝大部分坏死消失,肝细胞肿大,胞质溶解,空泡变性,肝细胞核浓缩、碎裂,肝细胞索分布紊乱、断裂,肝血窦扩张、融合,间质被炎性细胞浸润,肝脏中有大量的淤血、出血和坏死灶。对美蛙肾脏正常与病理组织切片的比较观察,可见(见图4):肾小囊腔扩张中间含有血浆和蛋白渗出物,上皮细胞肿大,广泛性的颗粒、空泡变性,胞核浓缩、碎裂。肾间质血管淤血、出血,炎性细胞浸润。肾小管管腔中不同程度存在渗出物和红细胞等物质。
4. 讨论
气单胞菌属(Aeromonas)包括:嗜水气单胞菌(Aeromonas hydrophila)、温和气单胞菌(Aeromonas sobria)、豚鼠气单胞菌(aeromonas caviae)、维隆气单胞菌(Aeromonas veronii)、杀鲑气单胞菌(Aeromonas salmonicida)、中间气单胞菌(Aeromonas media)等共14个气单胞菌表型和16个基因种 [8] 。TG-2与TG-5 16srRNA鉴定结果显示其两菌之间同源性 < 98.9%,进化树不在同一支,但均与嗜水气单胞菌KC202278.1号同源性为高,因此TG-2与TG-5为嗜水气单胞菌DNA不同组细菌。生理生化特性说明TG-2菌株为β溶血,葡萄糖产气;TG-5菌株为α溶血,葡萄糖不产气以及如氧化酶试验呈阳性,能发酵葡萄糖、蔗糖、阿拉伯糖,L-丙氨酸、L-天冬酰胺酸、L-组氨酸、L-丝氨酸反应阳性等特征,并经查阅《伯杰氏系统细菌学手册》,TG-2符合嗜水气单胞菌嗜水亚种(Aeromonas hydrophila subsp hydrophila),TG-5符合嗜水气单胞菌无气亚种(Aeromonas hydrophila subsp anaerogenes)。
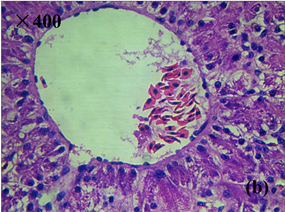
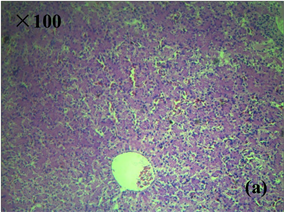
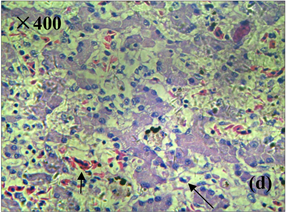
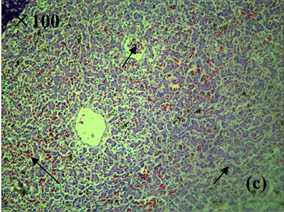
Figure 3. Histopathological characteristics of liver of diseased frog (HE staining). (a), (b) Healthy liver tissue; (c) Liver congestion, hemorrhage, disordered arrangement of hepatic cord; (d) Liver cell enlargement, vacuolar degeneration, cytolysis, nuclear concentration, fragmentation, hepatic sinusoidal dilatation
图3. 患病美蛙肝脏病理组织学特征(HE染色)。(a)、(b) 健康肝脏组织;(c) 肝脏淤血、出血,肝索排列紊乱;(d) 肝细胞肿大,空泡变性,胞质溶解,核浓缩、碎裂,肝血窦扩张




Figure 4. Histopathological characteristics of kidney of diseased frog (HE staining). (a), (b) Healthy kidney tissues; (c) congestion and hemorrhage of renal interstitial vessels, protein exudates in renal tubules; (d) enlargement of renal cysts, protein exudates, vacuolar degeneration of renal tubular epithelial cells, nuclear concentration and fragmentation
图4. 患病美蛙肾脏病理组织学特征(HE染色)。(a)、(b) 健康肾脏组织;(c) 肾间质血管淤血、出血,肾小管官腔内含蛋白渗出物;(d) 肾小囊腔扩大,内含蛋白渗出物,肾小管上皮细胞空泡变性,核浓缩、碎裂
由于不同菌株间的生理生化性状、血清型、基因型的差异,其致病性在表达毒力因子上也存在差异 [9] 。分离于大鲵体TG-2与TG-5的致病性不同。TG-2与TG-5菌对鲫鱼、美蛙、小白鼠均可致死。TG-2菌对鲫鱼致死率80%、蛙70%、小白鼠100%;TG-5菌鲫鱼致死率达70%、蛙40%、小白鼠100%。两株菌均能对鲫鱼、美蛙、小白鼠造成出血性病变,肝脏、肾脏与脾脏的病变较明显。张玉芬 [10] 对感染嗜水气单胞菌的鱼类病理变化的描述和孟彦 [11] 与钟蕾 [12] 对大鲵感染嗜水气单胞菌后的病例症状的描述与我们的结论相符。两株菌对美蛙的致死率较鱼和小鼠低,可以说明美蛙对嗜水气单胞菌的抵抗力较鲫鱼、小白鼠强,TG-2对动物的致病性更强,引起的败血症更为严重。美蛙和大鲵在自然环境下抵抗力较强,这一现象在实验室攻毒结果上亦可体现。
由于蛙与大鲵都为两栖动物,两者在生理结构生活特性等方面近似,大鲵为国家保护动物,资源非常珍贵,养殖大鲵因价格等因素限制了致病菌研究。本课题意图将美蛙作为大鲵的病原菌感染的实验动物模型进行探索,并通过感染死亡蛙的病理组织观察了解蛙和大鲵异同。感染后的美蛙临床病理症状显示皮肤溃疡,腹部与四肢出现大量红色出血点,腹水增多,泄殖孔出血,脾脏肿大,肝脏肿大有黄色斑纹或白色坏死灶,肾肿大出血。宋婷婷 [13] 用嗜水气单胞菌感染棘胸蛙后,患病棘胸蛙体表泛白,肝脏发黑,无红腿症,其病理症状与嗜水气单胞菌感染美蛙不同,分析其原因可能与蛙品种不同有关。感染死亡的美蛙肝脏、肾脏病理切片显示肝细胞肿大,胞质溶解,空泡变性,细胞核浓缩、碎裂,肝索紊乱,出血,肝血窦扩张。肾间质出血,肾小囊扩张,充满蛋白渗出物,肾小管官腔出现渗出物,由此组织细胞病变导致肝脏肿大出血,肾脏充血肿胀。与资道荣 [14]、于喆 [15] 报道牛蛙嗜水气单胞菌病理症状和病理切片相似。刘大志 [16] 在对感染嗜水气单胞菌的大鲵病理切片观察中发现大鲵肝细胞索排列紊乱,肝细胞肿胀,肝血窦扩张,肝细胞空泡变性。肾间质出血,肾小管上皮细胞空泡变性,肾小管内有少量红细胞,肾小囊肿大,有少量红细胞和蛋白渗出物。与本试验中美蛙病理切片所观察到的结果相似。重庆大鲵嗜水气单胞菌致死大鲵的组织病理与接种大鲵源嗜水气单胞菌致死的美蛙组织病理学之间的关系有待进一步研究。
由TG-2与TG-5对21种抗生素敏感性的测定结果表明,两株菌的耐药性较高,特别是TG-5对试验所使用的21种抗生素中18种耐药。TG-2与TG-5两种菌对头孢他啶、多粘菌素B敏感,TG-2对头孢哌酮、头孢曲松、头孢他啶、米诺环素、多粘菌素B高度敏感。四环素类中多西环素、四环素,磺胺类中复方新诺明和喹诺酮类中诺氟沙星广谱,β-内酰胺类中半合成青霉素哌拉西林、羧芐西林、氨芐西林、苯唑西林等对革兰阴性杆菌有较强抑菌作用,但TG-2与TG-5菌的实验结果均为耐药,说明该养殖场的病死大鲵体内病原菌对哌拉西林、羧芐西林、氨芐西林、苯唑西林等药物产生了耐药。氨基糖苷类中新霉素、卡那霉素、庆大霉素、丁胺卡那对需氧革兰阴性杆菌作用强,而一代头孢对阴性菌效果弱,二、三代头孢较一代对阴性菌作用强,所以TG-2对氨基糖苷类和β-内酰胺类中二、三代头孢敏感。从肖丹 [17]、王宏博 [18]、蔡丽娟 [19]、童照威 [20] 等的嗜水气单胞菌耐药性研究中,均得出了嗜水气单胞菌对大多数β-内酰胺类,喹诺酮类(主要为沙星类),复方新诺明,四环素类等药物耐药性较高,对氨基糖苷类(除开链霉素),β-内酰胺类中二、三代头孢等药物敏感的结果。嗜水气单胞菌多重耐药的菌株,会对大鲵生产和疾病治疗造成极大困难。因此临床若能运用药敏试验结果科学选用药物,制定合理治疗方案,对养殖生产具有重要的意义。
基金项目
国家科技支撑计划项目:黑龙江等流域冷水鱼健康养殖关键技术继承与示范(2012BAD25B10: 2012BAD25B10-1),开州农委采购项目:大鲵病害防控研究技术服务(2015ZFCG150)。