1. 引言
从植物根际土壤中分离到一株具有广泛抑菌谱的菌种,经鉴定为枯草芽孢杆菌(Bacillus subtilis),命名为Bs-W5。Bs-W5对苹果腐烂病菌(Valsa ambiens)、杨树溃疡病菌(Dothiorella gregaria)、腐皮镰刀菌(Fusarim solani)、葡萄座腔菌(Botryosphaeria dothidea)等九种植物病原菌和常见的大肠杆菌(Escherichia Coli)、金黄色葡萄球菌(Staphylococcus aureus)均有不同程度的抑制作用 [1] [2] 。本文优选了枯草芽孢杆菌Bs-W5摇瓶培养基组分以及培养条件。
2. 实验材料与试剂
2.1. 实验菌株
枯草芽孢杆菌Bs-W5,由本实验室分离和保藏。
2.2. 培养基和培养条件
牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂16 g,水1000 mL,调节pH至7.0~7.2;
种子培养基:葡萄糖20 g,蛋白胨10 g,酵母膏5 g,水1000 mL,调节pH至7.2;
以上培养基均在121℃条件下灭菌20 min;
初始培养条件:培养温度30℃,转速180 r/min,接种量5%,装液量100 mL/250mL。
2.3. 实验试剂
碳源:葡萄糖,玉米粉,蔗糖,可溶性淀粉,小麦粉,乳糖,麦芽糖;
氮源:蛋白胨,酵母膏,牛肉膏,大豆粉,鱼粉,尿素,(NH4)2SO4,KNO3;
无机盐:MgSO4,MnSO4,CaCO3,KH2PO4。
3. 实验方法
3.1. 活菌数测定
采用平板菌落计数法中的涂布平板法:采用梯度稀释法,分别吸取合适的3个梯度各0.1 mL菌液稀释液加入牛肉膏蛋白胨培养基中,用涂布棒充分涂开。待稀释菌液被培养基吸收后,放入生化培养箱30℃培养20~24 h,待其出现单菌落开始计数 [3] 。每梯度三个平行。
3.2. Bs-W5在种子培养基中的生长曲线测定
经活化的枯草芽孢杆菌Bs-W5在牛肉膏蛋白胨培养基上培养24 h后,接种3环到种子培养基中,种子培养基装液量50 mL/250mL,在30℃、180 r/min条件下培养,每隔2 h测定培养基中的活菌数,绘制生长曲线 [4] 。
3.3. 发酵培养基组分的筛选
1) 初始发酵条件:温度30℃,转速180 r/min,装液量100 mL/250mL,接种量5%,接种菌龄:22 h [5] 。
2) 不同碳源对Bs-W5活菌数的影响
以初始培养基(葡萄糖,蛋白胨,MgSO4,KH2PO4)为基础,选择不同的碳源(蔗糖,可溶性淀粉,玉米粉,小麦粉,乳糖,麦芽糖)来替换原来的碳源葡萄糖,在初始发酵条件下培养12 h后每隔6 h取样测定活菌数 [6] ,考虑到发酵时间问题,所有碳源培养基培养时间设为72 h。
3) 不同氮源对Bs-W5活菌数的影响
将上述筛选出的碳源替换初始培养基中的碳源,然后选择不同的氮源(酵母膏,牛肉膏,大豆粉,鱼粉,尿素,(NH4)2SO4,KNO3)来替换原来的氮源蛋白胨 [7] ,在初始发酵条件下培养12 h后每隔6 h取样测定活菌数。
4) 无机盐对Bs-W5活菌数的影响
将筛选出的碳源和氮源替换初始培养基中的碳氮源,根据朱晓立等 [8] 分别考察在培养基中只加入5 g/L CaCO3、只加入0.2 g/L MnSO4、加入5 g/L CaCO3和0.2 g/L MnSO4三种不同情况下Bs-W5的生长情况,以不加入CaCO3和MnSO4做空白对照。初始培养条件下培养12 h后每隔6 h测定活菌数。
5) 速效碳氮源和迟效碳氮源组合对Bs-W5生长的影响
在筛选出的碳源、氮源、无机盐培养基中加入速效碳源葡萄糖和速效氮源KNO3,加入量都为5 g/L,则培养基的组分为葡萄糖5 g/L,玉米粉15 g/L,KNO3 5 g/L,大豆粉15 g/L,MgSO4 2 g/L,KH2PO4 0.5 g/L,CaCO3 5 g/L,MnSO4 0.2 g/L [8] 。另外设只加入葡萄糖不加入KNO3为一组,只加入KNO3不加入葡萄糖为另外一组,不加入葡萄糖和KNO3为对照组。培养12 h后每隔6 h测定活菌数 [9] 。
3.4. 摇瓶发酵培养条件的优化
根据响应面优化法得到最佳的培养基各成分含量后,采用单因素试验法 [10] 测定pH值、培养温度、摇瓶装液量、接种量和摇床转速5个因素对Bs-W5摇瓶发酵的影响。
1) pH值
250 mL锥形瓶中各装入100 mL培养基,用1 mol/L的HCl和NaOH溶液调节培养基的pH值分别为:4、5、6、7、8、9、10,接种之后30℃培养,培养12 h后每隔6 h取样测定活菌数 [11] 。
2) 温度
250 mL锥形瓶中各装入100 mL培养基,摇床转速设为180 r/min,分别在25℃、27℃、30℃、32℃,35℃、37℃条件下摇床培养,培养12 h后每隔6 h取样测定活菌数。
3) 摇瓶装液量
把温度设为32℃,摇瓶装液量分别设为:25 mL/250mL、50 mL/250mL、75 mL/250mL、100 mL/250mL、125 mL/250mL,培养12 h后每隔6 h取样测定活菌数。
4) 接种量
250 mL锥形瓶中各装入75 mL培养,接种量分别设为3%、5%、7%、10%,培养12 h后每隔6 h取样测定活菌数,培养时间设为72 h。
5) 摇床转速
250 mL锥形瓶中各装入75 mL培养基,种子培养22 h时接种,培养温度设为32℃,转速分别设为140 r/min、160 r/min、180 r/min、200 r/min、220 r/min,培养12 h后每隔6 h取样测定活菌数,培养时间设为72 h [12] 。
4. 实验结果与分析
4.1. Bs-W5在种子培养基中的生长曲线
种子培养基是整个发酵过程的开始,接种量的大小和接种时间对整个发酵过程有着重要的影响,接种时间过早,种子培养基中的菌体总数过少,发酵时间延长;接种时间过晚,有芽孢生成,且会带入发酵产物,菌体活性降低 [13] ,对发酵过程也是不利的,所以Bs-W5在种子培养基中的生长曲线对于整个发酵过程有着非常重要的作用 [14] ,必须明确Bs-W5生长的最大菌数的时间。Bs-W5在种子培养基中生长曲线如图1所示:

Figure 1. The curve of between viable count and incubation time in the seed medium
图1. Bs-W5在种子培养基中的活菌数与培养时间曲线图
从图1中可以看出,枯草芽孢杆菌Bs-W5在前6 h处于调整期,随后开始指数期增长,在22 h时菌数达到最大(8.80 × 108 cfu/mL),22 h过后菌数开始减少并趋于稳定,说明此时种子培养基成分开始耗尽,枯草芽孢杆菌Bs-W5开始大量形成芽孢。所以,种子的接种时间定为22 h。
4.2. 培养基组分的筛选结果
1) 碳源的筛选结果
培养基中的碳源主要是为菌体的生长繁殖提供所需能量,同时为构成细胞结构和代谢所需物质提供碳素来源 [15] 。不同的碳源对整个发酵的进程和结果有着重要的影响,因此必须综合考虑不同碳源对Bs-W5生长情况的影响。枯草芽孢杆菌Bs-W5在不同碳源中的生长情况如图2所示。
从图2的结果中可以看到,在7种碳源中,葡萄糖、蔗糖和玉米粉的活菌数较高,以葡萄糖的活菌数为最高,但是三者之间相差不大,但考虑到以后的工业发酵成本,选择玉米粉作为Bs-W5发酵的碳源。
2) 氮源的筛选
发酵培养基中的氮源为合成菌体的细胞结构如蛋白质、核酸等提供物质来源,同时也可以为菌体的生长提供能量 [16] ,氮源可以分为有机氮源和无机氮源,其中,无机氮源一般可以作为速效氮源添加,从而起到辅助作用。Bs-W5在不同的氮源中的生长情况如图3所示。
从Bs-W5在不同的氮源中生长的情况可以看到,Bs-W5在蛋白胨中的活菌数是最高的,其次是牛肉膏和大豆粉,出于工业发酵的成本考虑,选择大豆粉作为发酵培养的氮源。在无机氮源中,KNO3的效果

Figure 2. Effect of different carbon sources on viable count of strain Bs-W5
图2. 不同碳源对Bs-W5的活菌数的影响

Figure 3. Effect of different nitrogen sources on viable count of strain Bs-W5
图3. 不同氮源对Bs-W5的活菌数的影响
是最好的,下一步可以作为考虑作为速效氮源添加。
3) 无机盐的筛选
锰元素是枯草芽孢杆菌生长的必须元素,Mn2+能够诱导芽孢生成,对菌体转化为芽孢有促进作用。Ca2+主要参与降低细胞的胶体状态和通透性、调节pH值等生理活动调节菌种的生理状态 [17] 。分别添加MnSO4、CaCO3以及同时添加MnSO4和CaCO3对Bs-W5的生长情况影响如图4所示:
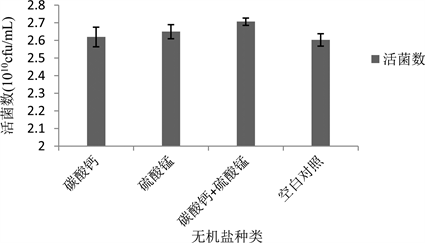
Figure 4. Effect of different inorganic salt on viable count of strain Bs-W5
图4. 添加不同无机盐对Bs-W5活菌数的影响
从结果中可以看到只添加MnSO4、只添加CaCO3以及同时添加MnSO4和CaCO3三种情况对芽孢生成率和活菌数都有促进作用,其中同时添加MnSO4和CaCO3的促进作用最明显,活菌数比对照组和其他两组要高,这可能是因为MnSO4和CaCO3都能够促进芽孢的生成,使得菌体转化为芽孢的转化率提高,总体活菌数的数量也增加。所以,在培养基中同时添加MnSO4和CaCO3。
4) 速效碳氮源和迟效碳氮源组合对Bs-W5生长的影响
枯草芽孢杆菌Bs-W5对不同碳、氮源的利用速度不同,在发酵初期会首先利用速效碳源和氮源,有利于菌体在最短时间内快速生长,待菌体数量增多时,再利用迟效碳、氮源,从而可以保证菌体生长过程中所需要的营养物质 [18] 。Bs-W5在不同的速效碳氮源中生长情况如图5所示:

Figure 5. The effect of quick-acting carbon and nitrogen sources on viable count of strain Bs-W5
图5. 添加速效碳氮源对Bs-W5活菌数的影响
从上图的结果中可以看到,速效碳、氮源中的葡萄糖和KNO3对Bs-W5的活菌数都有促进作用,其中同时添加葡萄糖和KNO3的促进作用最明显,添加葡萄糖次之。但是添加了速效碳源葡萄糖的两种培养基中的芽孢生成时间比对照组要延迟,这可能是因为葡萄糖对Bs-W5的芽孢生成有延迟作用。而单独添加速效氮源KNO3 时则对活菌数和芽孢生成都有促进作用,可能是因为菌体在前期能够利用速效氮源从而可以快速生长,对整个发酵过程都有促进作用。所以在培养基中添加KNO3作为速效氮源。
4.3. 摇瓶培养条件的优化
1) 初始pH值
pH值会影响菌体的细胞原生质膜的电荷、细胞内酶的活性和某些重要的代谢产物的离解,从而影响菌体的繁殖,因此培养基必须有最适的初始pH值 [19] 。初始pH值对Bs-W5的生长影响如图6所示。

Figure 6. Effect of initial pH on the viable count of strain Bs-W5
图6. 初始pH值对Bs-W5活菌数的影响
从上图初始pH值对Bs-W5活菌数的影响结果可以看到,pH值过大和过小对活菌数生成有抑制作用。当pH值为7时,活菌数最多,所以培养基的最初pH值设为7.0。
2) 温度
温度对菌体的影响,是综合影响各种代谢反应的结果。温度影响蛋白质和酶的合成与活性、RNA的结构稳定性和转录,从而影响到菌体的生理活动 [20] 。高温会影响菌体内蛋白质和酶的活性,从而影响菌体的生长和繁殖;低温会抑制菌体的生长。温度过高和过低,都会使枯草芽孢杆菌的生长缓慢。

Figure 7. Effect of temperature on the viable count of strain Bs-W5
图7. 温度对Bs-W5活菌数的影响
从图7的结果中可以看到,温度过低和过高会造成活菌数的减少,当温度为32℃时,活菌数较多。所以培养温度选择32℃。
3) 摇瓶装液量
摇瓶的装液量直接影响发酵液的溶氧量,而枯草芽孢杆菌是一种好氧菌,不论是菌体的生长繁殖还是芽孢的生成都需要充足的氧气 [21] ,摇瓶的装液量会影响到菌体对氧气的获得能力。
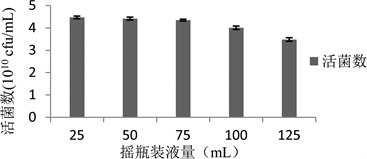
Figure 8. Effect of liquid volume in flask on the viable count of strain Bs-W5
图8. 装液量对Bs-W5活菌数的影响
从装液量对Bs-W5的生长影响结果(图8)中可以看到,装液量对活菌数的影响不是很大,只有最大装液量125 mL的活菌数明显减少。虽然装液量少有利于菌体芽孢的生成,但是发酵液的总得活菌数是比较少的,综合考虑芽孢形成率、活菌数及培养基总活菌数,最后选择装液量为75 mL。
4) 接种量
接种量过小会使发酵的延迟期延长,延长发酵周期,而接种量过大则会带进较多的代谢废物不利于菌体的生长。所以,最适的接种量对发酵的进程很重要。
从图9的结果可以看到,较低和较高的接种量都会对活菌数的产生抑制的影响。只有当接种量为5%时,活菌数是最高的,所以接种量选择5%。
5) 摇床转速
枯草芽孢杆菌是一种好氧菌,生长过程和芽孢的生成都需要氧气的存在,足够的通气量对菌体生长是有利的,但是溶氧量过高的话,会导致菌体自溶使得芽孢数减少。所以通气量必须保持在一定的范围内。

Figure 9. Effect of inoculation amount on the viable count of strain Bs-W5
图9. 接种量对Bs-W5活菌数的影响

Figure 10. Effect of rotation speed on the viable count of strain Bs-W5
图10. 转速对Bs-W5活菌数的影响
从图10的结果可以看到,转速的提高对活菌有促进作用,当转速为200 r/min的时候,活菌数达到了最高,可能的原因为转速的提高可以让枯草芽孢杆菌与氧气更好的接触,所以活菌数提高,而转速过高可能会对菌体有所损害,所以转速选择200 r/min。
5. 结论
以具有广谱生防作用的枯草芽孢杆菌Bs-W5为出发菌株,先利用单因素试验筛选综合考虑最佳的碳源、氮源和无机盐,再利用速效碳氮源和迟效碳氮源组合来测定速效碳、氮源对菌体生长的影响。确定培养基组分之后,分别考察初始pH值、培养温度、摇瓶装液量、接种量和摇床转速对Bs-W5的生长的影响,得到最佳的培养条件为:pH 7.0,培养温度设为32℃,摇瓶装液量为75 mL/250mL,接种量为5%,摇床转速设为200 r/min。培养基的组分为玉米粉15 g/L,大豆粉15 g/L,KNO3 5 g/L,MgSO4 2 g/L,KH2PO4 0.5 g/L,CaCO3 5 g/L,MnSO4 0.2 g/L,水1000 mL。
致谢
本文得到以下项目资助:
西安医学院配套基金项目(2017PT14);
西安医学院博士科研启动基金项目(2016DOC16);
西安医学院国家基金培育项目(2017GJFY16);
西安医学院大学生开放科研实验项目(2018DXS2-15)。