1. 引言
人类寿命的极限是一个生物医学问题,也是哲学问题。探索人类寿命极限,寻找延长寿命的方法同时也是生物医学家孜孜不息的追求 [1] 。老化是不可避免的,数千年来,无论是尝试长寿丹药的炼制,还是幻想的方法(如用处女血的洗浴等)都无济于事 [2] 。近半个世纪以来,人们对生命本质探索和抗衰老相关研究层出不穷的成果,已使人类平均期望寿命达到前所未有的高度并仍在不断提高着。Scully发表在《自然》杂志的文章中绘制了从1950到2010人类社会年龄构成金字塔结构图(附图1),很好地阐述了社会发展正在且继续大幅度提高着人类的平均期望寿命 [3] 。
随着人类基因图谱的绘制,多个长寿基因的发现,干细胞移植研究的深入,特别是2009年端粒的发现和2012年细胞核重新编程两项诺贝尔生理学或医学奖成果的问世正促进着生物医学家努力回答是否可以通过生物医学干预技术延长人类寿命这个难题。例如,端粒能够稳定人的染色体,生长过程中端粒逐渐缩短,若端粒过短则无法维持基因组稳定性,会导致细胞的老化和机体的衰老。端粒酶能够维持端粒长度,端粒酶活性降低,端粒缩短。端粒酶的激活一方面能够维持正常细胞生存,另一方面可使肿瘤细胞生存期延长。通过调控端粒、端粒酶活性来调节生长与衰老的平衡,可为疾病的治疗提供指导 [4] ,以达到延长人类寿命的目的 [4] 。Gurdon认为如果DNA去甲基化酶和其他核重新编程相关分子过度表达,人体任一细胞都可产生大量多能性胚胎干细胞样细胞,可用于疾病治疗 [5] 。就现在的科学技术发展而言,应用生物医学技术延长人类寿命尚为时过早。但以生物医学最新成果为基础,以哲学思想作指导,通过正确的后天干预技术延长期望寿命是有效和可行的 [6] 。

Figure 1. Pyramid structure of age composition of human society from 1950 to 2010 [3]
图1. 1950年到2010年人类社会年龄构成金字塔结构图 [3]
2. 人类寿命的决定因素 [7]
寿命包括最长寿命和平均期望寿命。最长寿命是指在没有环境不利生命因素影响的情况下,具有良好的遗传长寿基因个体自然生长的最长寿命。平均期望寿命是指根据当时人类寿命状况预测某个群体平均的寿命。随着科学技术的进步,近半个世纪来人类的平均期望寿命正快速提高,但由于受遗传因素的限制最长寿命并不随科学技术的进步得以延长。
2.1. 人类最高个体寿命
不同的方法推算的人类最高寿限约为125岁。
1) 流行病学资料显示,有确切记录的人类历史上最长寿的人是法国的卡尔曼,享年122岁。
2) 人类胚胎细胞传代能力决定了人类寿命的最高寿限。人类细胞的寿命为50代,每一代细胞的寿命约为2.4~2.5年,人类最高寿限应为2.5 × 50 = 125岁。
3) 所有动物的最高寿限均与其生长期有关,即寿限是发育成熟期的5~7倍。人类的发育成熟期为18岁,最高寿命是其5~7倍,也大约为125岁。
2.2. 决定人类寿命的遗传因素
所有生命在从父辈获得生命遗传信息的同时也获得“死亡”信息。当生长、发育、生育后代的任务完成后,生命个体开始缓慢衰老。所有这些都由从父辈获取的遗传信息所调控。人类尚无法破解遗传基因如何调控生命的奥秘。但通过对比长寿老人与普通人群的携带基因,现代生物医学家已经找到能延缓衰老的长寿基因。携带这些基因的人更容易长寿。现代生物医学研究至少证明多个基因调节着人的寿命,其中较为被广泛认可的有:沉默蛋白(Sir2-related enzymes sirtuin)或沉默信息调节因子2(silence information regulator 2, Sir 2),玛士撒拉(Methuselah)基因,叉头框(Forkhead box O, FOXO),功能性雷帕霉素靶 (mechanistic target of rapamycin, mTOR),生长激素/胰岛素样生长因子1/(Growth hormone/ insulin-like growth factor 1, GH/IGF-1/)胰岛素通路等。
2.2.1. 玛士撒拉基因
玛士撒拉是《圣经》中所记录的最长寿的人。因此用此名命名一种长寿基因。该基因包括了一种叫做ADIPOQ的基因,它存在于约一成的青年人身上,但是有近百分之三十的百岁老人携带这种基因。“玛士撒拉”基因能够保护人们免受吸烟和不健康饮食的影响,以及使与老年相关的疾病(如癌症和心脏病)推迟三十年。玛士撒拉基因通过G蛋白偶联受体(G protein-coupled receptors, GPCRs)发挥作用。王等 [8] 证明玛士撒拉基因也通过mTOR分子通路发挥作用。
2.2.2. Sir2
Sir2是一类从古细菌到人类都遗传高度保守的烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD)依赖的组蛋白去乙酰化酶(histone deacetylase, HDAC),哺乳动物有7种sirtuin同源基因SIRT1-SIRT7,具有不同的亚细胞定位和功能。这些蛋白在细胞周期控制、维持线粒体的动态平衡、自噬和细胞生长调节等过程中发挥重要作用 [9] 。Sir2通过调节卡路里限制的多重效果发挥其长寿作用并显著降低癌症、心血管疾病和糖尿病风险 [10] 。
2.2.3. FOXO基因
当人类变老的时候,体内的干细胞便失去了繁殖的能力,因此肌肉慢慢衰退。德国科学在研究水螅老化过程中发现了FOX0基因。这种基因在动物和人类身上都存在,这是早就被发现的,但是直到最近才发现,这种基因正是影响人类干细胞再生的因素。与年轻人相比FOX03A存在于百岁老人体内的情况更加普遍。比较大样本德国百岁老人和年轻人的DNA样本后还发现,FOX03A基因发挥的作用覆盖各不同人种。一项流行病学研究显示,通过对德国1762名百岁及90岁以上的德国长寿老人的DNA样本与年轻人的DNA样本比较后确认了FOXO3A基因确为长寿基因。哺乳动物FOXO基因组包含四个亚型FOXO1,FOXO3,FOXO4和FOXO6。FOXO基因通过以下关键的细胞过程实现长寿:调节应激抵抗,代谢,细胞循环和凋亡,以及调节胰岛素和胰岛素样生长因子信号 [11] 。
2.2.4. mTOR [12]
最早发现mTOR能调节老化的证据是从酿酒酵母获得的。研究发现编码mTOR下游S6K-SCH9基因的耗竭导致酵母寿命延长两倍 [13] 。其后不久研究发现mTOR(let-363)或mTORC1组分(daf-15)的突变或RNA干扰(RNAi)敲除能有效延长寿命 [14] 。进一步的研究证明mTOR和MTORC1部分构件的突变也延长果蝇寿命 [15] 。更多的研究显示mTOR抑制剂,雷帕霉素能有效延长酵母,线虫,果蝇 [16] 小鼠 [17] 寿命,mTORC1起着至关重要的作用。
mTOR的发现从分子水平阐明了为何饮食控制能显著延长寿命。mTOR作为营养感受器调节着细胞周期和机体生长,进而调节寿命长短。当过度进食时,mTOR被激活,促进生长相关激素(生长激素、胰岛素样生长因子1等)释放,促进蛋白合成,加速细胞生长。反之,饮食控制通过mTOR抑制了生长相关激素的分泌,减缓蛋白合成和细胞生长,结果是延寿。
2.2.5. GH/IGF-1/胰岛素通路
从低级蠕虫到哺乳动物,GH/IGF/胰岛素通路进化保守性高度提示GH/IGF/胰岛素通路活性的下调对延长寿命甚为重要。一个个体从一个受精卵发育成熟,GH/IGF/胰岛素通路起着至关重要的作用,但发育成熟后GH/IGF/胰岛素通路的过度活化会促进老化。Vitale等的研究显示,GH/IGF/胰岛素通路的抑制在百岁老人更为常见,且更有助于预防老化相关疾病(如心血管疾病,癌症) [18] 。
2.3. 环境因素对寿命的影响
与寿命相关的基因决定了人的生物学寿命,即如果没有任何疾病和外界损伤,细胞生长到不能再合成新的DNA,并长出新的细胞的时候人的年龄。而后天我们生存环境中不利于生存的因素,如空气污染、不洁饮食、不洁饮水等以及个体不正确的生活方式均不利于细胞正常自然的生长,也严重影响到寿限。这也是决定寿命之内因与外因的关系。影响寿命的社会环境因素需要通过社会的发展,进步和人们共同的努力逐步改善。个体的生活方式是我们自己能够调控的也是最为有效的延寿干预技术。毋容置疑,心理平衡是影响健康、长寿的最关键因素。刘超正等的案例研究证明心理平衡性对总的心理健康状况与身体健康状况有影响 [19] 。其作用机制十分复杂,另文论述,本文仅结合上述生物医学研究最新进展论述通过营养平衡和运动干预延寿的医学理论支持和哲学思考。
3. 延寿的干预技术
能活过百岁的人仅约1/10,000 [1] 。应用现代生物医学知识提高更多人的寿命更为重要。如限制小鼠饮食到接近饥饿状态,同时保证营养素的摄入能延长其寿命50% [1] 。
世界卫生组织曾指出:至少80%的早发心脏病、中风和2型糖尿病,以及40%的癌症可以通过饮食、经常性锻炼和避免烟草制品来预防 [20] 。显然,80%以上的早发心脏病、中风和Ⅱ型糖尿病,以及40%以上的癌症的预防对大幅度提高平均期望寿命具有极为重要的意义。后天干预可以通过改变各种长寿基因的表观遗传学实现延寿。
3.1. 饮食控制与延寿
3.1.1. 饮食控制延寿的流行病学证据
一战时期(1917~1918年),受战争影响,丹麦人不得不减少热量摄入限制,战后统计资料分析显示,由于战争期间被动的热量摄入限制反使其死亡率比热量供给充足的战前降低34% [21] 。相似地,二战时期(1940~1945)瑞典奥斯陆人摄入的热量由战前(1936~1937年)的3470千卡/天降到2850千卡/天,两年后死亡率降低30% [22] [23] 。二战后直到1960年日本冲绳居民摄入的热量为1785千卡/天,同期日本本土居民为2068千卡/天,美国居民为2980千卡/天。1960年冲绳成年人体质量指数为21,与美国和日本本土居民相比,心血管疾病和肿瘤死亡率锐减。到1995,美国男性心血管疾病死亡率为193/100,000,而冲绳男性为33/100,000。2000年65岁冲绳女性和男性平均期望寿命分别为24.1岁和18.5岁,相比较美国女性和男性分别为19.3岁和16.2岁。1990年以后,冲绳年轻一代饮食结构融入西方习惯,摄入热量与日本本土和美国相似,寿命和老化疾病的发病率也与后二者相似 [24] 。1991年美国的生态圈二号实验显示,4名男性和4名女性进入生态圈后,前6个月,每天摄入热量由实验前的2500千卡降到1784千卡/天,后18个月每天摄入热量为2000千卡,同时体力活动为70~80小时/周。2年期实验结束时,参与实验者男性的BMI由23.7 ± 1.8减到19.3 ± 0.9,女性由21.2 ± 1.5减到18.5 ± 1.2,血压从110/78降低到90/50 mmHg [25] 。
3.1.2. 饮食控制与生长发育
如图2所示,平均期望寿命曲线是一条抛物线,最高点位于饮食控制到有饥饿感时,随着进食的增加平均期望寿命不断减低。反之,生殖能力曲线随进食增加逐步上升。这与器官功能相一致。消化系统负责摄入能量,保证生长发育和各种应激的适应。这就需要消化系统必须具有较强的能量摄入能力。事实上,满足食欲所吸收的能量远大于身体生长发育最低需要。而长期摄入超过基本能量需要的食物,除激活mTOR通路促进蛋白合成和细胞生长外,势必导致超出部分以脂肪形式储存起来,这就是身体发育成熟后体型变化和代谢紊乱的原因。而摄入增加表明有足够的食物维持生长和繁殖后代,因此生殖能力的增强就不足为怪了。
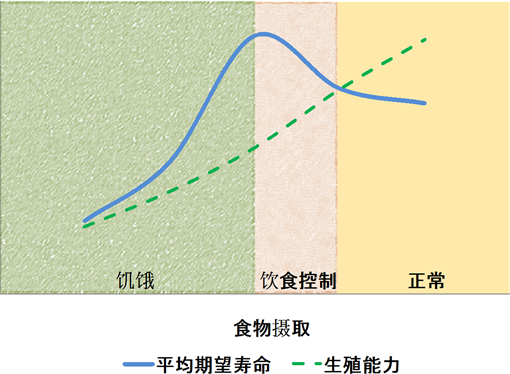
Figure 2. Effects of food intake on average life expectancy and reproductive capacity
图2. 食物摄取对平均期望寿命、生殖能力的影响
3.1.3. 饮食控制延寿的分子机制
正如上文所述,饮食(卡路里)限制提高生命质量的动物研究显示,饮食(卡路里)限制25%~30% (外因)能通过多个相关基因(如mTOR [26] ,Sir2 [27] ,GH/IGF-1/胰岛素通路 [26] ) (内因)调控能量代谢,抑制各种老化性疾病病理的发生、发展,促进生命质量的提高。
3.1.4. 饮食控制延寿应遵循的医学理论
为延寿进行的饮食控制主要是卡路里控制。我们摄入的饮食中除了含有新陈代谢所需的基本卡路里外,还含有其它机体必须的营养素:氨基酸、维生素、微量元素、无机盐类。控制卡路里的摄入,同时保证其它机体必须营养素摄入是应遵循的基本原则。一般而言,谷类食物是卡路里的主要来源,蔬菜、水果类可提供大量维生素和微量元素,瘦肉类含有高质量氨基酸,海产品中各种氨基酸、微量元素、维生素含量较为丰富 [28] 。因此,最好的饮食控制是控制摄入总量,但摄入食物必须多样化。
3.2. 运动与延寿
美国运动流行病学专家Steven Blair指出:缺乏运动和体力活动将成为21世纪最大的公共卫生问题 [29] 。运动即医学(exercise is medicine)的概念正在形成 [30] 。运动通过多种机制实现延寿。
3.2.1. 运动延缓端粒的缩短
2009年生理学或医学诺贝尔奖的成果是发现端粒作为DNA计时器调控寿命 [31] 。端粒是DNA末端一段序列,起着保护DNA的作用。随着老化,端粒缩短,端粒消耗殆尽之时也是DNA失去保护损伤之时。研究显示,任何形式的运动都能有效延缓端粒的短缩,且这一作用有明显的量效关系,即随着运动量的增加,防止端粒缩短的效果愈加显著 [32] 。
3.2.2. 运动预防老化性疾病
运动、增加能量消耗,起着与饮食控制异曲同工的延寿效果虽然运动增强新陈代谢,但与过度摄入食物不同,运动主要是促进分解代谢,而摄入食物激活mTOR的结果是促进蛋白合成,加速细胞生长。二者截然不同。运动增加能量消耗,减轻了机体负担,进而有效预防了糖代谢和脂代谢紊乱,其结果就是预防老化性疾病的发生,预防老化,延长寿命 [33] 。
3.2.3. 运动全面提高人体适应能力
任红等 [34] 全面总结了评价人体适应能力指标(图3)。运动本身就是在各种不利于人体机能发挥的环境中的机体活动。显然运动本身就是提高机体适应能力的方式。因此,运动能有效提高对疾病的抵抗能力,运动通过增强各器官功能提高对自然环境的适应能力。运动对心理平衡也具有显著的提高作用 [35] 。运动通过心理调节也有助于提高人体对家庭、社会、工作环境的适应能力。

Figure 3. Indicators for evaluating human adaptability
图3. 评价人体适应能力指标
4. 结论
基因技术的应用大大促进了老化生物学研究,以发现多个长寿基因研究为代表的一批老化生物学研究成果丰富了我们对生命本质和老化现象的认识。以现代老化生物学研究成果为基础,生物医学家提出了提高生命质量的有效方法。除了改善我们的生活环境能有效地提高生命质量外,正确的生活方式对提高生命质量至关重要。饮食控制是提高生命质量的最有效方法之一,现代研究已从分子基因水平给予很好的解释,即饮食控制通过抑制mTOR和促进自噬延缓细胞衰老、预防各种老化性疾病。针对随老化出现的代谢障碍以及超体重进行运动对有效遏制糖代谢和脂代谢障碍,保护端粒,延长寿命,预防各种老化性疾病的发生、发展具有重要作用。现代医学研究最显著的进展之一就是实现了医学模式的转化,社会—心理—生物医学模式强调现代人所面临的压力不利于生命质量的提高,而正确面对压力,提高适应能力就成为提高生命质量之关键。
基金项目
山西省回国留学基金重点项目2017-重点4。
参考文献