1. 引言
南沙参为桔梗科植物轮叶沙参Adenophora tetraphylla (Thunb.) Fisch或沙参Adenophora stricta Miq.干燥根。春、秋二季采挖,除去须根,洗后趁鲜刮去粗皮,洗净,干燥。养阴清肺,益胃生津,化痰,益气。用于肺热燥咳,阴虚劳嗽,干咳痰黏,胃阴不足,食少呕吐,气阴不足,烦热口干 [1] 。现代研究证明,南沙参含有生物碱类、β-谷甾醇及其衍生物、三萜类、多糖类、磷脂类、糖苷类等多种活性成分,并具有免疫调节、抗辐射、抗衰老、清除自由基、保肝等多种药理作用 [2] 。截至目前,该药材收载于《中国药典》第1部(2015版) 244~245页,药材质量标准只有简单的薄层鉴别和浸出物测定,且关于南沙参栽培种植、资源调查、与其他沙参的鉴别比较、化学成分、药理作用的研究较多 [3] - [8] ,但南沙参指纹图谱的研究报道较少。为保证其质量的稳定性,加强资源利用与开发,本实验对9批次的南沙参药材,采用药典方法进行了TLC鉴别,并建立了HPLC指纹图谱研究,确定了3个共有色谱峰,建立了南沙参指纹图谱共有模式,为南沙参的质量控制及科学评价,提供试验依据。
2. 材料
南沙参,批号:160901、160902、161010、161011、170319,170320、170811,170812、171002购自云南宗顺生物有限公司,经云南省药物研究所邱斌高级工程师鉴定,标本保存于云南省药物研究所标本室;产地见表1;南沙参对照药材,中国食品药品检定研究院,批号121499-201605。蒲公英萜酮,中国食品药品检定研究院,批号112006-201702。
Thermo UltiMate3000系列高效液相色谱仪(LPG-3400四元泵、WPS-3000 SL自动进样仪、TCC-3000柱温箱、DAD-3000二极管阵列检测器和Dionex Chromeleon工作站);超声波清洗器SK8200 HP (上海科导超声仪器有限公司);METTLER-TOLEDO AG-285型电子分析天平(METTLER-TOLEDO (上海)有限公司生产);ZF-90多功能暗箱式紫外投射仪(上海宝山顾村电光仪器厂);薄层色谱展开缸(上海信谊仪器厂);青岛海洋普通G板(青岛海洋化工厂分厂)。
乙腈为色谱纯(Merck公司);重蒸水(由Milli-Q纯水制备系统制备),其他试剂为分析纯。
3. 实验过程
3.1. TLC鉴别
《中国药典》第1部(2015年版)南沙参【鉴别】项中采用了薄层色谱法,以蒲公英萜酮作为对照品进行南沙参的鉴别。本实验采用药典方法,对不同产地的南沙参进行了TLC鉴别。
3.1.1. 溶液制备
供试品溶液制备:取各产地药材粉末2 g,加入二氯甲烷60 mL,超声处理30分钟,滤过,滤液蒸干,残渣加二氯甲烷1 mL使溶解,作为供试品溶液。
对照品溶液制备:取蒲公英萜酮对照品,加二氯甲烷制成每1 mL含0.2 mg的溶液,作为对照品溶液。
对照药材溶液制备:南沙参对照药材2 g,同法(同供试品溶液制备方法)制成对照药材溶液。
3.1.2. 鉴别
照薄层色谱法(2015版中国药典通则0502)试验,吸取上述三种溶液各5 μL,分别点于同一硅胶G薄层板上,以正己烷–丙酮–甲酸(25:1:0.05)为展开剂,置用展开剂预饱和20分钟的展开缸内,展开,取出,晾干,喷以2%香草醛硫酸溶液,在105℃加热至斑点显色清晰。结果表明,供试品与对照药材在相应位置显示相同的斑点,如图1所示。
 7对照品:蒲公英萜酮;10对照药材;1~6、8~10;9批药材
7对照品:蒲公英萜酮;10对照药材;1~6、8~10;9批药材
Figure 1. TLC of Adenophora radix
图1. 南沙参薄层色谱图
3.2. HPLC指纹图谱研究
3.2.1. 色谱条件
色谱柱为Thermo Acclaim TM120 C18 (4.6 × 250 mm,5 μm),流速为1.0 ml/min,柱温为30℃,进样量为10 μl,检测波长为203 nm,梯度洗脱(A)乙腈-0.5%磷酸溶液(B) (见表2),检测时间60 min。

Table 2. Mobile phase gradient mode
表2. 流动相梯度表
3.2.2. 供试品溶液的制备
取南沙参粉末(过五号筛)约2.0 g,精密称定,精密加入甲醇50 ml,称定重量,放置过夜,置80℃水浴上保持微沸1小时,放冷,滤过,浓缩至干,精密加入5 mL甲醇,摇匀,滤过,取续滤液,即得。
3.2.3. 方法学验证
1) 精密度试验
取同一份供试品(批号160901)溶液,在上述色谱条件下重复进样6次,记录指纹图谱。以3号峰为内参比峰,其它各个峰与其比较获得相对保留时间与相对峰面积。各色谱峰相对保留时间RSD小于0.35%,相对峰面积RSD小于3.00%,表明仪器精密度良好。
2) 稳定性试验
取同一份供试品(批号160901)溶液,在上述色谱条件下分别于0、2、4、8、24、48 h进样,记录指纹图谱。以3号峰为内参比峰,其它各个峰与其比较获得相对保留时间与相对峰面积。各主要色谱峰相对保留时间RSD小于0.45%,相对峰面积RSD小于2.15%,表明供试品溶液在48 h内基本稳定。
3) 重复性试验
取同一批供试品(批号160901) 6份,精密称定,按“3.2.2”项下方法制备供试品溶液,在上述色谱条件下进样,记录指纹图谱。以3号峰为内参比峰,其它各个峰与其比较获得相对保留时间与相对峰面积。各主要色谱峰相对保留时间RSD小于0.21%,相对峰面积RSD小于2.60%,表明供试品溶液的制备方法重复性良好。
3.2.4. 指纹图谱的建立及其相似度评价
1) 南沙参化学指纹图谱的建立
9批南沙参按“3.2.2”项下方法制备供试品溶液,各取10 μL分别进样,按确定的色谱条件进行HPLC分析,记录其指纹图谱。运用中国药典委员会“中药色谱指纹图谱相似度评价系统2004A版”对9批样品的指纹图谱进行分析,设定S1为参照图谱,进行多点校正,自动匹配,建立了南沙参药材指纹图谱,结果见图2,其中R为指纹图谱共有模式。共确定了3个共有峰。
2) 相似度评价
将9批样品色谱数据导入“中药色谱指纹图谱相似度评价系统”(2004A版)软件,以特征指纹图谱共有模式为对照,计算各批次样品的相似度。相似度可以体现不同批次样品间各成分在种类及其相对量上的整体相似程度。分析结果表明,不同批次南沙参药材指纹图谱相似度除S9批外均大于0.95,见表3,说明不同批次南沙参药材中化学成分相似度较高。
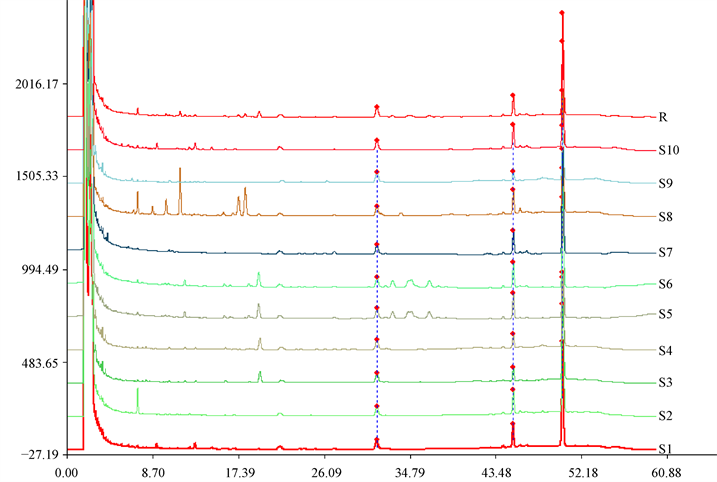
Figure 2. HPLC fingerprint of 9 batches of Adenophora radix samples
图2. 9批次南沙参药材HPLC指纹图谱

Table 3. Similarity evaluation results of 9 batches of medicinal materials
表3. 9批药材样品相似度评价结果
4. 讨论
TLC鉴别中参照药典方法进行9批南沙参检测,结果显示9批南沙参的斑点与对照药材斑点基本完全重合。在HPLC指纹图谱研究中,参照文献 [9] [10] 选择乙腈-0.5%磷酸为流动相;采用二极管阵列检测器在200~400 nm波长范围内进行三维图谱扫描,南沙参药材的主要峰的光谱图显示其最大吸收均为末端吸收,为了使各组分达到吸收强、干扰小的目的,检测波长选择在203 nm处;比较了不同温度25℃、30℃、35℃对南沙参化学成分的分离效果,结果表明,柱温在30℃条件下,主成分的峰能达到有效分离;考察了0.8 mL/min、1.0 mL/min、1.2 mL/min 3个流速对南沙参药材指纹图谱的影响,流速在1.0 mL/min时,指纹图谱基线平稳,各主成分峰之间的分离效果好,因此选择流速为1.0 mL/min;供试品溶液制备方法比较了回流和超声提取,结果表明回流提取的主成份峰的面积比回流提取大,且设备要求简单,方便。
应用国家药典委员会–中药指纹图谱相似度评价系统(2004A)软件对9批南沙参的共有峰进行确定,结果表明保留时间分别为32.397 min、45.747 min、50.750 min的三个色谱峰,在9批南沙参中均存在;9批南沙参的指纹图谱拟合图也对9批南沙参中的共有峰进行了标注,确定了三个色谱峰作为共有峰。不同批次南沙参药材指纹图谱相似度除S9批(0.90)外均大于0.95。从TLC检测和HPLC指纹图谱结果看出,不同产地南沙参化学成分有差异,但总体差异不大。我们建立的南沙参HPLC指纹图谱,可用于药材的质量控制,保证药品质量的均一和安全稳定。