1. 引言
乌药为传统常用中药,分布于江苏、浙江、台湾、福建、广东等省,其中天台乌药的品质最佳 [1]。天台乌药以块根入药,是重要的温胃理气止痛药之一,有抗菌、消炎,抗疲劳,保肝护胃,抗氧化等药理作用 [2] [3] [4] [5]。乌药的根、叶、果皮以及种子中都含有挥发油。据文献报道,乌药挥发油含有杀菌、消炎、祛痛、止痒、降血压、抗肿瘤等有效成分 [6] [7] ,但由于产地及提取方法不同,其化学成分也存在较大差异 [8] [9] [10] [11]。本文采用水蒸气蒸馏法提取天台乌药中的挥发油成分,分别考察了浸泡时间、提取时间和料液比对提取效果的影响,优化了挥发油的提取条件。此外,采用GC-MS方法对天台乌药挥发油的化学成分进行了分析。
2. 材料与方法
2.1. 材料与试剂
2.1.1. 实验材料
乌药块根购于浙江省台州市天台县,经浙江大学生命科学学院吴世华博士鉴定,为樟科山胡椒属植物乌药Lindera aggregata (Sims) Kosterm的干燥块根,凭证标本存于本实验室。将干燥的乌药块根粉碎成粗粉后密封,存放于阴凉干燥处备用。
2.1.2. 主要试剂
分析纯无水硫酸钠,购买自浙江常青化工有限公司;实验用水由娃哈哈纯净水经Milli-Q系统(Bedford, MA, USA)净化得到,电阻率为18.2 MΩ/cm。
2.2. 仪器与设备
电子天平(AL204型):美国METTLER公司;MilliQ超纯水系统(Direct-Q™ 5):美国密理博公司;挥发油提取器:科腾实验仪器公司;YH系列电热器:江苏近湖镇教学仪器厂;气质联用仪(Thermo Trace DSQII):美国Thermo Fisher Scientific公司。
2.3. 实验方法
2.3.1. 天台乌药挥发油的提取
1) 蒸馏法提取
准确称取天台乌药粗粉100.00 g,置于2000 mL的圆底烧瓶中,按一定的料液比加入相应体积的水。浸泡一段时间,取适量沸石振摇混合,连接挥发油测定器和回流冷凝管,从冷凝管的上端加水并充满挥发油测定器的刻度部分,当水溢流入烧瓶时停止。置电热器中缓缓加热至沸,并保持微沸适当时间,停止加热。放置一段时间后开启测定器下端的活塞,将水慢慢放出至油层上端到达刻度0线上方5 mm处为止。之后放置1小时以上,再开启活塞使油层下降到它的上端正好与刻度0线平齐,读取挥发油的量,并计算收油率(%)。将挥发油取出,密封,4℃储存待用。
2.3.2. 乌药挥发油提取方法的优化
1) 浸泡时间的优化
准确称取天台乌药粗粉100.00 g,加入1200 mL水,分别浸泡1,3,6,9,12 h,取适量沸石振摇混合后,置电热器中缓缓加热至沸,并保持微沸3 h,停止加热,按1.3.1.1中方法读取挥发油的得量,并计算挥发油提取率(%)。
2) 提取时间的优化
准确称取天台乌药粗粉100.00 g,加入1200 mL水,浸泡3 h,取适量沸石,振摇混合后,置电热器中缓缓加热至沸并分别保持微沸1,2,3,4,5 h,停止加热,按1.3.1.1中方法读取挥发油的得量,并计算挥发油提取率(%)。
3) 液料比的优化
准确称取天台乌药粗粉100.00 g,分别按一定液料比6:1、8:1、10:1、12:1、14:1加入水,浸泡3 h,取适量沸石振摇混合后,置电热器中缓缓加热至沸,并保持微沸3 h,停止加热,按2.3.1 1)中方法读取挥发油的得量,并计算挥发油提取率(%)。
2.3.3. 乌药挥发油成分的分析方法
采用优化条件提取乌药挥发油,加入适量的无水硫酸钠进行脱水,然后进行气质联用分析。
GC条件:色谱柱,TR-35MS (30 m × 0.25 mm, 0.25 μm);进样口温度250℃;升温程序:初始温度60℃保持1 min,然后以18℃/min升至120℃,保持1 min,再以3℃/min升至180℃,保持3 min,最后以3℃/min升至250℃,保持2 min;载气He流速0.8 mL/min;分流比1:30。
MS条件:EI源;电子能量70 eV;离子源温度200℃;传输线温度250℃;检测器温度280℃;质量扫描范围m/z30~500 amu。
使用Xcalibur 2.0软件对实验数据进行分析处理,将分离出的各物质通过NIST2.0标准谱库进行检索并且结合有关文献 [12] [13] 进行对比,从而分析鉴定了天台乌药中挥发油的化学成分,组分相对百分含量的确定采用面积归一化法。
2.4. 挥发油提取率计算
挥发油提取率/% = 挥发油提取的量(mL)/乌药粗粉的质量(g) × 100%
每组实验重复3次,所得的数据取平均值,利用Excel 2013和和OriginPro 8.1处理数据。
2.5. 工艺优化试验说明
经查阅相关挥发油的提取文献,钱俊青 [14] 等优化超声提取乌药有效成分的工艺条件,确定了超声前浸泡时间45 min、超声功率600 w、超声时间13.2 min、液固比10:1、超声后浸泡时间1.5 h、提取次数3次时乌药的有效成分提取最优。田金凤 [15] 等用水蒸气蒸馏法提取挥发油,并用正交试验法对挥发油提取进行3因素3水平考察,确定最佳提取条件为陈皮、白术粉碎成过50目筛的粉末,加10倍水量,提取5 h。高慧 [16] 采用水蒸气蒸馏法提取陈皮挥发油,以挥发油提取率为指标,应用L9(34)正交试验选取最佳提取工艺条件,确定最佳提取工艺条件为蒸馏水浸泡20分钟,提取3小时。雍菁 [17] 等以水蒸气蒸馏法提取陈皮挥发油,应用正交试验设计选取最佳提取工艺条件。结果表明最佳提取条件为6倍加水量、浸泡1 h、蒸馏时间6 h。
3. 结果与分析
3.1. 天台乌药挥发油提取条件的优化
3.1.1. 浸泡时间对挥发油提取率的影响
在液料比为12:1,提取时间为3 h的条件下,不同的浸泡时间对乌药挥发油的提取影响如图1所示。从图中可知,浸泡时间对乌药挥发油提取率的影响趋势不明显。当浸泡时间低于6 h,浸泡3 h时的收油率最大;当浸泡时间超过6小时,收油率缓慢增大,但和浸泡3 h的收油率接近,可能是浸泡过程中有效成分挥发,导致收油率增加不明显。从实际应用角度出发,选择浸泡时间短且能达到较高收油率的时间作为提取挥发油的最佳浸泡时间,因此本实验选取浸泡时间为3 h。

Figure 1. The effect of soaking time on the extraction efficiency of the volatile oil from Lindera aggregata (Sims) Kosterm
图1. 浸泡时间对乌药挥发油提取率的影响
3.1.2. 提取时间对挥发油提取率的影响
在浸泡时间为3 h,液料比为12:1的条件下,不同的提取时间对乌药挥发油的提取影响如图2所示。从图中可知,随着提取时间的增加,收油率逐渐增大,当提取时间超过3 h,收油率增加不明显。因此本实验选取3 h作为最佳提取时间。
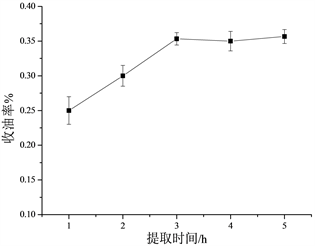
Figure 2. The effect of extracting time on the extraction efficiency of the volatile oil from Lindera aggregata (Sims) Kosterm
图2. 提取时间对乌药挥发油提取率的影响
3.1.3. 液料比对挥发油提取率的影响
在浸泡时间为3 h,提取时间3 h的条件下,不同的液料比对乌药挥发油的提取影响如图3所示。从图中可知,随着液料比的增加,挥发油提取率逐渐增大,当液料比为超过12:1时,挥发油提取率缓慢减小。在实验过程中,当液料比较小时,有效成分不能充分提取,影响实验结果;当液料比较大时,有效成分虽能充分提取,但提取过程中容易出现暴沸现象,有时液料会冲出圆底烧瓶,导致实验中断。因此本实验选取液料比为12:1。

Figure 3. The effect of liquid-solid ratio on the extraction efficiency of the volatile oil from Lindera aggregata (Sims) Kosterm
图3. 液料比对乌药挥发油提取率的影响
3.2. 乌药挥发油的提取结果
通过单因素实验确定乌药挥发油的最佳提取条件为:浸泡时间3 h,提取时间3 h,液料比12:1。在最佳提取条件下采用水蒸气蒸馏法提取乌药挥发油三次,提取率依次为0.36%,0.35%。0.36%,平均提取率为0.357%。董岩 [18] 等采用微波–水蒸气回流法提取挥发油,将乌药粉碎后用适量去离子水浸泡12 h,微波加热10 min后,水蒸气回流法提取3 h,收油率为0.41%。但是此提取方法浸泡时间较长,可能会导致挥发油成分发生改变;周继斌 [19] 等对乌药根进行成分测定时,块根粗粉150 g,得油0.53 mL,提取率为0.35%;晏润纬 [6] 等将7.5 kg新鲜的乌药块根剪成小段,利用挥发油提取器水蒸汽蒸馏3 h后得到乌药根挥发油约22 mL,提取率为0.293%;晏润纬 [20] 等按常规的水蒸气蒸馏法提取乌药根的挥发油,收油率为0.31%。对比以上文献,本实验的提取率约为0.36%,提取效果较好。
3.3. 乌药挥发油有效成分的气质联用分析与鉴定
准确称取天台乌药粗粉100 g,加入1200 mL水,浸泡3 h,取适量沸石振摇混合后,置电热器中缓缓加热至沸,并保持微沸3 h,停止加热,按2.3.1.1的方法提取挥发油,并加入适量的无水硫酸钠进行脱水,通过2.3.3的气质联用方法对其进行分析,天台乌药挥发油有效成分的总离子流图如图4所示,可知挥发油中的化学成分有良好的分离效果。
按2.3.3的GC-MS条件对挥发油成分进行分析,结果如表1所示,共鉴定了天台乌药挥发油中的39个化学成分。在天台乌药块根的挥发油中,烃类占20.35%,醛类占28.53%,酯类占0.98%,酮类占14.87%,酸酚类占0.87%,醇类占0.22%,其它种类占7.06%。其中含量最高的为视黄醛,占挥发油总量的22.56%,其次为2-蒈烯,占挥发油总量的17.14%,再次为异长叶烯酮,占挥发油总量的13.45%,上述三种化合物占挥发油总量的53.15%。其它主要成分还有L-樟脑醌、萜品烯、1-萜品-4-基乙酸酯、桉叶油醇、4-萜烯醇、萜品油烯、黄樟脑等。从乌药挥发油化学成分的分类看,它们大多为萜类化合物。萜类化合物具有重要的生理活性,是研究天然产物和开发新药的重要来源。因此,研究乌药挥发油具有极高的价值。

Figure 4. Tatalion chromatogram of the volatile oil from Lindera aggregata (Sims) Kosterm
图4. 乌药挥发油成分的总离子流图


Table 1. Constituent of the volatile oil from Lindera aggregata (Sims) Kosterm
表1. 乌药挥发油的化学成分分析结果
查阅乌药挥发油成分分析相关文献发现,何桂霞 [21] 等采用超临界CO2萃取法和水蒸气蒸馏法对乌药根挥发油进行了提取。以超临界CO2萃取方法提取时,鉴定出了46个成分,主要有1,1-二乙氧基乙烷、(2-[2-(2,4-二甲基苯基)环丙基]呋喃)、20-十四氢环十并[a]环十四烯等;当采用水蒸气蒸馏法提取挥发油时,通过GC-MS分析鉴定了36个化合物,主要有龙脑乙酸酯、长叶烯、桉叶4(14),11-二烯、龙脑、β-愈创木烯等。董岩 [18] 等对广西产乌药的挥发油进行气相色谱-质谱分析,共分离出51种组分,鉴定出了41个化学成分,大多数化合物属于单帖类和倍半萜类物质,主要有愈创树-l(5),7(11)-二烯、冰片醋酸酯、δ-3-蒈烯、琼脂螺醇、苎烯、莰佛精、2,4-二异丙基-1-甲基-1-乙烯基环己烷等。邓桂明 [22] 等通过水蒸气回流法提取湖南产乌药的挥发油,通过GC-MS共鉴定出了68个化学成分,大多数为单萜类物质,主要有(-)-马兜铃烯、β-桉叶油醇、4a-甲基-4,4a,9,10-四氢(-2(3H))菲酮以及1-甲基-1-乙基-2,4-二(1-甲基乙烯基)环己烷等。结合本文实验结果及上述文献研究内容可知,乌药挥发油化学成分十分复杂。由于产地、采集时间以及提取方法的不同,乌药挥发油的化学成分也存在较大的差异。
4. 结论
本文采用水蒸气蒸馏法提取天台乌药中的挥发油,分别考察了浸泡时间、提取时间和料液比对提取效果的影响,优化了挥发油的提取条件,确定了最佳的提取工艺为浸泡时间3 h,提取时间3 h,液料比12:1,在此条件下,天台乌药挥发油的收率约为0.36%。此方法在一定程度上缩短了提取时间,避免原料的浪费,适合用于天台乌药挥发油化学成分的提取。同时,采用GC-MS法分析天台乌药挥发油的化学成分。经过标准谱库检索并与相关文献进行比对,鉴定出了39个化学成分,其中大多数为萜类化合物。研究结果表明,GC-MS法可以简便、快速地对乌药挥发油中化学成分进行定性研究。挥发油是乌药中的特征成分之一,具有多种药理作用,对挥发油化学成分的研究将为乌药的进一步开发和应用奠定基础,具有重要的药用开发价值和经济价值。
基金项目
浙江省公益性科技计划项目(LGN18C200016)。