1. 引言
湿地生态系统是处于陆地和水体之间的自然综合体,其生物多样性十分丰富,生产力强 [1]。同时具有很强的调节环境的能力,湿地不仅具有储蓄地下水、泥炭积累等水文功能,同时具有保护生物多样性、维持物种库,为野生动植物尤其是一些稀少或濒危物种提供栖息地等生态功能 [2]。国际上对湿地的保护及研究经历了从无到有的过程,但我国湿地保护工作起步相对滞后 [3]。国内由于过度的开垦农田、工农业污染、城市建设等多方面的影响,给湿地生态带来了严重的破坏,有必要加强湿地的保护与监测工作 [4]。
大型底栖无脊椎动物是指生活史的全部或至少一段时间聚居于水体底部的大于0.5 mm的水生无脊椎动物 [5]。大型底栖无脊椎动物被广泛应用于监测水生态系统的损伤,同时也是水生食物网的重要组成部分,是生态系统营养循环和生态平衡的基础 [6]。大型底栖无脊椎动物具备物种丰富、分布广泛的特性,生活周期长且迁移距离短,易于采集且对生境的变化反应敏感,将其作为湿地生态系统监测的主要生物类群 [7]。
泰湖国家湿地公园位于黑龙江省泰来县城区 [8],主要水源来自于周边降水。近年来由于水量减少,湿地呈现明显的缺水状态,为了补充湿地水资源,泰来县政府设计从嫩江引水入泰湖。为了验证泰湖引水修复的效果,同时要求了解补水对泰湖湿地生态系统中生物栖息和繁殖的影响,以便科学有效地治理,既可以达到湿地水资源充沛,又对湿地生物栖息繁殖更有利。通过本次调查,对泰湖国家湿地公园大型底栖无脊椎动物进行采集、鉴定和生物特征分析,获得大型底栖无脊椎动物群落特征,根据其在水环境中的指示作用,对泰湖国家湿地公园水环境进行监测,并且为湿地生态系统的恢复提供科学依据。
2. 材料与方法
2.1. 研究地概况
泰湖国家湿地公园位于黑龙江省泰来县城区,地理坐标为E123˚25'14.17''~123˚29'00.97'',N46˚24'12.10''~46˚21'15.10'',属中温带大陆性季风气候,总面积1365 hm2,是省内为数不多毗邻城区、生态环保的国家湿地公园之一 [8]。如图1,泰湖国家湿地公园东西宽4180米,南北长5310米,总面积1365公顷,其中水域面积7平方公里。公园以沼泽、草甸、湖泡、林地等景观组成,并融合人文景观。湿地公园野生动植物资源丰富,有种子植物65科250属494种,有鱼类7科31种,鸟类34科162种,其中国家一、二级保护鸟类21种(如丹顶鹤、东方白鹳、白琵鹭、大天鹅) [9]。独特的生态环境,使湿地在调解气候、降解污染、保护生物多样性、保护生态平衡等方面发挥着重要作用。
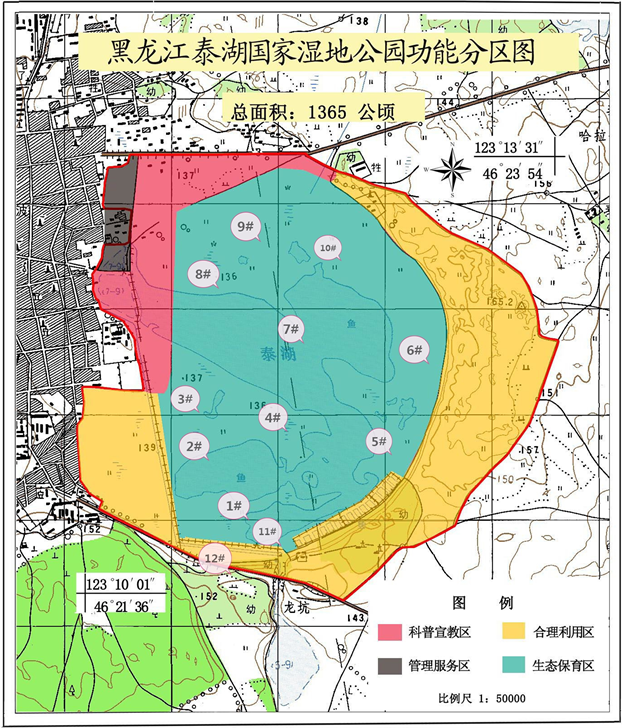
Figure 1. Map of sampling sites in Tai Lake National Wetland Park
图1. 泰湖国家湿地公园采样点分布图
2.2. 底栖动物采集
泰湖国家湿地公园的水体水深达2.5米,并且均为富含腐殖质的淤泥底质,因此本研究大型底栖无脊椎动物样本的采集工具主要是改良彼得生采泥器,采样面积为1/16 m2 [10]。使用时将彼得生采泥器打开,挂好提钩,然后缓缓放入水中,接触底质时将提钩抖脱,慢慢提起,提出水面后打开采泥器,重复采样三次,将采集到的底泥倒入40目分样筛除去污泥浊水及小型和微型动物,剩余部分倒入白瓷盘中,用镊子仔细挑选出所有的大型底栖无脊椎动物后保存。
样品在现场挑拣出来后即用85%的酒精固定,带回实验室后换用80%的酒精固定,常温保存,在鉴定完成前,经常检查并添加酒精保存液,确保样本浸没样品,对完整和有长期保存价值意义的样品进行标本制作,长期保存。
依据物种检索表,在肉眼、解剖镜或显微镜下,主要对照大型底栖无脊椎动物的外部形态进行鉴定,种类分类鉴定参照的文献主要有:《中国北方摇蚊幼虫》 [11]。大多数样本鉴定至种,鉴定不到种的鉴定至科、属。
2.3. 数据处理与分析
采用物种优势度指数Y = Pi × fi确定优势种,当Y > 0.02时,该物种即为群落中的优势种。式中:Pi为种i的个体数占所有种总个体数的比例;fi为出现种i的样点个数占总样点个数的比例 [10]。
采用Simpson多样性指数分析大型底栖无脊椎动物的多样性,具体计算公式为D = 1/∑Pi2。式中:Pi为种i的个数占所有种总个体数的比例 [12]。
3. 结果与分析
3.1. 泰湖国家湿地公园大型底栖无脊椎动物物种特征分析
本次调查分别于2018年夏季(7月)和秋季(9月)进行样本采集,结果共发现泰湖国家湿地公园大型底栖无脊椎动物7种(属) (表1),并且全部隶属于节肢动物门,均为双翅目摇蚊科的水生昆虫幼虫。其中夏季采集到的样本共5种(属),总计有61只;秋季采集到的样本共4种(属),总计有73只。
表2和表3分别为泰湖国家湿地公园夏季和秋季的各样点数据,通过两次采集到的样本数据对比,3号样点的摇蚊幼虫在数量和种类上已经占据所有样点中的优势,而1号样点则没有发现大型底栖无脊椎动物;4号样点至9号样点的摇蚊幼虫,秋季相对于夏季,在种类和数量上都略微有所提升,根据大型底栖无脊椎动物和泰湖国家湿地公园的地理因素特性,夏季的水温略高,可以促进加速摇蚊幼虫的繁殖和羽化,为此导致摇蚊幼虫的数量减少。
物种特征结果表明,泰湖国家湿地公园生态系统中,大型底栖无脊椎动物物种稀缺,数目也少,群落结构过于单调,摇蚊幼虫是湿地中的鲤鱼最适口的饵料,为此削弱了大型底栖无脊椎动物群落在生态系统中物质循环的功能、以及其发挥的水环境自净作用。

Table 1. List of macroinvertebrate in Tai Lake National Wetland Park
表1. 泰湖国家湿地公园大型底栖无脊椎动物名录

Table 2. Abundance (ind./m2) of macroinvertebrate of Tai Lake National Wetland Park in Summer
表2. 泰湖国家湿地公园夏季大型底栖无脊椎动物(个/平方米)

Table 3. Abundance (ind./m2) of macroinvertebrate of Tai Lake National Wetland Park in Autumn
表3. 泰湖国家湿地公园秋季大型底栖无脊椎动物(个个/平方米)
3.2. 泰湖国家湿地公园大型底栖无脊椎动物丰度特征分析
夏季大型底栖无脊椎动物的丰度处于0~320 ind./m2之间,丰度最大者为3号采样点,为320 ind./m2,其次为2号采样点,为192 ind./m2,最小者则为1号采样点未发现大型底栖无脊椎动物;秋季大型底栖无脊椎动物的丰度也处于0~320 ind./m2之间,丰度最大者仍为3号采样点,为320 ind./m2,其次为9号采样点,为304 ind./m2,最小者仍为1号采样点,为0 ind./m2,并不存在大型底栖无脊椎动物(表4,图2)。
两次样本采集结果显示,夏季和秋季均为3号样点的大型底栖无脊椎动物种类数最多,丰度也最大,而1、10、11、12号样点则均未发现大型底栖无脊椎动物,双翅目摇蚊科幼虫是大型底栖无脊椎动物中种类众多的类群,耐污性也较强,在本次泰湖国家湿地公园大型底栖无脊椎动物调查中也是唯一被发现的类群,但是仍然在1、10、11、12号样点没有出现,耐污染的种类都已经消失,说明1、10、11、12号样点水质污染已经极其严重。

Table 4. Abundance (ind./m2) of macroinvertebrate in Tai Lake National Wetland Park
表4. 泰湖国家湿地公园大型底栖无脊椎动物丰度(ind./m2)
3.3. 泰湖国家湿地公园大型底栖无脊椎动物优势种特征分析
表5中列出泰湖国家湿地公园大型底栖无脊椎动物群落中的优势种及其优势度指数,夏季秋季的优势种均为苍白摇蚊,优势度指数最大,其次夏季中依次为弯拟摇蚊属和云集多足摇蚊,秋季中依次为前突摇蚊属和溪流摇蚊。摇蚊幼虫属的特性在很大程度上决定了其某一种类的特性,其中苍白摇蚊和溪流摇蚊均属于摇蚊属,云集多足摇蚊则属于多足摇蚊属。
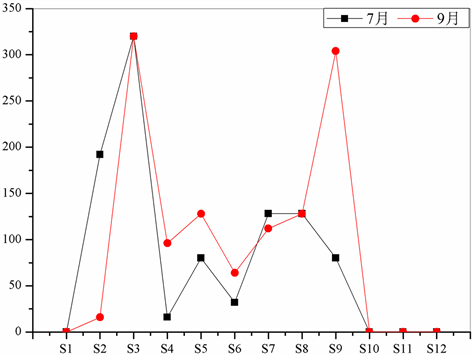
Figure 2. Abundance (ind./m2) of macroinvertebrate in Tai Lake National Wetland Park
图2. 泰湖国家湿地公园大型底栖无脊椎动物丰度分析(ind./m2)

Table 5. Dominant species of macroinvertebrate in Tai Lake National Wetland Park
表5. 泰湖国家湿地公园大型底栖无脊椎动物优势种
1) 摇蚊属(苍白摇蚊、溪流摇蚊):本属种类分布极为广泛,除南极洲外均有分布,本属幼虫喜爱软淤泥底质,分布于各种静水水体底部,流水中罕见,数种幼虫可生活于低溶解氧的腐殖质丰富的黑色淤泥中,常有众多的数量,部分种类幼虫喜欢生长在盐分较高的环境中。本属种类耐有机物污染,并且耐受酸性环境。
2) 多足摇蚊属(云集多足摇蚊):本属是世界性分布的属,是摇蚊科最大的属级分类单元之一,目前已记录种类共计428种。幼虫生活于各种类型的水体中,取食各种腐殖质或底泥,多营自由生活。一些种类的幼虫对水质的变化,如营养盐、重金属、pH和溶解氧等极为敏感,有些种类则适应有机污染、重金属类毒物污染。
3) 弯拟摇蚊属:本属幼虫分布于各种类型水体的软、硬沉积物中。
4) 前突摇蚊属:本属幼虫喜欢生活于静水或缓流的水体底部淤泥中,是世界性分布的属,其中种类耐重金属污染。
3.4. 泰湖国家湿地公园大型底栖无脊椎动物Simpson多样性指数特征分析
夏季和秋季各采样点的大型底栖无脊椎动物Simpson多样性指数数值如图3所示。夏季的平均值为1.73,各样点之间的多样性指数变化并不大,除去1号样点并不存在大型底栖无脊椎动物以外,指数最大的为3号样点,数值为4.26,指数最小的则有4个样点,分别为4号、5号、6号和9号样点,数值均为1,仅发现1种摇蚊幼虫。秋季的平均值为1.79,各样点之间的多样性指数变化也不大,1号样点同样并不存在大型底栖无脊椎动物,此外指数最大的同为3号样点,数值为3.92,指数最小的则有3个样点,分别为2号、7号和8号样点,数值均为1,仅发现1种摇蚊幼虫。
从Simpson多样性指数来看,夏秋两季各个样点之间的指数数值差别不大,尤其均值较小,说明泰湖国家湿地公园的大型底栖无脊椎动物物物种不丰富,可见泰湖国家湿地公园大型底栖无脊椎动物的生存已经岌岌可危,基于大型底栖无脊椎动物在水生态系统中的作用,必然对水生态系统的鱼类和鸟类等生物群落造成威胁。

Figure 3. Simpson diversity index of macroinvertebrate in Tai Lake National Wetland Park
图3. 泰湖国家湿地公园大型底栖无脊椎动物Simpson多样性指数
4. 讨论
4.1. 泰湖国家湿地公园大型底栖无脊椎动物群落特征分析
本次调查仅发现大型底栖无脊椎动物7种,并且均为水生昆虫中双翅目摇蚊科幼虫,归属于5个属。水生昆虫是大型底栖无脊椎动物中数目最多、种类最多、群落结构最复杂的类群 [13],其中摇蚊幼虫也最为常见,摇蚊幼虫的耐污性较强,本次调查中发现的摇蚊幼虫均为世界性分布的属,分布极其广泛,适应大多数类型的水体环境,对地理因素表现出的差异并不明显 [14]。
结合泰湖国家湿地公园中夏、秋两次采集的大型底栖无脊椎动物鉴定结果,和泰湖国家湿地公园的各种非生物因子状态:大型底栖无脊椎动物的生存已经岌岌可危,只存在少量的摇蚊幼虫,并且水体理化因子呈现出严重富营养化的状态,水体中的水生维管束植物并不存在,仅水体周围着生芦苇和香蒲,非常单调的植物群落结构,水体的底质也是腐殖质丰富的淤泥底质,综合以上因素分析泰湖国家湿地公园的水体已经达到重度污染,各项非生物因子均不支持大型底栖无脊椎动物的生存和繁殖,而大型底栖无脊椎动物的状况也响应了这一调查结果。
4.2. 泰湖国家湿地公园大型底栖无脊椎动物对水环境的指示作用
在长期的观察中发现,自然界中存在部分动植物对环境中的一些物质反应很敏感。它们对这些物质的多少和变化能产生各种反应或信息。因此,环境学家就用它们来定性地监测和评价环境质量的好坏和趋势,并且把有这种特性的动植物叫做指示生物。在一定地区范围内,能通过指示生物的特性、数量、种类或群落等变化,指示环境或某一环境因子的特征。
摇蚊幼虫为完全变态类昆虫,由于其主要以水底有机物碎屑为食,且摄食量相当可观,因而在加速水体物质循环中的有机物矿化作用和消除有机物污染方面具有显著作用 [15]。摇蚊科昆虫又因种类丰富,个体众多,分布广泛,不同种类对水域生境要求不同,从而成为监测水体环境和污染状况的优良指示生物,在生态学和环境科学领域中得到广泛的应用。在加强水生态毒理学应用研究中,摇蚊幼虫被广泛应用于毒性测试。依据摇蚊幼虫对水体中重金属的敏感性,已经开展了重金属对摇蚊幼虫的急性和慢性毒性实验。按照水污染的轻重程度划分,水体严重污染的指示生物就包括摇蚊幼虫,以及颤蚓类、毛蠓、绿色裸藻等,均有在低溶解氧条件下生活的能力。
本次调查发现的摇蚊幼虫中,摇蚊属幼虫(苍白摇蚊、溪流摇蚊)尤其喜欢生长在盐分较高的环境中,对有机物污染耐受性极强,并且耐受酸性环境;多足摇蚊属幼虫(云集多足摇蚊)对水质的变化,如营养盐、重金属、pH和溶解氧等的变化反应极为敏感,并且更加适应有机污染、重金属类毒物污染的水体;前突摇蚊属幼虫同样耐受重金属污染,综合调查中发现的摇蚊幼虫的特性,它们的存在已经指示了泰湖国家湿地公园的水质污染特性,其重金属和有机物污染程度较大,并且营养盐的含量也很多,水体富营养化状况严重,而对泰湖国家湿地公园水体理化指标的检测结果也响应了这一结论。
4.3. 泰湖国家湿地公园大型底栖无脊椎动物与底质和植被的关系
生境的复杂性是决定大型底栖无脊椎动物多样性的关键因子,相关学者对于环境因子与大型底栖无脊椎动物多样性关系的研究认为大型底栖无脊椎动物的群落结构、空间分布与水质、底质、植被、温度和盐度等环境因子有关 [16] [17] [18]。大型底栖无脊椎动物群落结构通常由栖息地的物理结构及其复杂性决定,尤其依赖于水体基质中的粗颗粒有机物,并且大型底栖无脊椎动物长期生活于水体底部,底质成分组成对大型底栖无脊椎动物的种类组成、丰度及多样性有着直接的影响 [19]。水生维管束植物是湿地生态系统中最明显的生物特征,大型底栖无脊椎动物的分布同样由植被类型决定,尤其是占主导地位的水生维管束植物的结构和生长形式,水生维管束植物通过吸收和释放化学物质(如营养物质、对抗性物质)影响水下气候和化学性质,也影响了大型底栖无脊椎动物的分布 [20]。
在本次泰湖国家湿地公园的大型底栖无脊椎动物调查中,样点均布设在湖中,湖水底质为腐殖质含量非常多的淤泥底质,淤泥底质非常适合摇蚊幼虫的生存,腐殖质含量多也为摇蚊幼虫提供生命活动的资源 [21]。但是,淤泥底质并不适合其他类群的大型底栖无脊椎动物,与软体动物、甲壳动物等耐污性较弱的类群所需的环境相差甚远。湖中也未发现水生维管束植物,浮水植物、沉水植物均不存在,仅有挺水植物如芦苇、香蒲等常见物种生长于湖周围,水生维管束植物群落结构单调,种类极少,既不利于对湖水水体的净化,也无法为大型底栖无脊椎动物提供充足的食物或是合适的栖息环境。
5. 结论
本次对泰湖国家湿地公园大型底栖无脊椎动物的调查中,夏季共发现5种摇蚊幼虫,秋季共发现4种摇蚊幼虫。优势种属于摇蚊属(Chironomus)、拟摇蚊属(Parachironomus)、多足摇蚊属(Polypedilum)和前突摇蚊属(Procladius)。这些类别的摇蚊幼虫尤其喜爱中至重污染水体。这说明泰湖国家湿地公园水体已经污染严重,通过夏季和秋季两次采样结果对比,水质并未得到明显的改善。
基金项目
“十三五”国家重点研发计划项目(2016YFC0500406)。中央高校基金项目,编号2572019DF09。