1. 引言
微生物和植物中所含的蒽酮类化合物其结构具有特殊性和多样性,通过不同的作用机制,可以达到调节机体免疫、防氧化、杀菌以及抗肿瘤等多种功能 [1]。蒽环抗生素对治疗肿瘤有着很好的效果,如柔红霉素、多柔比星、伊达比星等 [2],然而,天然产物中所含的蒽环类化合物不足以满足市场的需求 [3]。天然蒽醌及其衍生物种类众多,广泛存在于自然界中,绝大多数的天然蒽醌类化合物来自高等植物 [4] [5]。通过对蒽醌及其衍生物的还原可以制备不同种类的蒽酮衍生物,从而满足市场对于蒽酮衍生物的需求。大黄素蒽酮可用于合成具有镇静消炎、抗老年痴呆、抗抑郁、抗病毒、抗肿瘤等多种药理活性的金丝桃素 [6]。地蒽酚具有抗上皮细胞增殖、诱导上皮细胞分化及抗炎症等药物生理作用,对治疗银屑病具有较好的疗效 [7] [8]。传统由蒽醌制备蒽酮的方法都是通过锡粉或氯化亚锡还原 [9] [10] [11]。传统的合成方法还原剂用量过多,产生大量固废,且成本较高,本文提供了一种由铁粉做还原剂,制备蒽酮及其衍生物的新方法,能够更好地满足工业生产的需要,合成路线见图1。
2. 实验部分
2.1. 实验材料与仪器
AR级高纯铁粉、醋酸、盐酸、磷酸(国药集团化学试剂);蒽醌、大黄素、1,8-二羟基蒽醌(阿拉丁试剂);色谱纯乙醇(美国恩科化学)。
WRS-1B型数字熔点仪(上海仪电物理光学仪器);BRUCK 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标) (德国布鲁克);高效液相色谱仪Agilent-1100 (安捷伦);Waters Acquity UPLC Class I/Xevo G2Q-Tof型液质联用仪(安捷伦)。
2.2. 实验方法
1) 高效液相色谱(HPLC)分析方法
色谱柱:Agilent XDB-C18 (4.6 × 150 mm),检测波长254 nm,流速1.0 ml/min,进样量5 μL。
流动相:配制乙醇:水 (V:V) = 85:15的混合溶液,用磷酸将流动相pH调节至3.0,等梯度洗脱20 min。
2) 蒽酮(2a)的合成
向三口烧瓶中依次加入蒽醌(1a) 10 g,6.72 g铁粉,70 g醋酸,搅拌,氮气保护条件下,加热,使反应液内温达到105℃时,缓慢滴加盐酸32 g,滴加时长1~2 h,反应30 min (LCMS检测,1a无剩余)。反应液乘热压滤,滤液冷却结晶,得淡黄色针状晶体8.2 g,收率88.79%,HPLC纯度98.57%。
3) 大黄素蒽酮(2b)的合成
向三口烧瓶中依次加入大黄素(1b) 10 g,5.18 g铁粉,70 g醋酸,搅拌,氮气保护条件下,加热,使反应液内温达到105℃时,缓慢滴加盐酸25 g,滴加时长1~2 h,反应30 min (HPLC检测,1b无剩余)。反应液乘热压滤,滤液冷却析晶,得黄色粉末8.12 g,收率86.50%,HPLC纯度86.80%。
4) 地蒽酚(2c)的合成
向三口烧瓶中依次加入1,8-二羟基蒽醌(1c) 10 g,5.88 g铁粉,70 g醋酸,搅拌,氮气保护条件下,加热,使反应液内温达到105℃时,缓慢滴加盐酸27 g,滴加时长1~2 h,反应30 min (HPLC检测,1c无剩余)。反应液乘热压滤,滤液冷却析晶,得黄色粉末8.81 g,收率93.62%,HPLC纯度95.83%。
3. 结果与讨论
3.1. 铁粉用量对产品收率的影响
在固定条件下(蒽醌10 g,醋酸70 g,盐酸用量以铁粉摩尔量计2.5 eq),考察铁粉用量对还原进程的影响,其中铁粉用量以摩尔量计,具体结果列于表1中。由表1可见,当铁粉用量少于2当量(eq)时收率较低,经HPLC检测原料有剩余,当铁粉用量超过3.0 eq时,产品收率降低,铁粉用量为2.5 eq时收率较好。

Table 1. Effect of iron powder amount on product yield
表1. 铁粉用量对产品收率的影响
3.2. 盐酸的用量对产品收率的影响
在固定条件下(蒽醌10 g,醋酸70 g,铁粉用量以蒽醌摩尔量计2.5 eq,盐酸用量以铁粉摩尔量计),考察铁粉用量对还原进程的影响,具体结果列于表1中。
表2为盐酸用量对反应的影响。由表2可见,盐酸用量超过3.0 eq时产品收率降低,盐酸最佳用量为2.5 eq。产物中存在一定比例的互变异构体 [12],互变的比例在2%~10%,互变过程如图2、图3所示。

Table 2. Effect of hydrochloric acid dosage on product yield
表2. 盐酸用量对产品收率的影响
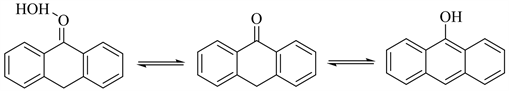
Figure 2. Diagram of structural interchangeability of 2a
图2. 2a互变过程图

Figure 3. Diagram of structural interchangeability of 2b and 2c
图3. 2b、2c互变过程图
3.3. 产物的结构鉴定
产物2a的结构确认:m.p 154.9℃~155.7℃;见图4 1HNMR (CDCl3, 400 MHz) δ8.27 (d, J = 8.0 HZ, 2H); δ7.505 (t, J = 6.0 HZ, 2H); δ7.375 (m, 4H); δ4.26 (S, 2H); MS m/z: 195.1 {[M + H]+}。
产物2b的结构确认:m.p 252.4℃~254.7℃,见图5 1HNMR (DMSO-d6, 400 MHz) δ12.31 (s, 1H); δ12.15 (s, 1H); δ10.76 (s, 1H); δ6.69 (s, 1H); δ6.60 (s, 1H); δ6.35 (s, 1H); δ6.16 (s, 1H); δ4.22 (s, 2H); δ2.25 (s, 3H); MS m/z: 257.0 {[M + H]+}。
产物2c的结构确认:m.p 178.7℃~179.6℃,见图6 1HNMR (DMSO-d6, 400 MHz) δ12.10 (s, 2H); δ7.63 (s, 2H); δ7.04 (s, 2H); δ6.91 (s, 2H); δ4.47 (s, 2H); MS m/z: 227.3 {[M + H]+}。
4. 结论
以铁粉为还原剂,合成了蒽酮及其衍生物大黄素蒽酮、地蒽酚。通过对铁粉、盐酸的用量的探究,可使蒽酮及大黄素蒽酮、地蒽酚的收率达到85%~95%。该方法有别于传统的还原方法,找到了一种高效的合成蒽酮及其衍生物的方法,新的合成方法原料廉价易得,大大降低了生产成本,且还原剂用量少,产生的固体废料少,非常有利于工业化生产的需求。