1. 引言
月见草(Oenothera erythrosepala Borb.)是柳叶菜科二年生草本植物,生于山区向阳坡地,林缘荒地、路旁等处 [1]。月见草被认为是欧美十大防治妇女更年期综合症(PMS)天然药用植物之一,也是二十世纪发现的最重要的营养药物来源之一 [2]。月见草的花具茉莉花的香气,主要成分是芳香醇及其衍生物,可制芳香浸膏或用于调和香精。月见草油中脂肪酸易被皮肤吸收,促进血液循环,防止表皮细胞角化,延缓衰老,可为皮肤提供韧性和保水功能,是化妆品中滋润剂和保湿剂 [3]。月见草油还可调节血液中类脂物质,对高胆固醇、高血脂引起的冠状动脉梗塞、粥样硬化及脑血栓等症有显著疗效。月见草的根是药食两用药材,工业可酿酒或做食材使用,而入药具有清热解毒、祛除湿、强筋骨的功效,还可治疗咳嗽、感冒、胃刺激和肠痉挛等病症。
近年来,主要围绕月见草挥发油成分及活性机制和临床疗效等方面进行研究 [4],而对于月见草的根,尽管开发的产品类型多,但基础研究鲜有报道。月见草的根主要成分是多糖类化合物,但对多糖的提取工艺、多糖组分、质量标准等缺乏系统的研究。在对月见草多年种植的基础上,作者围绕月见草多糖的积累规律,提取工艺和活性等方面进行研究,这对于进一步深入开发月见草资源,具有重要的指导意义。
本文运用了传统工艺法、超声提取法、微波提取法分别对月见草根中的多糖进行单因素研究,研究每种方法的最佳提取工艺;进一步应用响应面法设计试验,使最佳提取条件更加明确;并研究了月见草根中多糖的动态积累规律和探究月见草多糖的抗氧化活性,为月见草更深入的研究提供了一定的基础。
2. 材料
2.1. 仪器与试剂
电子天平(上海菁海仪器有限公司)、DZTW型调温电热套(北京市永光明医疗仪器厂)、KQ-250DE型数控超声波清洗器、微波炉(青岛海尔成套家电服务有限公司)、旋转蒸发器 RE52CS (上海亚荣生化仪器厂)、循环水式多用真空泵SHB-IIIA (上海沪析实业有限公司)、754PC紫外–可见分光光度计(上海菁海仪器有限公司)、DHP-9162电热恒温培养箱(上海一恒)、Spectra Max M5酶标仪(美国Molecular Devices公司)、96孔培养板(南通新星实验器材公司)、一次性无菌培养皿(直径90 mm,南通新星实验器材公司)、苏净安泰BSC-1300IIA生物洁净安全柜(苏州苏净集团)。
丙酮、无水乙醇、石油醚、苯酚(AR)、浓硫酸(AR)、葡萄糖、过氧化氢、DMSO,均为分析纯;胎牛血清、DMEM+F12培养基(BR)、过氧化氢、RAW264.7细胞、DMSO、MTT (BR),均来自山东德仁医药有限公司。
2.2. 实验材料与处理
月见草(Oenothera erythrosepala Borb.)来源于山东中医药大学百草园和山东鲁山神农药谷,由山东中医药大学药学院副教授高德民老师鉴定,凭证标本保存于山东中医药大学标本馆(表1)。

Table 1. Oenothera erythrosepala materials
表1. 供试样品月见草材料
将新鲜的月见草根切片于烘干箱中烘干后打成粉末状并过50目筛,得粗细均匀的月见草粉末,放置待用。
3. 方法
3.1. 多糖提取方法(单因素分析法)
3.1.1. 传统工艺法
精密称取多份月见草20 g粉末于烧杯中加入石油醚浸泡过夜,抽滤,将干燥的月见草粉末置于烧杯中分别以料液比(1:20)加入蒸馏水,分别回流4 h过滤,浓缩,Sevage法除蛋白,85%乙醇多次醇沉于4℃下静置过夜,过滤,干燥得粉末 [5] [6]。按2.2测定样品吸光度,计算多糖含量。
3.1.2. 微波提取法
精密称取多份月见草5 g粉末于烧杯中加入石油醚浸泡过夜,抽滤,将干燥的月见草根别在时间(5 h,15 h,20 h,25 h,30 h)、料液比(1:10,1:15,1:20,1:25,1:30)、功率(120 w,280 w,460 w)条件下进行如表2所示的单因素实验,过滤,浓缩,干燥 [7] [8] [9]。

Table 2. Microwave extraction of polysaccharides from Oenothera erythrosepala
表2. 月见草多糖微波提取法
3.1.3. 超声提取法
精密称取多份月见草粉末5 g于烧杯中加入石油醚浸泡过夜,抽滤,将干燥的月见草分别在功率(40 w,50 w,60 w,70 w,80 w)、温度(20℃,30℃,40℃,50℃,60℃)、料液比(1:10,1:15,1:20,1:25)条件下进行如表3所示的单因素实验过滤,浓缩,离心,干燥 [10] [11] [12]。

Table 3. Ultrasonic extraction of polysaccharides from Oenothera erythrosepala
表3. 月见草多糖的超声提取法
3.2. 多糖含量和提取率测定
3.2.1. 标准曲线的绘制
精密称取葡萄糖0.01 g将其定容于100 mL容量瓶中,制得0.10 mg/mL的葡萄糖对照品溶液。吸取葡萄糖标准溶液0、1.0、2.0、3.0、4.0、5.0 mL定容于10 mL容量瓶,分别取2 mL于具塞的试管中,精密加入5%苯酚溶液1 mL并迅速加入浓硫酸5 mL,摇匀,放置10 min,于40℃水浴锅中保温15 min,用分光光度计在波长480 nm处测定吸光度 [13],得标准曲线方程:Y = 9.06X − 0.0162,R² = 0.9997。
3.2.2. 测定方法
取多糖粉末0.01 g定容于100 mL容量瓶中,取2 mL进行苯酚硫酸法。
3.3. 月见草多糖的动态分析
对采集的不同土质、不同时期下的月见草根(表1),采用3.1中最佳提取方法提取月见草根中多糖并测定多糖含量,每次测定均做三组平行实验。
3.4. 月见草根中多糖体外抗氧化活性
3.4.1. 月见草根中多糖对过氧化氢损伤的RAW264.7细胞模型建立
取对数生长RAW264.7细胞,用含10%胎牛血清的DMEM+F12培养基重悬成细胞悬液。取对数生长期的RAW264.7细胞以3 × 105个/孔密度将细胞接种于96孔板,用含10%胎牛血清的培养基于37℃,5%二氧化碳培养24 h后,弃去原有细胞培养液,空白组加入不含血清的培养基100 µL,模型组和样品组加入用不含血清培养基稀释的1000 μM过氧化氢100 µL。继续培养10 h,弃去原有细胞培养液,样品组加入不含血清培养基稀释的不同浓度月见草多糖(62.5 μg/mL,125 μg/mL,250 μg/mL,500 μg/mL,1000 μg/mL,2000 μg/mL),每孔最终体积100 µL,每个浓度设3个复孔;空白组和模型组只加入不含血清培养基100 µL,继续培养10 h,MTT法检测细胞活性。
3.4.2. MTT法测细胞活性
培养10 h后,加入20 µL的MTT溶液,继续培养4 h,吸去培养液,加入100 µL DMSO,10 min后在490 nm下测吸光度,计算细胞存活率 [14] [15]。
4. 结果及分析
4.1. 传统工艺法
通过对温度、料液比等参数的比较,传统工艺法提取月见草根多糖在温度75℃、料液比为1 g:20 mL时,多糖的最高提取率为75.00%。
4.2. 单因素水平试验及结果 [16]
4.2.1. 微波提取法
采用微波提取法对月见草多糖进行提取,结果(表2)所示,通过对比,最佳提取时间为25 min,最佳料液比为1 g:20 mL,最佳微波功率为460 w。
4.2.2. 超声提取法
采用超声提取法对月见草多糖进行提取,结果如表3所示,通过对比,超声提取法的最佳提取温度为20℃,最佳料液比为1 g:20 mL,最佳超声功率为60 w。
4.3. 月见草根多糖的动态分析
不同采收时间月见草根的多糖含量结果显示(表4),不同时期月见草根的多糖含量差异显著。在每年的11月份和3月份多糖含量较高,而在7、8月份多糖的含量明显偏低。不同土质对月见草根中多糖的含量如表4所示,不同土质下种植的月见草的根中多糖含量不同,月见草的根中多糖的含量砂质土中要高于壤土中。

Table 4. The extraction rate of polysaccharides at different stages
表4. 不同时期月见草根中多糖含量
4.4. 月见草根中多糖的抗氧化活性
样品组与模型组有显著差异,与模型组相比较月见草多糖能够明显提高经过氧化氢诱导损伤的RAW264.7的存活率(图1)。在多糖浓度为5 μg/mL、25 μg/mL、250 μg/mL时,有一定的抗氧化活性且有剂量效应;在多糖浓度为500 μg/mL、1000 μg/mL、2000 μg/mL时,与模型组差异有统计学意义(P < 0.05)。
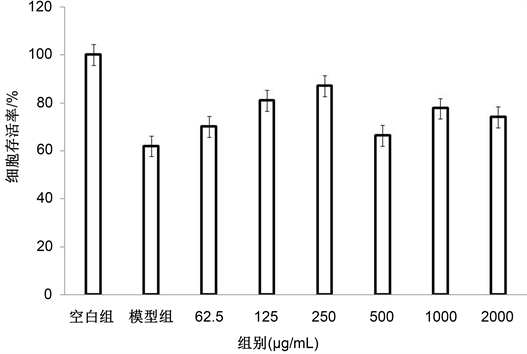
Figure 1. Repair effect of evening primrose polysaccharide on RAW264.7 cells damaged by hydrogen peroxide
图1. 月见草多糖对过氧化氢损伤的RAW264.7细胞的修复作用
5. 响应面法优化月见草多糖提取工艺
5.1. 微波提取法
在单因素实验的基础上,参考文献 [17] [18] [19] [20] 选取提取时间、料液比、微波功率进行三因素三水平的实验设计,因素水平分别以−1、0、1编码,以月见草根多糖的得率为响应值,见表5。
以提取时间、微波功率、料液比为自变量,月见草多糖提取率为响应值,利用Design-Expert8.0.6软件进行三因素三水平的响面数据分析,结果见表6、表7。

Table 6. Response surface analysis of experimental design and results
表6. 响应面分析实验设计及结果

Table 7. Fitting regression analysis results
表7. 拟合回归分析结果
表注:A-时间,B-微波功率,C-料液比。
表7表明A、B、C因素对多糖提取率影响显著,表明三个因素对月见草多糖的提取有影响,提取时间、微波功率、料液比均对月见草多糖的提取有显著影响。
5.2. 超声提取法
在单因素基础上选取提取温度、料液比、超声功率进行三因素三水平的实验设计,实验结果见表8。
以提取时间、微波功率、料液比为自变量,月见草多糖提取率为响应值,利用Design-Expert8.0.6软件进行三因素三水平的响面数据分析,结果见表9和表10。

Table 9. Response surface analysis of experimental design and results
表9. 响应面分析实验设计及结果


Table 10. Fitting regression analysis results
表10. 拟合回归分析结果
表注:A-温度,B-料液比,C-超声功率。
表9表明A、B、C因素对多糖提取率影响显著,表明三个因素对月见草多糖的提取有影响,其中料液比对月见草多糖的提取有显著影响。
6. 响应面图分析 [21]
根据上述表格分别得到微波提取法和超声提取法的三因素对月见草多糖提取率影响的响应面图和等高线图。
6.1. 微波提取法
由图2~4可知,说明微波功率和时间之间、时间和料液比之间对多糖提取率影响显著;料液比和微波功率之间对多糖提取率的影响不显著。
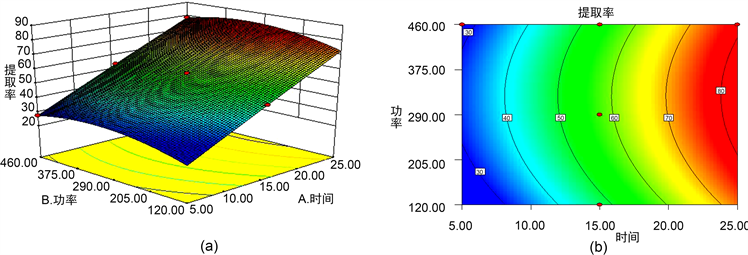
Figure 2. Response surface and contour line of microwave power and extraction time to the extraction rate of polysaccharides from monthly grass roots
图2. 微波功率与提取时间对月见草根多糖提取率的响应面及其等高线
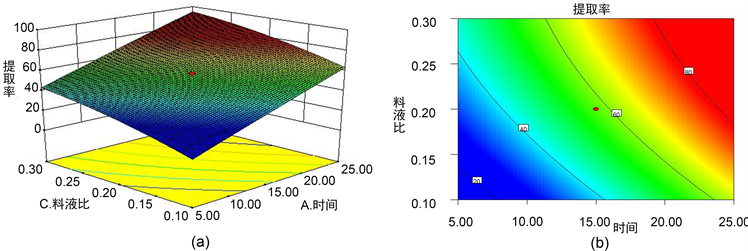
Figure 3. The response surface and contour line of the ratio of solid to liquid and extraction time to the extraction rate of polysaccharides from grass root
图3. 料液比与提取时间对月见草根多糖提取率响应面及其等高线
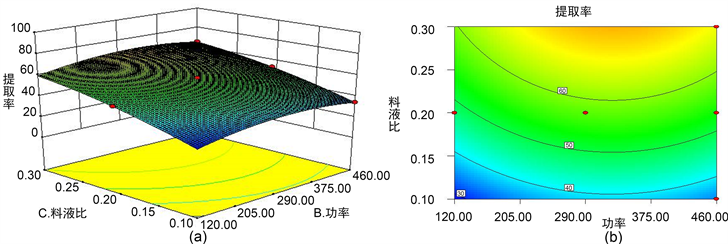
Figure 4. The ratio of feed to liquid and microwave power to the response surface and contour line of polysaccharides
图4. 料液比与微波功率对月见草根多糖响应面及其等高线
6.2. 超声提取法
图5~7说明温度和料液比之间、温度和超声功率之间对月见草多糖的提取率影响显著:超声功率和料液比之间相互作用较小,对月见草多糖的提取率影响不显著。
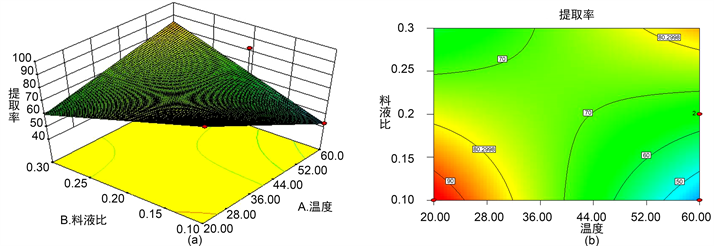
Figure 5. The response surface and contour line of the ratio of solid to liquid and extraction temperature to the extraction rate of polysaccharides from grass root
图5. 料液比与提取温度对月见草根多糖提取率响应面及其等高线
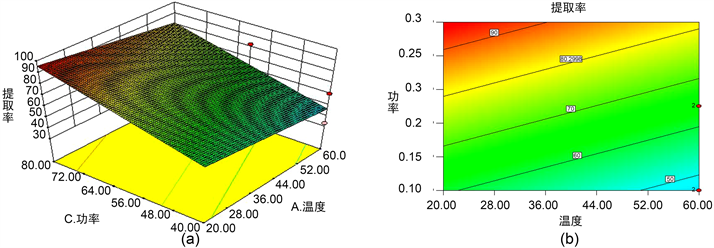
Figure 6. The response surface and contour line of ultrasonic power and extraction temperature to the extraction rate of polysaccharides
图6. 超声功率与提取温度对月见草根多糖提取率响应面及其等高线
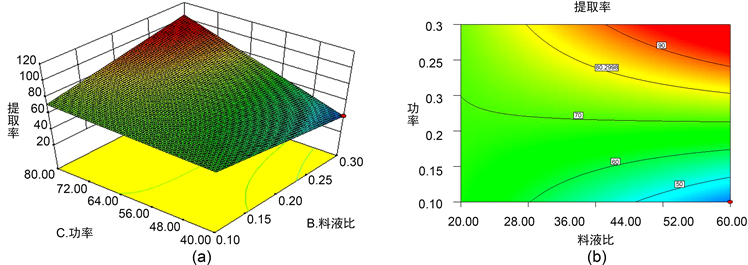
Figure 7. The response surface and contour line of the ratio of solid to liquid and ultrasonic power to the extraction rate of polysaccharides from grass root
图7. 料液比与超声功率对月见草根多糖提取率响应面及其等高线
7. 结论
本实验通过单因素试验和响应面法分析设计,得到了月见草根中多糖在微波提取法中的最佳工艺条件:最佳提取时间为25 min,最佳料液比为1:20,最佳微波功率为460 w,在此条件下的多糖提取率为78.55%;在超声提取法中的最佳工艺条件:最佳提取温度为20℃,最佳料液比为1:20,最佳超声功率为60 w,在此条件下的多糖提取率为77.62%。通过研究得出,本实验所选用的微波提取法提取月见草中的多糖,与其它两种方法相比,具有提取效率高、速度快等特点。该提取方法也被用于紫荆花多糖 [7] 、天麻多糖 [13] 等多种多糖的提取工艺中,并获得了较好的效果。
微波提取多糖的效率高,其原理是微波能根据所遇介质性质不同会产生反射、吸收和穿透等现象 [22]。微波辐射植物维管束和腺细胞,使细胞内部快速升温,内压提高,细胞壁膨胀破裂,提高溶剂活性细胞,内含物流出而溶解在溶剂中 [23] [24] [25] [26]。但超声的作用效果没有微波的更彻底,超声时间太长,杂质可随有效成分一起被提取出来,而且超声时间越长,杂质含量越高 [27] [28] [29]。与传统工艺法相比较,超声提取法和微波提取法,提取月见草多糖所用时间短,提取率也较高。综合分析上述三种提取方法,我们得到了月见草多糖的最佳提取工艺为微波提取法,并进一步明确了微波提取的最佳提取参数。
本实验通过对不同时期、不同土质的月见草根中多糖的含量进行分析,发现经过生长期的生长,11月份的月见草多糖含量最高,可达75.61%。月见草的花期为第二年6~9月,在其花期时茎高50~200厘米,因此根部的营养成分在此时向上运输,导致根部多糖含量降低。在11月和3月附近,月见草的基生叶丛紧贴地面,根吸收主要的营养成分,因此,月见草根中的多糖在11月份时最高,且研究发现月见草更适合在砂质土壤中生长。通过对不同时期的月见草的根中的多糖含量进行比较,明确了提取月见草的根的多糖的最佳时期。并通过不同浓度的月见草根中多糖对过氧化氢损伤的RAW264.7细胞的修复作用进行比较,发现月见草多糖具有一定的抗氧化活性,为月见草根中多糖的进一步研究与开发奠定了基础。
基金项目
2017年中医药公共卫生补助专项“全国中药资源普查项目”(财社【2017】66号);国家大科学装置—山东野生植物资源调查(2019-01)。
NOTES
*通讯作者。