1. 引言
真菌性角膜炎是一种由于真菌感染引起的角膜炎症,是最具破坏性的微生物性角膜炎 [1]。现已成为发展中国家常见的感染性致盲病,烟曲霉和镰刀菌是真菌性角膜炎最常见的病原体 [2]。真菌性角膜炎起病缓慢、病程长,病程可持续达2至3个月,常在发病数天内出现角膜溃疡。与病毒性或细菌性角膜溃疡相比,真菌性角膜溃疡往往有更差的预后 [3]。如果不及时治疗,轻度情况下可能会导致角膜的瘢痕,严重的情况下可能会导致角膜穿孔,导致眼内炎。由于人体对于真菌的先天免疫应答反应差,还有常规药物对于真菌性感染的疗效不佳等缺点(如药物的组织渗透性差、细胞毒性强和容易产生耐药性),真菌性角膜炎已成为造成视力损害和失明的一个主要原因 [4]。
参与炎症反应的众多炎症因子中,肿瘤坏死因子(Tumor Necrosis Factorα, TNF-α)、白细胞介素-1β (Intcrlcukclin-1β, IL-1β)、白细胞介素-6 (Intcrlcukclin-6, IL-6)的作用颇为重要 [5] [6]。TNF-α是在炎症反应过程中早期开始出现的,也是最重要、最普遍的炎性介质,它能激活免疫系统中起主要作用的细胞如中性粒细胞和淋巴细胞,并且使血管内皮细胞的通透性增加,以有利于血液的供应,并且能促使炎症过程中多种其他细胞因子的合成和释放,能调节其他组织代谢活性 [7]。白细胞介素-6 (Intcrlcukclin-6, IL-6)是具有多种生物学活性的细胞因子,也是机体复杂的细胞因子网络中的关键因子。IL-6可以调节其他细胞因子的作用,趋化、活化中性粒细胞和单核细胞,促进血管内皮细胞表迖黏附分子和其他炎症递质,增强局部的炎症反应,同时诱导B细胞分化和产生抗体,并诱导T细胞活化增殖、分化,参与机体的免疫应答,是炎性反应的促发剂 [8]。IL-1β主要由活化的单核–巨噬细胞产生。局部低浓度时协同刺激抗原呈递细胞(Antigen-presenting cells, APC)和T细胞活化,促进单核–巨噬细胞等APC的抗原递呈能力,促进B细胞增殖和分泌抗体,进行免疫调节;吸引中性粒细胞,引起炎症介质释放;刺激多种不同的间质细胞释放蛋白分解酶并产生一系列效应;可以通过血循环引起全身反应,并作用于下丘脑可引起发热,具有较强的致热作用 [9]。
虾青素(Astaxanthin, ASX)是红色的类胡萝卜素酮式含氧衍生物 [10],具有抗炎、抗氧化、抗衰老、抗肿瘤、预防心脑血管疾病等作用,国际上已将其应用于保健食品、高档化妆品、药品等领域中 [11]。1938年,库恩等人在龙虾中发现了ASX,最初用于水产养殖中的着色剂。其在水生动物中具有多种生物学功能,包括抵御紫外线辐射、防止色素沉着、控制免疫反应、保护生殖能力、提高应激耐受、抗氧化保护等 [12]。目前,ASX在抗氧化、抗炎、神经保护、抗凋亡、抗肿瘤等临床方面被广泛的研究 [13]。同时,ASX的安全性也是有保证的,美国食品和药物管理局已允许在动物饲料中使用ASX作为食品着色剂,而欧盟委员会已批准使用天然ASX作为食品染色剂 [14]。
由于食品药品及健康领域对于天然ASX的需求,对ASX的研究日益增多。ASX可从各种微生物、浮游植物、海洋动物和海鲜中提取,其中雨生红球藻(一种单细胞生物)是人类食用ASX的主要来源 [15]。ASX的分子结构类似于β-胡萝卜素和其他类胡萝卜素,但与胡萝卜素亚类的其他分子不同之处在于,它中间有一个非极性区,由一系列称为“共轭”的碳碳双键组成,这种碳碳双键形成的共轭长链结构通过提供电子并与自由基反应将其转化为更稳定的产物并在各种生物体中终止自由基链反应而充当强抗氧化剂 [10]。这些独特的分子结构使其具有更强的抗炎抗氧化能力,比维生素C、维生素E、β-胡萝卜素高出14~65倍,在多种不同的疾病中发挥抗炎抗氧化作用 [14]。
ASX现在越来越多被用在药物研究中,并已被证实在很多疾病中发挥抗炎作用。T. Dolma等的实验证实了ASX对小鼠乳腺炎有治疗作用 [16]。此外,Y. Suzuki等的实验证实ASX可以抑制葡萄膜炎的炎症反应 [17]。还有报道揭示了ASX能有效降低皮炎病程中的炎症因子,减轻皮肤疾病的严重程度 [18] [19]。提示ASX在抑制炎症反应中起重要作用。此外,在神经系统炎症、肝炎、胰腺炎和视网膜缺血性病变等其他多种疾病中均发挥抗炎作用,保护组织正常结构和功能 [20] [21] [22] [23]。
但ASX在真菌性角膜炎中的抗炎作用还未见报道。因此,我们对此进行了探究。
2. 材料与方法
2.1. 实验物品及试剂
2.1.1. 实验对象
雌性易感型C57BL/6小鼠(自江苏省常州Cavens动物实验中心获取,实验前于裂隙灯下检查小鼠眼部发育正常。实验动物的使用均符合美国眼科和视觉研究协会The Association for Research in Vision and Ophthalmology关于在眼科和视觉研究中动物使用的原则和标准)。
2.1.2. 实验细胞
人永生化角膜上皮细胞株(HCECs)由厦门眼科中心提供。
2.1.3. 实验菌种烟曲霉菌
烟曲霉菌菌种(编号 3.0772) (自中国普通微生物培养物保藏中心获取)。
2.1.4. 实验用药
虾青素(粉剂) (自美国Sigma Aldrich Chemical 公司获取)。
2.1.5. 实验所需试剂及耗材
RNA提取试剂:RNAiso Plus (自大连TaKaRa有限公司获取)、实时荧光定量PCR试剂盒:SYBR Premix Ex Taq (自大连TaKaRa有限公司获取)、逆转录试剂盒:Prime Script RT试剂盒(自大连TaKaRa有限公司获取)。小鼠IL-1β、IL-6及TNF-α酶联免疫吸附测定试剂盒(自武汉Elabscience公司获取)。
2.2. 烟曲霉菌培养及菌丝刺激液的制备
取出冻存的标准烟曲霉菌菌株,在超净台将其溶解吹打后接种在Sab-ouroud琼脂培养基上。将培养基置于在28℃恒温箱中并观察菌株的生长情况,约5~7天后,当烟曲霉菌生长良好布满培养基时,用无菌接种环刮取烟曲霉菌的孢子及菌丝,将其接种于含Sabouroud液体培养基的无菌锥形瓶内,用无菌纱布严密包扎瓶口,在37℃摇床培养箱内120 rpm条件下培养5天左右,待生长至呈团状菌丝状态时,收集无菌锥形瓶内的烟曲霉菌菌丝于离心管内,仔细并多次研磨以制备烟曲霉菌菌液。研磨充分后在12,000 rpm、4℃条件下进行离心15分钟,弃去上清,用吸管吸取无菌PBS溶液充分洗涤菌液,重复3遍。最后一遍弃去洗涤液,一部分菌液加入75%的酒精充分混匀后于4℃冰箱过夜灭活菌丝。次日再次离心,弃去上层酒精,用无菌PBS溶液洗涤并再次离心3遍后弃去洗涤液,加入DMEM培养液混匀制成菌丝悬液,用血细胞计数板于显微镜下进行菌丝计数,配制成最终浓度为 1×108/CFU的菌丝刺激液。
2.3. 小鼠真菌性角膜炎模型的建立
准备30只C57BL/6小鼠(年龄:8周;体重:20 ± 2 g)。小鼠通过腹腔注射8%水合氯醛(0.4 ml/kg)麻醉小鼠。在立体显微镜下,用角膜基质注射针将体积为5 μL的烟曲霉菌菌液注射于右眼角膜基质中。左眼不做任何处理,为未建模的正常眼。将小鼠随机分为两组,分别为DMSO处理组和ASX处理组。每天三次给药处理,给药方式为眼水点眼,ASX治疗组给与浓度为64 μM (ASX浓度的设定:通过CCK-8确定ASX自0 μM到128 μM均对小鼠角膜上皮细胞无明显毒性,为可选范围,故选择测量最大值的一半为实验用药浓度),溶质为灭菌PBS溶液,DMSO处理组给与同等体积的灭菌PBS溶液,由于药物最初是溶于DMSO溶质,所以对照组中加入了与ASX处理组相同量的DMSO,使DMSO浓度一致,确保ASX为唯一变量。在实验需要的不同时间点麻醉小鼠后并在裂隙灯下拍摄小鼠角膜照片度并根据角膜的炎症程度进行临床评分。在实验需要的不同时间点麻醉小鼠后通过颈椎脱臼法处死小鼠,根据PCR、ELISA等具体的实验方法及时处理小鼠眼球和角膜组织。小鼠角膜的炎症评分分级见表1 [24]。

Table 1. Inflammation grade of mouse fungal keratitis model
表1. 小鼠真菌性角膜炎模型炎症分级 [24]
注:角膜炎症评分的总分为三项观察指标的分数之和。
2.4. 细胞的刺激试验
在十二孔板细胞培养基中细胞生长均匀并达到约80%融合时即为可以开始使用,将细胞分为6组,分别为:1) 正常组;2) DMSO组;3) ASX处理组;4) 烟曲霉菌组;5) 烟曲霉菌 + DMSO组;6) 烟曲霉菌 + ASX组,每组至少3个孔,在相应的孔里加入对应处理条件后处理2小时,后在培养基中加入灭活的烟曲霉菌菌丝刺激液,菌丝终浓度为5 × 106个/ml,烟曲霉菌菌丝刺激8小时后收取十二孔板的HCECs,用于PCR法检测下游促炎细胞因子(IL-1β, IL-6, TNF-α)的mRNA表达。24小时后收取十二孔板细胞,用于ELISA法检测下游炎症因子(IL-1β, IL-6, TNF-α)的蛋白表达。
2.5. Real-time RT-PCR实验方法
在Pubmed的GeneBank中查找小鼠引物:mβ-actin、mIL-1β、mIL-6、mTNF-α,及人的引物:hβ-actin、hIL-1β、hIL-6、hTNF-α的mRNA 序列,设计引物,并在Pubmed中验证引物的特异性。引物的合成由大连TaKaRa有限公司负责完成。目的基因的引物序列见表2。

Table 2. Real-time RT-PCR primer sequence
表2. Real-time RT-PCR引物序列
注:各引物退火温度为95℃。
使用RNA裂解液(RNAiso Plus)分离小鼠角膜(充分研磨)和细胞(HCECs)各个样本的总RNA,测出每个样本RNA含量后,按照逆转录试剂盒步骤进行逆转录得到样本DNA。根据PCR试剂盒步骤配置相应混合待测液,立即置PCR仪上,进行内参及目的基因扩增反应。扩增条件为:95℃预变性30 s → 95℃变性5 s、60℃ 30 s (重复40个循环) → 95℃退火、延伸15 s → 60℃30 s → 95℃溶解15 s。反应结束后,根据各样本的内参及目的基因循环数,计算目的分子的mRNA相对表达量。
2.6. ELISA实验方法
将小鼠角膜组织取下后,置于500 μl无菌PBS液中,充分破碎角膜组织,将上清液转移至EP管中。分别设空白孔、不同浓度梯度的标准孔、待测样品孔。注意不要有气泡,加样时尽量不触及孔壁,轻轻晃动混匀。酶标板上覆膜,37℃恒温箱孵育90分钟。弃去液体,甩干。加入生物素化抗体工作液,酶标板上覆膜,37℃恒温箱温育1小时。弃去液体,甩干,大约350 μl/每孔,洗板3次,每次浸泡2分钟,甩干并在吸水纸上轻拍将孔内液体拍干。每孔加酶结合物工作液100 μl,加上覆膜,37℃温育30分钟。弃去液体,甩干,每孔加洗涤液350 μl,洗板3次,每次浸泡2分钟,甩干并在将孔内剩余液体在吸水纸上拍干。迅速向每孔加底物溶液(TMB) 90 μl,酶标板加上覆膜并避光37℃温育15~30分钟。当一半数量的标准孔出现明显的蓝色梯度时终止反应。迅速向每孔加入50 μL反应终止液,加入顺序与加底物,底物顺序保持一致,之后孔内液体由蓝色转为黄色。将96孔板中液体轻轻混匀,置于酶标仪中,检测并记录各孔在450 nm波长的吸光度值。根据检测结果,计算出各组样品目的蛋白的浓度。
2.7. 统计学分析
所有数值数据均表示为平均值的平均值±标准误差(SEM)。所有实验都至少进行了三次。采用单因素方差分析(ANOVA)对三组或三组以上的数据进行比较,并采用未配对双尾t检验对多组数据进行比较。P值小于0.05具有统计学意义。
3. 结果
3.1. ASX能减轻烟曲霉菌诱导的真菌性角膜炎小鼠角膜的疾病表现及炎症评分
在真菌性角膜炎小鼠角膜模型中,在第3天时ASX治疗组的角膜与对照组相比,透明度更高,溃疡灶面积和深度明显降低(图1A)。ASX治疗组在第3天的临床炎症评分也明显低于对照组(图1B)。提示ASX可提高角膜透明度,缩小溃疡灶,减轻烟曲霉菌对角膜的破坏,降低了临床炎症评分,对患有真菌性角膜炎的角膜有保护作用。
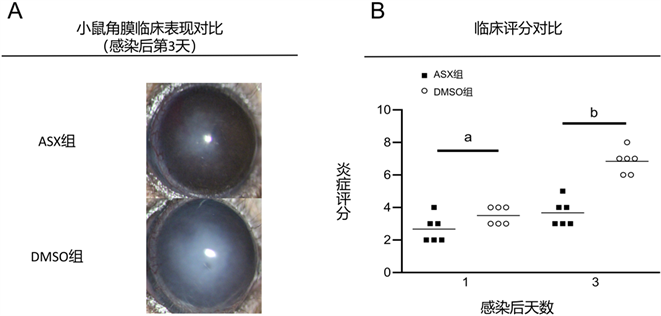 注:A.感染后第3天用裂隙灯拍摄的图像显示了DMSO处理组与虾青素治疗组小鼠的临床表现。B.基于临床表现得出的临床评分(n = 6/组)显示,DMSO处理组的评分明显高于虾青素处理组(aP < 0.05; bP < 001)。
注:A.感染后第3天用裂隙灯拍摄的图像显示了DMSO处理组与虾青素治疗组小鼠的临床表现。B.基于临床表现得出的临床评分(n = 6/组)显示,DMSO处理组的评分明显高于虾青素处理组(aP < 0.05; bP < 001)。
Figure 1. Clinical manifestations and inflammatory score of astaxanthin in the treatment of fungal keratitis in mice
图1. 虾青素治疗小鼠真菌性角膜炎的临床表现及炎症评分
3.2. ASX在基因水平抑制烟曲霉诱导的真菌性角膜炎小鼠角膜中炎性细胞因子的产生
在真菌性角膜炎小鼠模型角膜中,于处理后第3天检测ASX治疗组与对照组的IL-1β、IL-6和TNF-α的mRNA的表达(图2A-C)。PCR结果显示,在第3天,ASX治疗组的IL-1β、IL-6和TNF-α的表达水平在基因水平显著低于DMSO组。提示ASX可以抑制烟曲霉诱导的真菌性角膜炎小鼠模型中炎性细胞因子的产生。
3.3. ASX在蛋白水平抑制烟曲霉诱导的真菌性角膜炎小鼠角膜中炎性细胞因子的产生
在真菌性角膜炎小鼠模型角膜中,于处理后第3天检测ASX治疗组与对照组的IL-1β、IL-6和TNF-α的mRNA的表达(图3A-C)。ELISA结果显示,在第3天,ASX治疗组的IL-1β、IL-6和TNF-α的表达水平在蛋白水平显著低于DMSO对照组。提示ASX可以抑制烟曲霉诱导的真菌性角膜炎小鼠模型中炎性细胞因子的产生。
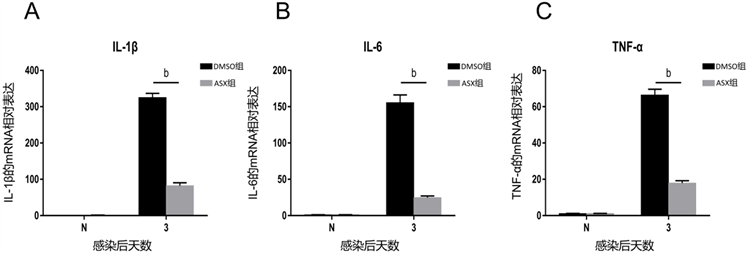 注:A-C.虾青素治疗组在感染后第3天,较DMSO处理组相比,IL-1β、IL-6和TNF-α的相对表达显著下调。(bP < 0.01)。
注:A-C.虾青素治疗组在感染后第3天,较DMSO处理组相比,IL-1β、IL-6和TNF-α的相对表达显著下调。(bP < 0.01)。
Figure 2. The mRNA relative expression of inflammatory factors (IL-1β, IL-6 and TNF-α) in the mouse model of fungal keratitis induced by Aspergillus fumigatus
图2. 烟曲霉菌诱导的真菌性角膜炎小鼠模型中炎症因子(IL-1β、IL-6和TNF-α)的mRNA的相对表达
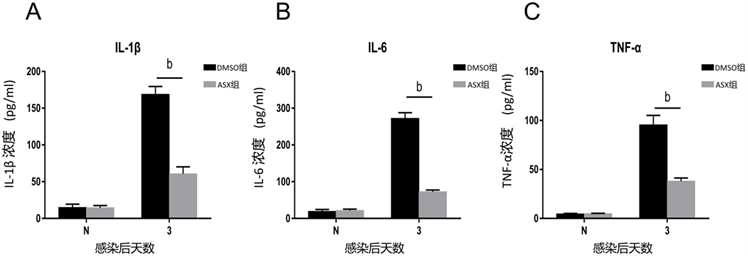 注:A-C. ELISA结果显示,虾青素处理组IL-1β、TNF-α和HMGB-1蛋白水平在感染后第3天明显低于DMSO处理组。(bP < 0.01) (N = 正常组;DMSO = DMSO组;ASX = 虾青素组)。
注:A-C. ELISA结果显示,虾青素处理组IL-1β、TNF-α和HMGB-1蛋白水平在感染后第3天明显低于DMSO处理组。(bP < 0.01) (N = 正常组;DMSO = DMSO组;ASX = 虾青素组)。
Figure 3. The expression of inflammatory factors (IL-1β, IL-6 and TNF-α) in the mouse model of fungal keratitis induced by Aspergillus fumigatus in protein level
图3. 烟曲霉菌诱导的真菌性角膜炎小鼠模型中炎症因子(IL-1β、IL-6和TNF-α)的蛋白水平的表达
3.4. ASX在基因水平抑制烟曲霉菌感染的HCECs中的炎症因子的上调
烟曲霉菌处理HCECs细胞后8 h,我们设置了6个不同处理条件的组,来排除药物溶剂DMSO对细胞的影响,结果示,正常组及加菌组和加了DMSO处理的正常组及加菌组相比,结果无统计学意义(图4A-C),说明了药物溶质DMSO对实验结果无统计学意义的影响。烟曲霉菌处理的HCECs中IL-1β、IL-6和TNF-α都较正常组有显著升高,说明烟曲霉菌诱导了HCECs中炎症的发生,而ASX处理组的相关因子与单纯加菌组相比较有着显著的下调(图4A-C),说明了ASX在人角膜上皮细胞中抑制烟曲霉诱导的真菌性角膜炎小鼠模型中炎性细胞因子的产生,抑制炎症表达。
3.5. ASX在蛋白水平抑制HCECs中因烟曲霉菌而上调的炎性细胞因子
细胞系的ELISA实验结果在蛋白水平检测了炎症因子的表达水平,表明了ASX能够下调因烟曲霉菌诱导而升高的相关炎症因子(图5A-C),进一步验证了ASX在人角膜上皮细胞中抑制烟曲霉诱导的真菌性角膜炎小鼠模型中炎性细胞因子蛋白水平的表达,抑制炎症。
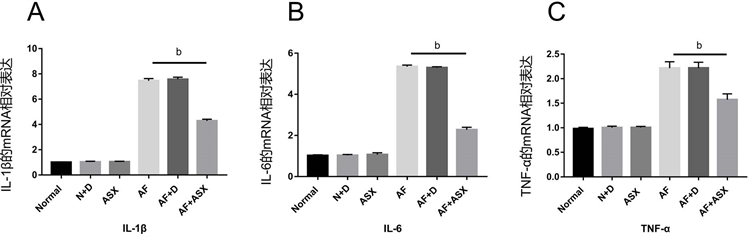 注:A.加真菌后8 h后各组HCECs中QT-PCR检测炎症因子IL-1β,IL-6和TNF-α的表达。(bP < 0.01) (Normal = 正常组;N + D = 正常HCEC细胞 + DMSO;ASX = 虾青素处理组;AF = 烟曲霉菌组;AF + D = 烟曲霉菌 + DMSO;AF + ASX = 烟曲霉菌 + 虾青素)。
注:A.加真菌后8 h后各组HCECs中QT-PCR检测炎症因子IL-1β,IL-6和TNF-α的表达。(bP < 0.01) (Normal = 正常组;N + D = 正常HCEC细胞 + DMSO;ASX = 虾青素处理组;AF = 烟曲霉菌组;AF + D = 烟曲霉菌 + DMSO;AF + ASX = 烟曲霉菌 + 虾青素)。
Figure 4. Detection of the expression of inflammatory factors (IL-1β, IL-6 and TNF-α) by QT-PCR in HCECs
图4. HCECs中QT-PCR检测炎症因子 (IL-1β、IL-6和TNF-α)的表达
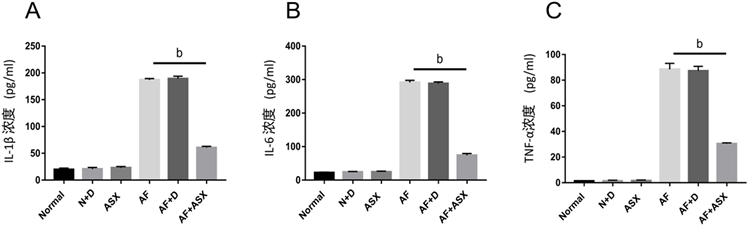 注:A-C.加真菌后24 h后各组HCECs中ELISA检测炎症因子IL-1β、IL-6和TNF-α的表达。(bP < 0.01) (Normal = 正常组;N + D = 正常HCEC细胞 + DMSO;ASX = 虾青素处理组;AF = 烟曲霉菌组;AF + D = 烟曲霉菌 + DMSO;AF + ASX = 烟曲霉菌 + 虾青素)。
注:A-C.加真菌后24 h后各组HCECs中ELISA检测炎症因子IL-1β、IL-6和TNF-α的表达。(bP < 0.01) (Normal = 正常组;N + D = 正常HCEC细胞 + DMSO;ASX = 虾青素处理组;AF = 烟曲霉菌组;AF + D = 烟曲霉菌 + DMSO;AF + ASX = 烟曲霉菌 + 虾青素)。
Figure 5. Detection of the expression of inflammatory factors (IL-1β, IL-6 and TNF-α) by ELISA in HCECs
图5. HCECs中ELISA检测炎症因子(IL-1β、IL-6和TNF-α)的表达
4. 讨论
真菌性角膜炎(真菌性角膜炎)是眼科学临床方面面临的巨大挑战 [25]。而烟曲霉菌是世界范围内真菌性角膜炎的主要病原之一,感染后往往会导致视力损害甚至失明 [26]。
通常来说,炎症是机体的一种抗病反应,对机体往往是有利的,例如炎性充血,能使组织得到更多的氧、营养物质等,使得表面组织代谢和抗击力增加;渗出液能稀释毒素,其中所含的抗体能清除病原体并中和毒素;渗出的纤维蛋白元凝结而成假膜,设立成一道遮蔽,能阻止病原菌向深部蔓延;渗出物中的中性白细胞和巨噬细胞能吞噬病原体及坏死崩解的细胞碎屑;炎症部位的浆细胞和淋巴细胞能产生抗体中和毒素 [5]。
但是,我们要从两个方面来分析炎症。炎症反应中的某些利于因素,在一定条件下,可以向着各自相反的方向转化而变成对机体有害的因素 [27]。真菌性角膜炎即使及时给予适当的治疗,临床疗效也往往不佳,其中一个最重要的原因是过度的免疫反应,它会招募过量的各种炎性细胞因子和免疫细胞,导致角膜组织蛋白质沉淀,降低角膜透明度。所以在临床治疗过程中,在合适的时机联合用药是治疗真菌性角膜炎的最佳方案 [28]。因此,控制真菌性角膜炎中晚期的炎症反应是非常关键的,因为在真菌性角膜炎中晚期,过度炎症反应引起的组织损伤大于其保护作用,甚至在联合用药的情况下,早期控制炎症对角膜的保护都是积极的 [29]。
本篇研究探讨ASX在真菌性角膜炎中的抗炎作用。ASX是一种具有强抗氧化性的类胡萝卜素,研究表明它在肝炎、胰腺炎、皮炎、神经病变、乳腺炎和葡萄膜炎等多种急慢性疾病中都能起到重要的生物学作用。我们的实验结果发现,ASX改善了烟曲霉菌诱导的小鼠真菌性角膜炎的临床表现,降低了临床炎症评分,提高了角膜透明度,提示ASX在真菌性角膜炎病程中对角膜组织起保护作用。
炎性细胞因子如IL-1β、IL-6和TNF-α是反映炎症反应严重程度的重要指标,是真菌性角膜炎中最重要的炎症因子,在炎症过程中起着至关重要的作用 [6]。它们激活免疫系统,趋化及活化巨噬细胞中性粒细胞及其他炎症因子,在真菌性角膜炎中,这些作用往往会破化角膜基质细胞,影响内皮细胞的正常功能,从而导致了角膜透明度的损失 [30] [31]。而减轻炎症的过程,就是保护角膜透明度的过程。大量研究表明ASX能够抑制各种急慢性炎症中炎症因子的表达。Suzuki等的研究表明ASX可通过阻断NF-kB依赖性信号通路抑制葡萄膜炎大鼠IL-1β、IL-6和TNF-α的表达 [17]。Zhou L.等在小鼠败血症模型中发现ASX通过下调炎症因子如IL-1β和TNF-α来防止组织损伤 [32]。这些结论说明ASX能够在体内外抑制真菌性角膜炎中IL-1β和TNF-α的高表达,提示ASX在真菌性角膜炎的病理过程中对角膜组织起到保护作用。
而我们的实验结果表明,不仅在细胞实验中,而且在动物模型中,ASX处理组的炎症因子(IL-1β、IL-6和TNF-α)都较对照组在基因和蛋白水平都有明显的下调。这些结果都提示ASX在真菌性角膜炎病理过程中同样能发挥抗炎作用,可作为一种有潜力的治疗真菌性角膜炎的药物,甚至可考虑与其他药物联合治疗,发挥有效保护角膜组织,防止角膜组织细胞的过度损坏,保护角膜透明度的作用,在临床治疗中可考虑进一步实验和应用。
5. 结论
总而言之,ASX在各种疾病中发挥了积极的生物学作用。越来越多的研究数据也表明了ASX在各种急慢性炎症疾病中能有效地发挥抗炎作用,保护机体正常的组织结构,本实验的研究结果也表明了ASX有成为真菌性角膜炎新型抗炎药物的潜力,而关于ASX对真菌性角膜炎的治疗的具体作用机制则需要进一步的研究。