1. 引言
合金是由两种金属元素混合形成,可以在一定程度上调整所得材料的热、机械和电子性能。合金的表面偏析具有重要的意义,因为表面偏析可以增强或抑制理想和不理想的表面化学反应 [1],而合金催化剂的催化活性也几乎完全由表面性质所决定 [2]。
合金的表面反应性,通常是由与大气接触形成的氧化层来调节的,可能会发生化学反应与它不同组分的反应性有本质的不同。这是由于合金元素在表面附近的选择性偏析过程所产生的特殊的表面电子性质。例如,与纯元素相比,双金属合金可能具有更好的催化性能 [3] [4] [5] [6] [7]。特别是铂和钯的混合物广泛应用于氢气反应 [8] [9] 和氧化 [10] [11],以及电化学氧还原反应 [6] [7]。此外,易于腐蚀的金属表面可以通过选择性地形成稳定的元素合金化来钝化氧化层,如用于生物医学应用的FeCr或CoCr合金 [12]。无论是用于催化的贵金属合金,还是用于承受氧化环境腐蚀侵蚀的非贵金属合金,都需要对其表面成分和反应活性有详细的了解,以使合金性能合理化和最优化。在这两种情况下,裸露表面与氧气的反应都会严重影响其表面性质。然而,当合金膜被保存在气体环境中时,其氧化及表面偏析是一个必须要考虑的问题 [13] [14]。表面偏析的驱动力一般被认为是:i) 表面自由能的降低;ii) 由于溶剂和溶质原子尺寸的不同而引起的表面应力的降低;iii) 根据所考虑的元素的键强度,在断键方法中反映的元素汽化热的减少。全面了解表面偏析对进一步改进钯合金膜、催化剂或传感器至关重要。
自从表面偏析现象被Gibbs预言后,已有许多理论方法(模型)用来描述表面偏析现象,如第一性原理 [15] 和密度泛函理论 [16] 的计算方法太过复杂且耗时长;Langmuir-Mclean模型 [17],虽然能定量的描述部分简单合金体系的表面偏析现象,但是没有考虑原子间的相互作用;Monte Carlo方法 [18],需要确定正确的原子间相互作用势;在热力学框架下导出的修正Darken模型,计算简便,且能够描述体块材料和薄膜材料平衡态和动态的表面偏析 [19] [20] [21]。表面偏析通过改变体系表面成分和结构直接影响材料的性能,氧化物的存在会影响合金的偏析能,从而影响合金偏析元素的偏析。
本文以修正Darken模型为基础,分别模拟了二元合金Pd-X和三元合金Pd-X-PdO (X = Ag, Au, Cu, Ni, Pt)的表面偏析。通过模拟预测了PdO对Pd-X二元合金表面偏析的影响,为研究氧化物对Pd基合金表面浓度的改变提供了一种有效的研究方法。
2. 理论部分
2.1. 修正的Darken模型
在修正的Darken模型中,晶体被划分为N + 1层(1个表面层和N个体层),二元体系的表面偏析动力学过程可用一组耦合速率方程描述如下 [22]:
(1)
其中,
和
分别为偏析原子的表面浓度和第1体块层的浓度,D为扩散系数,R为气体常数,T为绝对温度,d是薄膜厚度。
是相邻两层的化学势差,
。根据规则固溶体理论模型,对二元系统,组元i在相j的化学势
与表面浓度
和相互作用系数
的关系表示为:
(2)
(3)
其中
为标准化学势,相互作用参数
表示为:
(4)
其中
和
分别为原子i之间的相互作用能与原子i和原子j之间的相互作用能,Z为晶体中原子的配位数。结合方程(2)和(3),方程组(1)中第一个方程可以改写为:
(5)
其中表面偏析能
是表面层和体块第1层间的标准化学势差,
,它与浓度和温度无关。对于块体合金材料,速率方程组的总层数N由速率方程组的解收敛性决定,即当N进一步增加时,速率方程的解不变。
当达到平衡态时,速率方程组(1)都应该等于零,由方程组(1)中第一个方程(即方程(5))可得到:
(6)
(7)
其中
和
分别为平衡态的表面浓度和体块浓度。(6)式是描述平衡态表面偏析的著名Bragg-Williams表达式。因此,平衡态表面偏析是速率方程组(1)的自然结果。(7)式表明在体系达到偏析平衡态时,体层中所有的体浓度值都等于体系初始浓度值
。
对于三元体系,平衡态的表面偏析满足下面条件 [23]:
(8)
根据规则固溶体理论模型,得到了平衡时的溶质1和2的表面偏析浓度为:
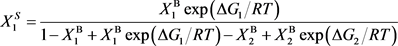 (9)
(9)
(10)
其中
(11)
(12)
由式(13)和(14)的右边表达式可知,如果
,则原子i偏析到表面。原子i的偏析能
受三个因素影响:第一项
是表面和体块间的标准化学势差;第二项
是溶质原子i和溶剂原子3的相互作用能;第三项
是溶质原子之间的相互作用。因此,
,偏析能
为正。
2.2. 表面偏析能和相互作用系数的计算
根据上面偏析理论模型可知,如果已知表面偏析能∆G和相互作用系数,就可以定量地描述表面偏析现象。Miedema模型是被广泛应用于计算表面偏析能和相互作用系数的模型之一 [24] [25] [26],它是基于大量实验数据基础上总结出来的半经验模型。实际上,对于复杂多晶系统的界面能而言,从实验及第一性原理计算都是非常困难的,Miedema模型基于基本热力学参量/热力学实验参数可以计算出表面和界面能、二元合金的生成焓等热力学参数,其预测准确性较好。
根据Miedema模型,单位摩尔原子的Gibbs表面能
(J/mol)可表示为单位面积的表面能
(J/mol)与摩尔原子的表面积
的关系 [27]:
(13)
(14)
其中,
为每个表面原子与真空接触的平均分数,其值为
,
为
的单位摩尔的总表面积,
为
的摩尔体积,C为一个常数,其平均值为:
。根据(13)式和(14)式,Gibbs表面能可表示为:
(15)
那么根据上面2.1表面偏析理论可知表面偏析能可表示为:
(16)
若
,溶质
往表面偏析,反之
往表面偏析。
和
为纯元素
体材料和表面区域的标准化学势,也相当于纯元素
在室温的吉布斯能和表面吉布斯能。其中表1给出了Miedema模型计算合金系统的表面偏析能所需的热力学参数。

Table 1. Thermodynamic parameters for the Miedema calculations
表1. 用于Miedema模型计算的热力学参数
对于由两种过渡金属、两种非过渡金属及一种过渡金属和一种碱土金属或贵金属形成的二元合金系统,按Miedama模型金属A溶于B中的形成焓为:
(17)
其中,
,
和
分别为A和B的电子化学势,单位eV,
,
和
分别为纯金属A和B的Wigner-Seitz原胞边界上的电子浓度,单位density units (d.u),由此可以看出,Miedema模型所考虑的合金化效应及用以描述这种效应所使用的两个半经验参数
和
均属于电子因素;VA和VB分别为纯元素A和B的摩尔体积;P、Q、R为经验常数。其中P的值有下面三种情况 [30]:
,两种过渡族金属元素形成的二元合金体系;
,两种非过渡金属元素形成的二元合金体系;
,一种过渡金属和一种非过渡金属元素形成的二元合金体系;
经验值
;
按照Miedema模型,合金形成焓是与不同元胞接触的表面积大小成比例的,因此,该合金的形成焓关系式应为:
(18)
其中
表示A原子与B原子相接触的比例,依赖于晶体的有序度。
和
分别是A原子和B原子的浓度分数(
)。对于随机无序原子(液体和非晶态):
;对于高度有序原子:
;对于规则固溶体,相互作用能可表示为 [31]:
(19)
根据上述的Miedema理论模型和分析,结合单位表面能数据和热力学参数数据(SGTE) (见表1),计算了Pd-Ag,Pd-Au,Pd-Cu,Pd-Ni和Pd-Pt多个二元合金系统的表面能和形成焓,结果见表2。其中表2 (最右一列)也给出了二元合金在氧环境下生成的最稳定的氧化物,是根据金属与气体的吸附能的大小决定的 [32]。

Table 2. Segregation parameters calculated by the Miedema model
表2. Miedema理论模型计算得到偏析参数
此外,根据文献 [33] 的计算可知PdO的吉布斯自由能改变值
,而根据(16)式可知Pd和PdO的偏析能
,因此,对于Pd-X-PdO三元合金,就Pd与PdO偏析竞争而言,PdO偏析到三元合金表面。在以下的计算中,取PdO与X (X = Pd, Ag, Au, Cu, Ni, Pt)的相互作用系数WXPdO = 0。
3. 结果与讨论
3.1. Pd-X二元合金的表面偏析
通过方程(6),计算了Pd-25 at% X (X = Ag, Au, Cu, Ni, Pt)二元合金中,平衡态表面偏析原子的表面浓度随温度的变化,如图1所示。图1显示随着温度的升高,偏析原子(Ag, Au, Cu, Ni)的表面浓度下降,而Pt的表面浓度近似为0,这证实了在PdAg、PdAu、PdCu和PdNi二元合金中偏析原子是溶质原子(Ag, Au, Cu, Ni),而在PdPt合金中偏析原子是Pd。另外,从图1中可知,随着温度的增加,Ni的平衡态表面偏析浓度下降的最快,Cu的平衡态表面偏析浓度下降的最缓慢,这是由于Ni和Pd的相互作用系数较小,可以忽略;而Cu和Pd的相互作用较大(见表2)。
通过方程(1),可以计算在一定温度下表面偏析原子动态的表面浓度,由此可以预测出合金达到偏析平衡态的时间。如图2给出了,当温度
,初始浓度均为25 at%时,偏析原子X表面浓度随时间的变化。由于溶质的扩散系数和元素之间的相互作用系数的不同,则PdCu和PdAg最先达到平衡态,相应的Cu和Ag平衡态浓度分别为55 at%和80 at%,与图1中的结果一致。由于PdNi和PdPt在600 K下达到平衡态偏析的时间较长,为方便比较,分别在800 K和700 K计算了PdNi和PdPt表面偏析浓度随时间变化的动态偏析。很明显,图2动态偏析给出的平衡态表面浓度与图1的计算结果一致。
3.2. Pd-Ag-PdO三元合金的表面偏析
由图1可知Ag与Pd的偏析竞争Ag偏析到PdAg合金表面,因此,在Pd-Ag-PdO三元合金中,是Ag和PdO偏析到三元合金表面。对于不同PdO体浓度的三元Pd-25 at% Ag-PdO合金,图3(a)给出了Ag和PdO平衡态表面浓度随温度的变化,图3(b)给出了在800 K时,Ag和PdO表面浓度随时间的变化,其中取Ag在PdAg合金中的扩散系数
[34]。从图3(a)中可知,随着温度的升高,Ag的表面浓度逐渐下降,而PdO的表面浓度缓慢上升;PdO的体块浓度越高,Ag表面浓度下降的速度越慢,PdO在表面的浓度越大。在相同温度下,由于PdO的存在,Ag表面浓度比在二元合金PdAg (图中实心点)中高。由图3(b)可知,当温度
时,在Pd-25 at% Ag二元合金中,Ag的平衡态的表面浓度等于70 at%;而在Pd-25 at% Ag-PdO的三元合金中,Ag的平衡态的表面浓度高于70 at%,并且随着PdO体块浓度的增加,Ag的平衡态的表面浓度增加,与图3(a)平衡态的结果一致。由于偏析原子的相互作用,开始时PdO快速偏析到合金表面,随着Ag偏析到表面替代偏析到表面的PdO,导致PdO的表面浓度出现先增加后降低的现象。综上分析,PdO的存在促进了Ag在PdAg合金的表面偏析。
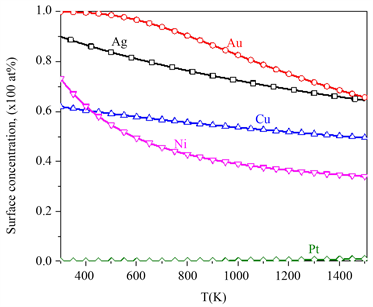
Figure 1. Equilibrium surface concentration with temperature in Pd-25 at% X (X = Ag, Au, Cu, Ni, Pt) binary alloys
图1. Pd-25 at% X (X = Ag, Au, Cu, Ni, Pt)二元合金平衡态表面偏析浓度随温度的变化
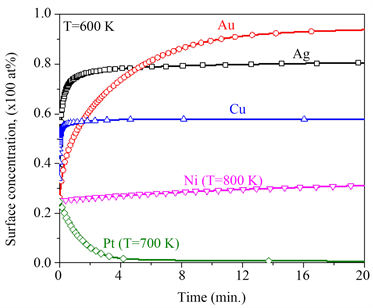
Figure 2. Kinetic surface segregation concentration with time in Pd-25 at% X (X = Ag, Au, Cu, Ni, Pt) binary alloys
图2. Pd-25 at% X (X = Ag, Au, Cu, Ni, Pt)二元合金动态表面偏析浓度随时间的变化
Figure 3. Pd-25 at% Ag-PdO ternary alloy with different initial concentrations of PdO, (a) the equilibrium surface concentration of Ag and PdO with temperature; (b) the kinetic surface concentration of Ag and PdO with time at T = 800 K
图3. Pd-25 at% Ag-PdO三元合金,在不同PdO初始浓度下,(a) Ag和PdO平衡态表面偏析浓度随温度的变化;(b) T = 800 K时,Ag和PdO的表面浓度随时间的变化
3.3. Pd-Au-PdO三元合金的表面偏析
对于PdAu二元合金,由图1可知Au偏析到合金表面,因此,在Pd-Au-PdO三元合金中,是Au和PdO偏析到合金表面。对于不同PdO体浓度的三元Pd-25 at% Au-PdO合金,图4(a)给出了Au和PdO平衡态表面浓度随温度的变化,图4(b)给出了600 K时,Au和PdO表面浓度随时间的变化,其中取Au在PdAu合金中的扩散系数
[35]。从图4(a)中可知,随着温度的升高,Au的表面浓度逐渐下降,而PdO的表面浓度缓慢上升;PdO的体块浓度越高,则Au表面浓度下降的速度越快,PdO在表面的浓度越大。在相同的温度下,由于PdO的存在,Au表面浓度比在二元合金PdAu (图中实心点)中低。由图4(b)可知,
时,在Pd-25 at% Au二元合金中,Au的平衡态的表面浓度等于90 at%;而在Pd-25 at% Au-PdO的三元合金中,Au的平衡态的表面浓度低于80 at%,并且随着PdO体块浓度的增加,Au的平衡态的表面浓度降低,与图4(a)平衡态的结果一致。综上分析,说明了PdO的存在抑制了Au在PdAu合金的表面偏析。

Figure 4. Pd-25 at% Au-PdO ternary alloy with different initial concentrations of PdO, (a) the equilibrium surface concentration of Au and PdO with temperature; (b) the kinetic surface concentration of Au and PdO with time at T = 600 K
图4. Pd-25 at% Au-PdO三元合金,在不同的PdO初始浓度下,(a) Au和PdO平衡态表面偏析浓度随温度的变化;(b) T = 600 K时,Au和PdO的表面浓度随时间的变化
3.4. Pd-Cu-PdO三元合金的表面偏析
对于PdCu二元合金,由图1可知Cu偏析到PdCu合金表面,因此,在Pd-Cu-PdO三元合金中,是Cu和PdO偏析到合金表面。对于不同PdO体浓度的三元Pd-25 at% Cu-PdO合金,图5(a)给出了Cu和PdO平衡态表面浓度随温度的变化,图5(b)给出了在550 K时,Cu和PdO表面浓度随时间的变化,其中取Cu在PdCu合金中的扩散系数
[36]。由于Cu与Pd的相互作用系数较大,并与偏析能数值相当(见表2),因此,当偏析原子的体浓度低于一定值时,其表面浓度会经历非连续的变化 [19] [20]。由图5(a)可知,当PdO的浓度为20 at%和30 at%时,随着温度的升高,Cu的表面浓度快速增加,并在约450 K呈现非连续的变化,然后再缓慢下降,而PdO的表面浓度先快速下降,随后呈现非连续变化,然后再缓慢下降;当PdO的浓度为35 at%和40 at%时,随着温度的升高,Cu的表面浓度呈连续性的缓慢下降,而PdO的表面浓度则逐渐升高。当
时,由于PdO的存在,Cu表面浓度比在二元合金PdCu (图中实心点)中低。由图5(b)可知,在
时,无论是PdCu二元合金还是Pd-Cu-PdO三元合金,Cu与PdO的表面浓度迅速达到平衡态的表面浓度,与图5(a)计算的平衡态的结果一致。综上分析,当温度
,x > 30 at%时,PdO的存在促进了Cu在PdCuPdO合金的表面偏析,35 at% PdO的促进作用最强;当温度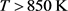 ,PdO的存在抑制了Cu在PdCuPdO合金的偏析。
,PdO的存在抑制了Cu在PdCuPdO合金的偏析。
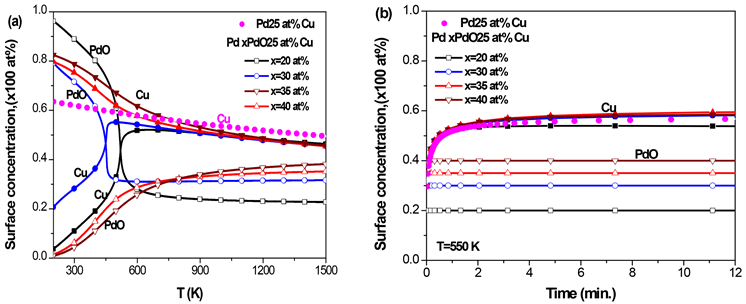
Figure 5. Pd-25 at% Cu-PdO ternary alloy with different initial concentrations of PdO, (a) the equilibrium surface concentration of Cu and PdO with temperature; (b) the kinetic surface concentration of Cu and PdO with time at T = 550 K
图5. Pd-25 at% Cu-PdO三元合金,在不同的PdO初始浓度下,(a) Cu和PdO平衡态表面偏析浓度随温度的变化;(b) T = 550 K时,Cu和PdO的表面浓度随时间的变化
3.5. Pd-Ni-PdO三元合金的表面偏析
对于PdNi二元合金,由图1
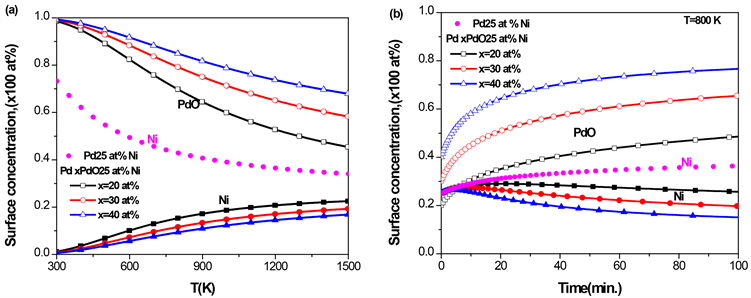
Figure 6. Pd-25 at% Ni-PdO ternary alloy with different initial concentrations of PdO, (a) the equilibrium surface concentration of Ni and PdO with temperature; (b) the kinetic surface concentration of Ni and PdO with time at T = 800 K
图6. Pd-25 at% Ni-PdO三元合金,在不同的PdO初始浓度下,(a) Ni和PdO平衡态表面偏析浓度随温度的变化;(b) T = 800 K时,Ni和PdO的表面浓度随时间的变化
3.6. Pd-Pt-PdO三元合金的表面偏析
对于PdPt二元合金,由图1
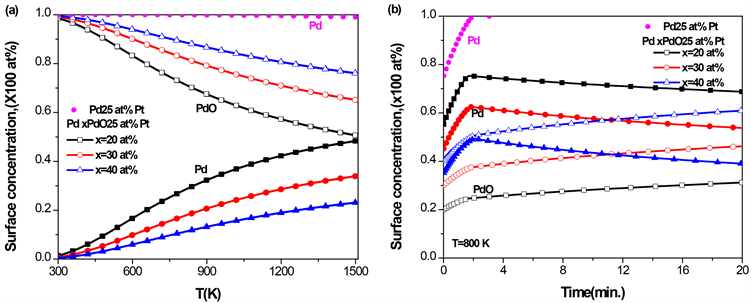
Figure 7. Pd-25 at% Pt-PdO ternary alloy with different initial concentrations of PdO, (a) the equilibrium surface concentration of Pd and PdO with temperature; (b) the kinetic surface concentration of Pd and PdO with time at T = 800 K
图7. Pd-25 at% Pt-PdO三元合金,在不同的PdO初始浓度下,(a) Pd和PdO平衡态表面偏析浓度随温度的变化;(b) T = 800 K时,Pd和PdO的表面浓度随时间的变化
的表面浓度逐渐上升,而PdO的表面浓度缓慢下降;PdO的体块浓度越高,则Pd表面浓度上升的速度越慢,PdO在表面的浓度越大。在相同温度下,由于PdO的表面偏析,Pd的表面浓度比在二元合金Pd-25 at% Pt (图中实心点)中低。由图7(b)可知,当温度
时,在PdPt二元合金中,在25 at% Pt的初始体块浓度下,Pd的平衡态的表面浓度达到100 at%;而在Pd-25 at% Pt-PdO的三元合金中,Pd平衡态的表面浓度低于80 at%,并且随着PdO浓度的增加,Pd平衡态的表面浓度降低,并与图7(a)平衡态的结果一致。此外由图7(b)可知,由于偏析原子的相互作用,开始时Pd快速偏析到合金表面,随后PdO偏析到表面,替代了偏析到表面的Pd,导致Pd的表面浓度出现先增加后降低。综上分析,PdO的存在抑制了Pd在PdPtPdO合金的表面偏析。
4. 总结
本文通过Darken模型预测二元Pd-X (X = Ag, Au, Cu, Ni, Pt)和Pd-X-PdO三元合金平衡态与动态的表面偏析现象,考虑氧化物对合金表面偏析的影响,从而更加准确地预测了合金在氧气环境下可能的偏析现象。计算结果表明:在PdAg、PdAu、PdCu和PdNi二元合金中偏析原子是溶质原子(Ag, Au, Cu, Ni),而在PdPt合金中偏析原子是Pd。对于PdAg二元合金,PdO的存在促进了Ag在PdAgPdO合金的表面偏析。在PdCu二元合金中,当温度T < 850 K,x > 30 at%时,PdO的存在促进了Cu在PdCuPdO合金的表面偏析,35 at% PdO的促进作用最强;当温度T > 850 K,PdO的存在抑制了Cu在PdCuPdO合金的偏析。而其他合金PdO的存在会抑制偏析元素(Au, Ni, Pd)在Pd-X (Au, Ni, Pd)二元合金的表面偏析。该模型提供了一种简便、准确的方法来预测氧化物对合金表面偏析的影响。
基金项目
感谢广东省普通高校青年创新人才项目(2018KQNCX078)的支持。
NOTES
*通讯作者。