1. 引言
我国锌资源丰富,多年来锌的产量一直位居世界首位。我国电解锌生产多以闪锌矿为原料,因矿中所含铁在酸解浸取时也会溶出进入溶液中,在后序除铁工序,经氧化中和沉淀去除 [1]。目前我国主流的除铁方法主要有黄钾铁矾法、针铁矿法两种 [2],无论哪种方法,每吨产品将产生铁渣0.3~0.6吨,因铁渣的比表面积较大,表面会吸附硫酸锌,因限于水平衡,吸附态硫酸锌无法全部洗去,另外,在调pH时也会产生枸溶性的碱式硫酸锌 [3],经检测,铁渣中水溶性锌和枸溶锌约10%~15%,还有少量镉、铅和铜等有害元素。以前,铁渣并不单独分离出来,这就使得整个浸出渣按照我国标准HJT299-2007对铁渣进行浸出,按照GB5085.3-2007进行鉴别,都属于危险固废。随着环保要求的提高,开始把铁渣分离出来,外卖给火法提锌企业,但现在火法提锌企业已被大量关停,加上危废跨境运输从严管理,铁渣已成制约冶锌企业的重要问题。
含锌废渣资源化回收技术已有一些报导,如王福生等 [4] 以及姚芝茂等 [5] 进行了锌回收分析与评价,闵小波等 [6] 的以硫酸作为浸出剂,以硫酸肼作为还原剂的还原酸浸法,可需要还原剂,成本较高;张亚平等 [7] 的以氢氧化钠溶液作为浸出剂,以铁粉为还原剂的还原碱浸法,不仅需还原剂,还需要在高压下进行,成本亦很高;王江伟等 [8] 采用添加碳酸氢铵的氨水作为浸取剂的氨浸取法,浸出选择性好浸出率高,但需要配套活性氧化锌生产装置,适应性不好,同时氨易外泄影响生产环境。本文以湘西泸溪县某冶锌企业的铁渣为原料,采用乙二胺四乙酸盐(EDTA)浸取锌,并用硫化氢沉淀锌,实现EDTA循环利用,利用冶锌企业自有的阳极液酸解硫化锌使硫化氢循环,从而实现废物的二次利用。
2. 实验部分
2.1. 实验材料与仪器
实验材料与试剂:含锌铁渣来源于湘西自治州泸溪县某冶锌厂,呈棕褐色块状,含水率为36.7%,干基含锌13.61%。将铁渣原料置于鼓风干燥箱中于105℃下烘干至恒重,经研磨粉碎过100目后,存放于干燥器内备用;闪锌矿、熟石灰、电解阳极液(含硫酸150 g/L)取自同一企业。乙二胺四乙酸二钠(EDTA二钠盐)、乙酸钠、冰乙酸、二甲酚橙、盐酸、硝酸等试剂均为分析纯。
实验仪器:D/max-γA型X-射线衍射仪(日本Rigaku公司);iCAP6300型电感耦合等离子体发射光谱仪(ThermoFisher Scientific, USA);S2400-N型热重-差热分析仪(美国Mettler-Toledo公司);GZX-9070 MBE型数显鼓风干燥箱(上海博讯实业有限公司);NHWY-100D型台式恒温摇床(常州诺基仪器有限公司);FA2104N型电子分析天平(上海民桥精密科学仪器有限公司);PHS-3C型pH计(上海精密仪器有限公司)。
2.2. 实验方法
本文采用EDTA为浸取剂对冶锌铁渣中锌进行选择性浸取,简称EDTA浸取法。辅以硫化氢沉淀锌使EDTA循环和酸解回收锌及使硫化氢循环,形成从铁渣中回收锌的工艺,流程见图1。主要工序有三道,即浸取、沉淀和酸解,EDTA水溶液用熟石灰调pH后加入铁渣,进行选择性浸取,这道工序是整个工艺的关键。第二道是用硫化氢沉淀,让锌转化为硫化锌,使EDTA游历出来进而循环使用。第三道是用含酸的阳极液分解硫化锌,生成的硫化氢再用于沉淀锌。
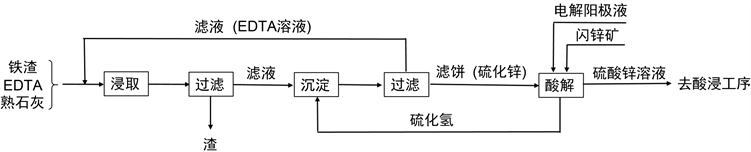
Figure 1. Technological process of recovering zinc from iron slag
图1. 冶锌铁渣回收锌的工艺流程
2.2.1. EDTA浓度对浸取率及选择性的影响
取250 mL的锥形瓶,分别加入0.1、0.2、0.3和0.4 mol/L的EDTA二钠盐水溶液120 mL,用熟石灰调pH值至9,并在另一个250 mL的锥形瓶中加入120 mL水做对照,再分别放入20 g干燥后的铁渣原料粉末,置于温度为40℃的恒温摇床里反应浸取2 h。浸取完成后过滤并用60 mL去离子水分3次洗涤,合并滤液和洗涤液,并量取体积。取样测定其中锌、钙和铁元素的含量。并对浸取前后的渣用XRD扫描,根据MDI Jade6.5中的标准卡片对照进行物相分析,采用S3400-N型扫描电子显微镜(日本日立高新技术公司)进行外形分析比较。
2.2.2. 浸取液初始pH对浸出率及选择性的影响
取多份120 mL浓度为0.4 mol/L的EDTA二钠盐水溶液,分别置于250 mL的锥形瓶中,然后用熟石灰分别调pH为5、6、7、8、9和10。再加入20 g干燥后的铁渣原料粉末,置于温度为40℃的恒温摇床里反应浸取2 h。浸取完成后过滤并用60 mL去离子水分3次洗涤,合并滤液和洗涤液,并量取体积,然后取样测定其中锌、钙和铁元素的含量。
2.2.3. 正交实验优化实验
根据经验与初步实验得知,影响浸出率的主要因素有浸出温度、浸出时间、液固比、浸出剂浓度等,因此分别以温度(A)、时间(B)、液固比(C)以及EDTA浓度(D)为考察因素,每个因素各选择3个考察水平,每份试验铁渣原料用量为20 g,浸取液调pH到9,选用L9(34)正交表安排试验,因素水平见表1。浸取完成后过滤并用60 mL去离子水分3次洗涤,合并滤液和洗涤液,并量取体积,取样测定其中锌的含量,计算锌的浸出率(以质量百分比表示)。

Table 1. Factors of the test for leaching zinc from iron-zinc slag by orthogonal experiment
表1. 正交实验浸取铁渣中锌因素水平表
2.2.4. EDTA与H2S的循环实验
取浸出实验所得浸出液100 mL放入250 mL的锥形瓶中,再加适量硫化锌(闪锌矿或实验所产硫化锌),放入具塞锥形瓶中,加入电解阳极液,并鼓入空气,产生的硫化氢引入盛有浸取液的锥形瓶中沉淀锌,当锌沉淀完成后停止,过滤,滤渣为硫化锌,用于下次产生硫化氢,滤液为EDTA溶液,循环用于浸取。
3. 结果与讨论
3.1. EDTA浓度对浸取率及选择性的影响
从原铁渣、水浸铁渣及EDTA浸取后铁渣的XRD图谱(图2)可见,铁渣中锌是以硫酸锌和碱式硫酸锌两种形式存在,水浸时只能溶出硫酸锌,而不能使碱式硫酸锌浸出,而用EDTA浸取,可把锌全部浸出。EDTA的配合能力很强,能与许多金属离子配合,铁渣中含量大的金属主要是锌、铁和钙,在考虑选择性时只需考察这三种离子。
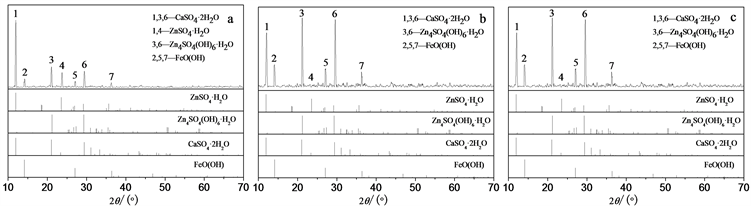 注:a:原铁渣;b:水浸铁渣;c:EDTA浸取铁渣
注:a:原铁渣;b:水浸铁渣;c:EDTA浸取铁渣
Figure 2. XRD patterns of iron-zinc slag leached by different methods
图2. 铁渣浸取前后的XRD图谱
不同EDTA浓度浸取时锌、铁、钙离子浸出量见表2。从表2可见,当EDTA浓度较小时,只有锌浸出,铁和钙基本不进入液相,当EDTA达0.4 mol/L时,锌几乎全部浸出,且有铁浸出而钙几乎不进入液相。从铁渣含锌13.61%可知,20 g铁渣中含锌0.042 mol,可见,EDTA浸取时有较好的选择性,优先选择浸出锌,只有当EDTA与锌配位过量后,才会浸出铁。

Table 2. Effect of EDTA concentration on the extraction amount of zinc, iron and calcium
表2. EDTA浓度对锌、铁、钙离子浸出量的影响
从铁渣浸取前、水浸后以及EDTA充分浸取后的铁渣化学组成见表3。经EDTA浸取后,铁渣中Zn的含量仅为0.075% (质量比),绝大部分Zn被浸出进入液相,Fe仅有少量浸出,而钙几乎不被浸出。

Table 3. Main chemical compositions of iron slag by pre/post-leaching
表3. 铁渣浸取前后主要元素的质量分数(%)
浸取前后的扫描电镜结果如图3所示。从图3可见,EDTA浸取时不破坏铁渣的晶型结构,有利于过滤。

Figure 3. The scanning electron micrographs of iron slag (a) and leaching residue (b)
图3. 原料铁渣(a)与EDTA浸出渣(b)扫描电镜图
3.2. 浸取液初始pH对浸出率及选择性的影响
浸取液初始pH对锌浸出率及选择性的影响见表4,从表4可见,不同初始pH条件下锌基本都能完全浸出,不随pH而变;而随着pH值的增大,铁的浸出量逐渐减小,pH到9时钙开始有浸出,之后钙讯速增大而铁不再进入液相。这与EDTA和金属离子的配位反应有关 [9],可认为EDTA首先与水溶性锌反应,反应式(以Y代表EDTA):
(1)
生成的氢离子再与碱式硫酸锌及羟基氧化铁反应,使它们进入溶液,进而与EDTA配位,反应式:
(2)
(3)
(4)
因氢氧化铁的溶度积远小于氢氧化锌的溶度积,故生成的氢离子会优先与Zn4SO4(OH)6反应,只有当Zn4SO4(OH)6反应完了后才会与FeO(OH)反应。而EDTA在不同的pH时主要存在形式不同,pH为5时,主要存在形式为H2Y2−,随着pH的增大,主要存在形式由H2Y2−逐渐转变为HY3−,pH到9时HY3−比例达最大,再增大pH值,则开始转变为Y4−。可见,随着初始pH值的增大,反应中生成的氢离子会减少,当少到生成的氢离子不足以完全溶解Zn4SO4(OH)6时EDTA也可直接与Zn4SO4(OH)6反应。此时,与锌配位后过量的EDTA也会与其它金属离子配位,因氢氧化铁的溶度积(4 × 10−38)远远小于硫酸钙的溶度积(9.1 × 10−6),在碱性时过量的EDTA只会与硫酸钙反应而使钙进入溶液中,而不会浸出铁,这就是pH高于9后,钙能进入溶液而铁不再溶出的原因。从反应式(1)和(2)可见,能使钙溶出的浸取液初始pH值与渣中水溶性锌与碱式硫酸锌的比例有关,因此,适合的浸取液初始pH值决定于原料,此实验适合的初始pH为9到10。

Table 4. Effect of pH on leaching rate and selectivity of zinc from iron slag
表4. 浸取液初始pH对浸出率及选择性的影响
3.3. 正交实验优化
以铁渣中锌的提取率为指标,用直观分析法对试验结果进行分析,实验结果及数据处理见表5。由表5可知,各因素对结果影响的显著性次序为D > C > B > A,可见,EDTA浓度和液固比对浸取有显著影响,生产中需严格控制。最优浸取条件为:温度60℃,固液比6 L/kg,EDTA浓度为0.4 mol/L,浸取时间2 h。最优条件在正交表中没有出现,用最优条件对铁渣进行浸取,锌的浸出率为99.81%,与正交表中出现的在温度20℃,固液比6 L/kg,EDTA浓度为0.4 mol/L,浸取时间2 h条件下的结果(99.77%)相比提高不明显,而提高温度不仅增加设备还要消耗能源,故而在实际生产中可采用常温浸取。

Table 5. Effect of different leaching conditions on zinc extraction by EDTA method
表5. 不同条件对EDTA浸锌率的影响
3.4. EDTA与H2S的循环
实验表明,浸出液中通入硫化氢,可很好的使锌沉淀,见反应式:
(5)
这也可根据质量作用定律 [10] 计算得出,由文献 [11] 查得氢硫酸的离解常数、EDTA的离解常数、EDTA与锌的稳定常数、硫化锌溶度积,代入热力学计算式有:
可见,平衡常数较大,可较好的使锌沉淀为硫化锌。通过用阳极液酸解硫化锌,产生的硫化氢沉淀锌生成硫化锌,从而实现EDTA的循环和硫化氢的循环。
4. 结论
EDTA是很好的选择性浸取锌的浸取剂,浸取时要根据原料中水溶性锌和酸溶性锌的比例调节浸取液的初始pH值。通过正交实验优化显示EDTA的浓度和液固比对浸取影响高度显著,浸取时间对结果有一定的影响,浸取温度对结果影响较小,研究所得最佳浸取条件为EDTA浓度为0.4 mol/L、温度为20℃,固液比6 L/kg的条件下反应2 h,此时,锌的浸出率为99.77%。
基金项目
锰锌矿业重金属污染综合防治技术湖南省工程实验室开放项目(MXKF201906)。
NOTES
*通讯作者。