1. 引言
关节软骨由软骨细胞、II型胶原和蛋白多糖组成,是覆盖关节腔滑膜关节骨端的透明软骨 [1]。健康的关节软骨具有优越的生物力学性能,在关节间起缓冲作用,分担机体的负荷 [2]。因此,软骨的完整性在促进身体运动方面起着至关重要的作用。然而,成人关节软骨比较脆弱,缺乏血管和血供,软骨细胞分布稀疏。因此,关节软骨一旦发生损伤是很难实现自我修复的 [3]。
但是关节软骨损伤却是骨科临床工作中经常会遇到的一种关节损伤类型。创伤、退变、肿瘤等多种原因都可以造成关节软骨损伤。同样这种损伤不仅会对关节软骨造成损伤,还常常伴有关节下骨的损伤,进一步可发展为骨关节炎,不仅会对病人及社会带来沉重的负担,也会造成患者生活质量的降低,影响患者的日常生活,也为临床工作的开展造成了一定的困难。目前对于关节软骨损伤临床上主要应用的修复方法有,软骨钻磨、骨膜和软骨膜移植、人工关节置换等技术 [4]。软骨钻磨技术主要是通过破坏钙化软骨层结构,来使位于软骨下骨中的骨髓间充质干细胞移行至软骨损伤区域,从而形成血凝块,骨髓间充质干细胞在血凝块中增殖分化形成纤维软骨,但是由于纤维软骨在各项性能上远逊于透明软骨,故其远期疗效欠佳。自体骨膜、软骨膜移植,不仅会造成供体区病损,而且由于供体区来源有限,对于较大的软骨缺损无法完成修补。异体骨膜、软骨膜移植则存在着供体来源寻找困难,疾病传播性高及易发生免疫排斥反应等缺点。人工关节置换适用于大面积软骨缺损,继发严重骨性关节炎的患者,这种手术会去除患者关节处的软骨,对患者造成创伤极大,并且会面临多种术后并发症。综上所述,这些方法可以一定程度上解决关节缺损的问题,但都存在较大的缺陷。
组织工程学是一种将生命科学与工程学有机结合的新技术。其目的是修复及再生组织。近年来组织工程技术在多个领域蓬勃发展,并获得了优秀的成绩。特别是软骨组织工程的迅速发展,为软骨及软骨下骨损伤的修复和再生提供了巨大的希望。关节软骨组织工程的工艺过程通常包括三个步骤:1) 体外培养、扩增治疗细胞;2) 在不同生长因子加载的三维支架中培养,形成细胞支架结构;3) 随后将构建物植入体内组织缺损中,随着原位新软骨的形成,支架逐渐降解 [5]。作为其中关键要素的支架,在关节软骨组织工程中起到了至关重要的作用。
传统的软骨组织工程修复关节软骨缺损,是在生物支架上种植软骨细胞,一方面细胞的种植率较低;另一方面,从修复的角度来看,软骨损伤通常伴随软骨下骨的损伤,单纯的运用软骨细胞修复软骨而忽略了软骨下骨的修复,其修复效率有限 [6]。而复合支架是通过各种物理化学的方法将许多原材料混合,相互弥补不足,形成最大限度地满足临床和组织工程的要求的支架,可以提高关节软骨损伤的修复程度 [7]。
构建关节软骨复合支架的难点在于如何选择合适的材料。关节软骨支架材料要满足以下三点要求:1) 支架材料不会导致机体发生免疫及炎症反应;2) 需要其具有无毒性及良好的生物相容性;3) 支架材料的降解性能及孔隙率等特性。
软骨组织工程的支架材料可以根据来源分为以下两大类:天然聚合物和合成聚合物。天然材料由于其良好的生物相容性、无毒性以及合适的降解速率而被广泛用于软骨组织工程 [8]。海藻酸盐是一种天然衍生的线性多糖,含有不同数量的(1-4)-连接-D-甘露醛酸和-L-古龙醛 [9]。酸海藻酸钠作为美国食品和药物管理局(FDA)批准的聚合物,已成为最重要的生物材料之一 [10]。海藻酸钠具有生物相容性好、毒性低、成本低、来源广等特点,已被广泛应用于各种生物医学领域 [11]。近年来多项研究表明海藻酸钠水凝胶在软骨组织工程方面发挥了不俗的表现 [12] [13]。Focaroli等人通过海藻酸钠与钙离子交联研制了一种可注射的海藻酸钠凝胶,这种海藻酸钠凝胶不仅能很好地适应软骨缺损,而且能促进新软骨与软骨组织的融合 [14]。医用可吸收明胶海绵作为如今医学常见的止血材料已经被广泛应用。医用明胶海绵的主要成分为明胶。明胶是胶原部分水解后的产物。胶原分子是一种通过三条多肽链互相缠绕形成的螺旋体结构,通过处理,胶原螺旋体可以发生变性,并会分解成由单条多肽链(α链)组成的α-组分、由两条α链组成的β-组分及由三条α链组成的γ-组分,以及小于α-组分或大于γ-组分的分子链碎片 [15]。医用明胶海绵作为医学临床工作常用的止血材料,其生物相容性无毒性、低免疫性及可降解性毋庸置疑。明胶海绵不仅能促进成骨细胞的黏附和增殖,还能促进细胞外基质的分泌 [16]。有研究表明在体外培养2周后,将明胶海绵骨细胞构建物移植到8例膝关节损伤骨缺损上。关节镜观察显示所有患者的关节下骨缺损都得到了修复 [17]。
如何将两种材料有机的结合到一起是下一步要解决的问题。海藻酸钠有一种特性是可以与不同二价金属离子如Ca2+、Mg2+交联 [18] [19]。由于海藻酸钠溶液可以与Ca2+交联形成海藻酸钠水凝胶,我们可利用海藻酸钠的这一特性来构建复合支架:首先先在明胶海绵支架上种植成骨细胞,在体外培养一段时间后,待成骨细胞粘附在三维支架上后,向明胶海绵支架中滴入CaCl2溶液,再在明胶海绵支架上滴上含有软骨细胞的海藻酸钠溶液,然后利用CaCl2溶液与含软骨细胞的海藻酸钠溶液交联,这样就会在明胶海绵支架上形成海藻酸钠水凝胶,从而形成明胶海绵–海藻酸钠水凝胶复合支架。最近,有研究利用碳二亚胺化学和定向冷冻技术通过共价交联制备了海藻酸钠/胶原复合支架。通过这种方法,提高了支架的力学性能。在支架中加入II型胶原可促进人髌下脂肪垫基质细胞的增殖和软骨细胞外基质的生成 [20]。可见通过交联的方法将海藻酸钠与明胶海绵结合构建复合支架有一定可行性。
本研究是通过利用海藻酸钠可与Ca2+交联形成水凝胶的方法,使海藻酸钠水凝胶与明胶海绵结合形成复合支架,与以往构建复合支架相比,这种方法不需要粘合剂等措施,即可将两种支架组合在一起,更加简单方便。同时在复合支架的下层培养成骨细胞,上层培养软骨细胞,形成细胞、支架共培养系统,检测支架的生物相容性及其他理化性质,为后续动物实验打下基础,同时解决单纯的运用软骨细胞修复软骨损伤的局限性,为提高软骨损伤的修复找到一个更为科学有效的方法。
2. 材料与方法
2.1. 实验材料
2.1.1. 实验原材料
医用明胶海绵1块,由青岛大学附属医院提供。MC3T3-E1细胞,由青岛大学再生中心提供,新鲜猪膝关节,由青岛大学再生中心提供。海藻酸钠,由青岛大学再生中心提供。
2.1.2. 主要试剂
1) 高糖DMEM培养液:将高糖DMEM粉末1袋加入1 L容量大烧瓶,以超纯水注入至终体积1 L,搅拌均匀后分装至无菌盐水瓶,密封、高温灭菌后保存,并加入含有10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素备用。
2) PBS液配制:将PBS粉一袋加入1 L容量大烧瓶,以超纯水注入至终体积1 L,搅拌均匀后分装至无菌盐水瓶,密封、高温灭菌后保存。
3) 0.25%胰蛋白酶溶液(含有0.02% EDTA二钠):将胰蛋白酶溶解于PBS中并加入EDTA。
4) 诱导液:将DMEM (10%胎牛血清+1%青霉素/链霉素) 118.5 ml和240 ul地塞米松、120 ul VitC、1.2 ml β-磷酸甘油钠混合所得。
5) 2D培养基:DMEM添加20%胎牛血清,0.4 × 10−3 ml脯氨酸,0.1 × 10−3 ml非必需氨基酸,0.01mg 4-(2-羟乙基)-哌嗪1-乙基磺酸,0.05 mg/mL维生素C,100单位/mL青霉素和0.1 mg/mL链霉素。
6) 3D培养基:DMEM添加20%胎牛血清,0.4 × 10−3 ml脯氨酸,0.1 × 10−3 m非必需氨基酸,0.01 mg 4-(2-羟乙基)-哌嗪1-乙基磺酸,0.05 mg/mL维生素C,100单位/mL青霉素和0.1 mg/mL链霉素和含有10%胎牛血清的DMEM,其比率为1:2。
2.1.3. 主要仪器及实验物品
电子天平,奥豪斯仪器(上海)有限公司;恒温磁力搅拌器,上海司乐仪器有限公司;电热鼓风干燥箱,上海博迅医疗生物仪器股份有限公司;微量天平,上海舜宇恒平科学仪器有限公司;荧光显微镜,Nikon ECLIPSE Ti;微波炉,美的;无菌50 mL离心管;无菌15 mL离心管;24孔板;血球计数板;镊子;无菌吸水纸;无菌剪刀;全功能微孔板检测仪,美国伯腾仪器有限公司;高通量组织研磨器,宁波新芝生物科技股份有限公司;细胞筛,北京索莱宝科技有限公司。
磷酸盐缓冲液(PBS),以色列BI公司;DMEM高糖培养基,以色列BI公司;非必需氨基酸,大岛生物公司;青霉素,链霉素,美国Sigma公司;胎牛血清(FBS),以色列BI公司;胰蛋白酶,美国Gibco公司;乙二胺四乙酸二钠(EDTA二钠),北京索莱宝科技有限公司;琼脂糖粉末,广州赛国生物科技有限公司;碱性磷酸酶活性检测试剂盒,上海翊圣生物科技有限公司;RIPA裂解液,北京索莱宝科技有限公司;糖胺多糖检测试剂盒,上海一研生物科技有限公司。
2.2. 实验方法
2.2.1. 明胶海绵支架制备
准备适量明胶海绵,在超净台下使用灭菌后的手术刀或剪刀将明胶海绵切成0.5 cm × 0.5 cm × 0.5 cm小块,共40块,放置于干净培养皿中,紫外灯照射约5小时。
2.2.2. 消化MC3T3-E1细胞
1) 取MC3T3-E1细胞(在DMEM含10%胎牛血清+1%青霉素/链霉素中培养)于超净台下分别使用吸管吸除培养基。
2) 使用吸管吸取PBS约3 ml加入到每个培养皿中,前后震荡几次,吸除PBS。
3) 吸取胰蛋白酶约3 ml于每个培养皿中,放置37℃含5%的CO2培养箱中约4~5 min,取出培养皿,于光镜下观察确定。
4) 确认细胞已被胰酶消化下来(细胞由梭形变为椭圆形即为被胰酶消化下来,部分细胞可能与皿底粘附较紧,可适当震荡培养皿使细胞悬浮)。
5) 于含MC3T3-E1细胞的每个培养皿中加入DMEM (含10% FBS + 1% P/S培养基)约3 ml稀释胰酶,吸取细胞悬液置于离心管中。分别计算离心管中的细胞悬液体积。
6) 分别于光镜下在计数板中计算每ml细胞悬液中消化MC3T3-E1细胞密度,计算离心管中总的细胞数量。
2.2.3. 向明胶海绵支架上种植细胞
1) 将含MC3T3-E1细胞悬液在37℃下于离心机1000 rmp离心5 min,倒掉上清液。
2) 向含MC3T3-E1细胞离心管中加入DMEM (10%胎牛血清+1%青霉素/链霉素)将细胞密度浓缩为5 × 106/ml,吹打混匀,将细胞悬液平均加到之前紫外照射过的40块明胶海绵上,可用枪头挤压海绵,使海绵充分吸收细胞悬液,将含有细胞悬液的明胶海绵放到37℃含5%的CO2培养箱约30 min,后取出备用。
3) 配置1%琼脂糖溶液,取4块12孔板,每孔加入1 ml琼脂糖溶液,待其充分凝固后,每孔加入DMEM含10% FBS + 1% P/S培养基3 ml,用灭菌过的镊子夹取含有细胞悬液的明胶海绵放入(1个/孔),后放入37℃含5%的CO₂培养箱中培养。
4) 增殖细胞:培养前3天,不进行处理使细胞充分增殖。
2.2.4. 诱导MC3T3-E1细胞分化
1) 培养3天后,即第4天,配置诱导液,对培养的细胞进行诱导分化。
2) 诱导7天即培养第10天停止诱导。
2.2.5. 提取猪软骨细胞
1) 从5月龄猪新鲜关节获得的软骨组织被切成块(1 mm3)。
2) 将切成块的软骨组织在胶原酶溶液(1.5 mg/mL)中消化。
3) 将消化后的软骨组织培养在含10%胎牛血清(FBS)的II型胶原酶改良Eagle培养基(DMEM)中,并放在37℃含5%的CO2培养箱中培养。
4) 将细胞悬浮液通过一个70微米的细胞过滤器过滤。
5) 然后将软骨细胞离心和再悬浮后,在2D培养基中培养软骨细胞。
6) 然后将悬浮液接种在培养皿中(细胞密度:3 × 104/cm²)在37℃含5%的CO2培养箱中培养。
2.2.6. 消化猪软骨细胞
1) 取猪软骨细胞(2D培养基培养)于超净台下分别使用吸管吸除培养基。
2) 使用吸管吸取PBS约3 ml加入到每个培养皿中,前后震荡几次,吸除PBS。
3) 吸取胰酶约3 ml于每个培养皿中,放置37℃含5%的CO2培养箱中约4~5 min,取出培养皿,于光镜下观察确定。
4) 细胞被胰酶消化下来(细胞由梭形变为椭圆形即为被胰酶消化下来,部分细胞可能与皿底粘附较紧,可适当震荡培养皿使细胞悬浮)。
5) 于含猪软骨细胞每个培养皿中加入DMEM含10% FBS + 1% P/S培养基约3 ml稀释胰酶,吸取细胞悬液置于离心管中。分别计算离心管中的细胞悬液体积。
6) 分别于光镜下在计数板中计算每ml细胞悬液中消化猪软骨细胞密度,计算离心管中总的细胞数量。
2.2.7. 构建复合支架
1) 取将含猪软骨细胞悬液在37℃下于离心机1000 rmp离心5 min,倒掉上清液。
2) 向含MC3T3-E1细胞离心管中加入灭菌后的海藻酸钠溶液将细胞密度浓缩为10 × 106/ml,吹打混匀。
3) 取20块含MC3T3-E1的明胶海绵(剩余20块含MC3T3的明胶海绵作为对照),用1 ml移液枪吸取多余的培养基,每个加入适量配置好的100 mmol/L CaCl2溶液(加入适量即可,避免明胶海绵过湿),后向明胶海绵加入含软骨细胞的海藻酸钠溶液,约100 ul/个,再向明胶海绵上滴加适量的100 mmol/L CaCl2溶液,待凝胶凝固后,将明胶海绵-海藻酸钠凝胶复合体重新放入培养基中,后更换培养基为3D培养基,放入37℃含5%的CO2培养箱培养。
4) 取1个96孔板,向其中20个孔洞内加入含软骨细胞的海藻酸钠溶液每个孔洞约50 ul,后加入100 mmol/L CaCl2溶液20 ul,盖上盖子,放入4℃冰箱放置10 min,待凝胶凝固,取出凝胶放入2块含3D培养基12孔板中,放入37℃含5%的CO2培养箱中培养作为对照。
3. 检测
3.1. 与MC3T3-E1细胞共培养明胶海绵支架活/死细胞检测
1) 培养不同时间间隔(3天、10天)后,在超净台中取与MC3T3-E1共培养的明胶海绵支架于干净的培养皿,用灭菌后的手术刀切除一薄片,余支架放回培养皿中继续培养。
2) 向切成薄片的支架加PBS约500 ul,然后加入0.5 ulcal (钙黄绿素-AM)、1 ulpI (碘化丙啶),在黑暗条件下放入37℃含5%的CO2培养箱中30分钟。
3) 使用PBS冲洗2~3次,5 min/次。
4) 在表面荧光显微镜下观察(期间注意避光)。
3.2. 复合支架活/死细胞染色
1) 培养不同时间间隔(20天、30天,此天数是从构建底层支架算起)后,取复合支架于干净的培养皿,用灭菌后的手术刀切除一薄片,余支架放回培养皿中继续培养。
2) 向切成薄片的支架加PBS约500 ul,然后加入0.5 ulcal (钙黄绿素-AM)、1 ulpI (碘化丙啶),在黑暗条件下放入37℃含5%的CO2培养箱中培养30分钟。
3) 使用PBS冲洗2~3次,5 min/次。
4) 在表面荧光显微镜下观察(期间注意避光)。
3.3. 碱性磷酸酶(ALP)检测
1) 冷却至室温备用所需要的试剂。
2) 配制显色底物溶液:取出显色底物粉末,向粉末中加入2.5 mL ALP反应缓冲液至粉末完全溶解,将溶液充分混匀,在冰上放置备用(现用现配,配制后6 h之内使用)。
3) 准备标准品工作液:将浓度为10 mmol/L的标准品溶液10 μL,加入到ALP反应缓冲液直到0.2 mL (标准品工作液浓度为0.5 mmol/L)。
4) 制备裂解液:首先用RIPA裂解液裂解含细胞的支架材料,然后用高通量研磨器研磨至呈匀浆状,在用离心机离心并取上清液。
5) 样品稀释:若待检测样品中的碱性磷酸酶活性较高,可以使用以下方式进行稀释:a) RIPA裂解液;b) 磷酸盐缓冲液;c) 试剂盒中的ALP反应缓冲液。
6) 检测板中空白对照孔、标准品孔及待检测样品孔的设计可以参考下表1。标准品的用量可设置为4 μL、8 μL、16 μL、24 μL、32 μL和40 μL,待检测样品适当稀释后加50 μL。
7) 混匀:使用移液枪头轻轻吹打混匀,并用低速离心壁上液体。
8) 孵育:37℃条件下温育5~10 min。(若样品中碱性磷酸酶活性较低时,可以延长孵育时间至30 min)
9) 终止:向每孔中加入100 μL反应终止液。因ALP活性不同会导致标准品孔和有碱性磷酸酶活性的孔显示出有不同深浅的黄色。
10) 检测:在405 nm波长处测定各孔吸光度值,显示出来的黄色在会在6个小时内稳定。
11) 计算个样品ALP含量,作柱状图。

Table 1. Data sheet of each component sampling
表1. 各组分加样数据表
3.4. 糖胺多糖检测
1) 甲酸缓冲液配制:4 g甲酸钠、4 ml甲酸,去离子水补足至1 L,封闭储存。
2) DMB试剂配制:将DMB粉末80 mg加入12 ml乙醇,完全溶解后,加488 ml甲酸缓冲液,避光室温保存。
3) 裂解液配制:PBS配制后调pH值至6.4后,加入400 mg乙酸钠,200 mg EDTA二钠盐和40 mg半胱氨酸盐酸盐,4℃保存;使用裂解液时加入木瓜蛋白酶,现用现配。
4) 解离液配制:将0.2 g SDS粉末加入到100 ml去离子水中。
5) 硫酸软骨素标准品配制:称取1 g硫酸软骨素,溶于100 ml PBS中,同时加入0.005%的叠氮钠,得到10 mg/ml储存液;并将软骨素标准品稀释成1 mg/ml备用。
6) 裂解、研磨:将含细胞的支架材料中加入裂解液进行裂解(裂解为在冰上进行超声裂解),然后用高通量研磨器研磨至呈匀浆状,在用离心机离心(高速离心具体为高速12,000 g离心10~15 min)并取上清液。
7) 混匀:吸取上清100 μl,加入1 ml DMB试剂,室温下摇动,使糖胺多糖和DMB充分结合。
8) 解离:高速离心(高速离心具体为高速12,000 g离心30 min),沉淀糖胺多糖和DMB的结合体,加入解离液,室温放置10 min使DMB从糖胺多糖上解离出来。
9) 标准曲线制作:分别取5 ug、4 ug、3 ug、2 ug和1 ug的硫酸软骨素标准品,加入1 ml DMB试剂,室温下摇动;离心留沉淀,加解离液后,解离液完全解离DMB和糖胺多糖的结合体后,空白对照设置为解离液,于656 nm波长处测定吸光度值。
10) 计算实验组的糖胺多糖数值,统计分析。
3.5. 统计学分析
本实验应用GraphPad Prism7.00软件处理定量数据,实验数据以
表示,以P < 0.05表示差异具有统计学意义。应用双因素方差分析进行两组实验在不同时间点的比较,在相同时间点两组间的比较应用单因素方差分析,实验数据均进行方差齐性检验,两两比较采用Lsd-t检验。
4. 结果
4.1. 明胶海绵支架的活/死细胞染色
在体外增殖培养的第3天以及通过诱导剂诱导成骨培养的第10天,进行活/死细胞荧光染色检测以用来评估接种在明胶海绵支架上MC3T3-E1细胞的活力和形态。在该染色方法中,活细胞的细胞质呈绿色,染色结果如图1。MC3T3-E1附着于明胶海绵微孔中生长,可见随着时间逐渐延长,MC3T3-E1细胞不断增殖,并且细胞外基质(ECM)分泌逐渐增加,在第10天可以看到明胶海绵微孔中的MC3T3-E1相互连接,并且随着时间推移,明胶海绵表面上的MC3T3-E1细胞亦表现出显著增殖。
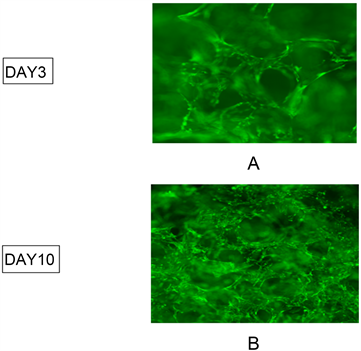 (A) MC3T3-E1在明胶海绵支架中增殖培养第3天,活/死细胞染色荧光纤维镜下图。放大100倍;(B) MC3T3-E1在明胶海绵支架中培养第10天,即诱导分化培养第7天,活/死细胞染色荧光纤维镜下图。放大100倍。
(A) MC3T3-E1在明胶海绵支架中增殖培养第3天,活/死细胞染色荧光纤维镜下图。放大100倍;(B) MC3T3-E1在明胶海绵支架中培养第10天,即诱导分化培养第7天,活/死细胞染色荧光纤维镜下图。放大100倍。
Figure 1. MC3T3-E1 on a gelatin sponge scaffold under a stained fluorescent fiberscope
图1. MC3T3-E1在明胶海绵支架上于荧光纤维镜下图
4.2. 明胶海绵海藻酸钠水凝胶复合支架的活/死细胞染色
在从构建底层支架算起进行体外增殖培养的第20天及30天,进行活/死细胞荧光染色检测以用来评估接种在复合支架上MC3T3-E1细胞和猪软骨细胞的活力和形态。在该染色方法中,活细胞的细胞质呈绿色,染色结果如图2。明胶海绵–海藻酸钠水凝胶构建复合体内胞活/死细胞染色结果如图2(C)。可见MC3T3-E1附着于明胶海绵微孔中生长,随着时间延长,MC3T3-E1细胞在明胶海绵表面及微孔内增殖良好,并且细胞外基质(ECM)分泌逐渐增加,猪软骨细胞也在海藻酸钠水凝胶中增殖良好,随时间延长细胞外基质(ECM)分泌逐渐增加。单纯海藻酸钠及明胶海绵支架组体内胞活/死细胞染色结果如图2(A)、图2(B)。与复合支架相比,随着时间推移,单纯海藻酸钠及明胶海绵支架组边缘细胞呈现明显的增殖趋势,然而,单纯海藻酸钠及明胶海绵支架组内部的细胞密度在20~30天内几乎保持不变。增殖培养第20天至第30天,在相同时点间,与单纯海藻酸钠及明胶海绵支架组相比,复合支架组观察到更高的细胞密度和细胞扩散比率。表明复合支架组可提供比单纯海藻酸钠及明胶海绵支架组更好的细胞增殖与培养环境。
4.3. 碱性磷酸酶(ALP)检测结果
碱性磷酸酶(ALP)的表达是评估MC3T3-E1早中期分化的重要标志物。分别检测复合支架和单纯明胶海绵支架中MC3T3-E1在总培养天数第10,20,及30天中碱性磷酸酶的活性,结果如图3。从图中可以看出实验组及对照组中的MC3T3-E1细胞的ALP活性在培养20天内均明显增加,并在20天达高峰,并会在第30天出现表达下降。然后除去养的第10天外,在第20及30天,可以看出在复合支架中的碱性磷酸酶活性均高于单纯明胶海绵支架组(P < 0.05)。
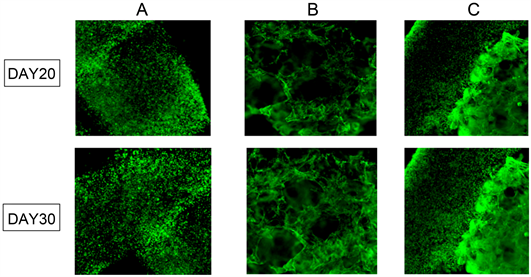 (A) 猪膝软骨细胞在单纯海藻酸钠水凝胶支架中增殖培养第10天和20天,即总培养过程的第20天和30天,活/死细胞染色荧光纤维镜下图。放大100倍;(B) M MC3T3-E1在明胶海绵支架中培养第20天和第30天,活/死细胞染色荧光纤维镜下图。放大100倍;(C) 两种细胞在复合支架中培养第10天和20天,即总培养过程的第20天和30天,活/死细胞染色荧光纤维镜下图。放大100倍。
(A) 猪膝软骨细胞在单纯海藻酸钠水凝胶支架中增殖培养第10天和20天,即总培养过程的第20天和30天,活/死细胞染色荧光纤维镜下图。放大100倍;(B) M MC3T3-E1在明胶海绵支架中培养第20天和第30天,活/死细胞染色荧光纤维镜下图。放大100倍;(C) 两种细胞在复合支架中培养第10天和20天,即总培养过程的第20天和30天,活/死细胞染色荧光纤维镜下图。放大100倍。
Figure 2. Cells in different scaffolds under the fluorescent fiberscope below
图2. 细胞在不同支架下于荧光纤维镜下图
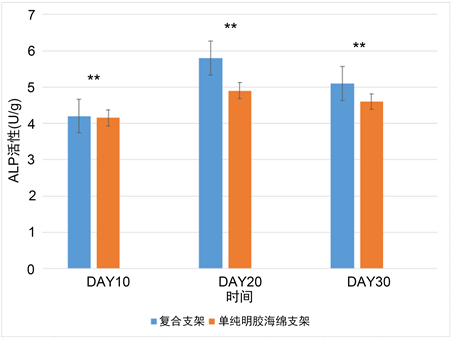 注:**表示有差异有统计学意义。
注:**表示有差异有统计学意义。
Figure 3. Alkaline phosphatase table test results
图3. 碱性磷酸酶表检测结果
4.4. 糖胺聚糖检测结果
糖胺聚糖是软骨细胞分泌的重要外基质之一。分别检测复合支架和单纯海藻酸钠支架中猪膝软骨细胞在培养的第10,20及30天中糖胺聚糖的含量,结果如图4。从图中可以看出实验组及对照组中的猪膝软骨细胞的糖胺聚糖的含量在培养30天内均明显增加,并在20天达高峰,30天糖胺聚糖的含量出现下降。然后除去培养的第10天外,在第20及30天,可以看出在复合支架中糖胺聚糖的含量的均高于单纯海藻酸钠支架组(P < 0.05)。
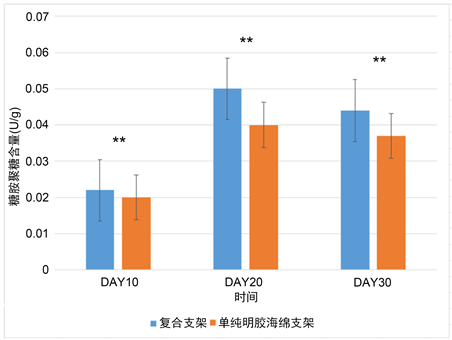 注:**表示有差异有统计学意义。
注:**表示有差异有统计学意义。
Figure 4. Test results of glycosaminoglycan content
图4. 糖胺聚糖含量检测结果
5. 结论
由于创伤、肿瘤等不同原因引起的关节软骨损伤及由其随后带来的骨性关节炎不仅会给骨科临床工作带来困难,还会给患者带来身体上的痛苦,同时也会给国家社会经济带来负担。但是现今临床使用的外科技术的长期疗效不仅难以令人满意,还会给患者带来身体上的创伤。不过近年来软骨组织工程的高速发展带来了新的希望。传统的关节软骨组织工程技术修复关节软骨缺损,仅仅关注于软骨的修复而忽略了软骨下骨的修复,关节软骨下骨的损伤在关节软骨损伤中常常出现,所以在关节软骨损伤修复中同时修复关节软骨下骨的修复也至关重要。所以本研究设想能否构建一种复合支架,在支架上层种植软骨细胞,支架下层种植成骨细胞,然后将种植了细胞的组织工程复合支架在体外培养,这样分别在上层培养软骨、下层培养骨,通过这种方式可以在修复关节软骨的同时,也可以兼顾软骨下骨的修复。同时将软骨–骨修复面转换为软骨–软骨、骨–骨修复面,增加了修复效率。
本研究利用医用明胶海绵构建下层支架,其优势在于医用明胶海绵已在临床工作中广泛应用,其生物相容性、无毒性、低免疫性及可降解性毋庸置疑,并且医用明胶海绵拥有丰富的三维孔径结构,可以给予成骨细胞广泛的粘附增殖空间。其次实验结果显示MC3T3-E1附着于明胶海绵微孔中生长,可见随着时间逐渐延长,MC3T3-E1细胞不断增殖,并且细胞外基质(ECM)分泌逐渐增加,在第10天可以看到明胶海绵微孔中的MC3T3-E1相互连接。利用海藻酸钠水凝胶构建上层支架。海藻酸钠是一种很有前途的软骨组织工程支架材料,除了具有良好的生物相容性和低成本外,还具有易交联的特点 [20]。特别是容易与二价金属离子,如钙、镁离子交联。由于海藻酸钠溶液可以与Ca2+交联形成海藻酸钠水凝胶,所以可利用海藻酸钠的这一特性来构建复合支架,首先先在明胶海绵支架上种植成骨细胞,在体外培养一段时间后,待成骨细胞粘附在三维支架上后,然后将CaCl₂溶液滴在明胶海绵支架上,再在明胶海绵支架上滴上含有软骨细胞的海藻酸钠溶液,然后利用CaCl₂溶液与含软骨细胞的海藻酸钠溶液交联,这样就会在明胶海绵支架上形成海藻酸钠水凝胶,从而形成明胶海绵–海藻酸钠水凝胶复合支架。通过体外培养,MC3T3-E1附着于明胶海绵微孔中生长,随着时间延长,MC3T3-E1细胞在明胶海绵表面及微孔内增殖良好,并且细胞外基质(ECM)分泌逐渐增加,猪软骨细胞也在海藻酸钠水凝胶中增殖良好,随时间延长细胞外基质(ECM)分泌逐渐增加。并且与复合支架相比,随着时间推移,单纯海藻酸钠及明胶海绵支架组边缘细胞呈现明显的增殖趋势,然而,单纯海藻酸钠及明胶海绵支架组内部的细胞密度在20~30天内几乎保持不变。增殖培养第20天至第30天,在相同时点间,与单纯海藻酸钠及明胶海绵支架组相比,复合支架组观察到更高的细胞密度和细胞扩散比率。ALP广泛存在于人体骨骼中,成骨细胞中的ALP作用产生磷酸,与钙生成磷酸钙沉积于骨中,ALP是基质矿化的早期成骨标志物 [21]。在体外培养的第10,20,及30天检测碱性磷酸酶的活性,除去培养的第10天外,在第20及30天,可以看出在复合支架中的碱性磷酸酶活性均高于单纯明胶海绵支架组。糖胺聚糖是软骨细胞分泌的重要外基质之一。通过糖胺聚糖的表达情况可明确软骨细胞的生长情况。在体外培养的第10天、20及30天中检测糖胺聚糖的含量,除去培养的第10天外,在第20及30天,可以看出在复合支架中糖胺聚糖的含量的均高于单纯海藻酸钠支架组。
本研究通过化学交联的方法制备了一种以明胶海绵为底层支架并以海藻酸钠水凝胶为上层支架的关节软骨组织工程复合支架。通过一系列实验结果表明复合支架可以更好的促进MC3T3-E1细胞及猪膝软骨细胞在体外的增殖和分化。下一步将继续构建关节软骨缺损动物模型,并研究该复合支架在体内的作为关节软骨缺损修复材料的可行性,为临床关节软骨缺损的治疗提供实验依据。
NOTES
*通讯作者。