1. 前言
骨髓增生异常综合征(MDS)是一组起源于骨髓造血干细胞的异质性髓系克隆性疾病,临床表现为骨髓造血功能衰竭、无效造血、难治性血细胞减少,并有较高风险转化为急性髓系白血病(AML) [1]。近年来关于MDS发病机制的深入研究发现免疫失调与炎症反应可能参与了MDS的发病 [2] ,而基于免疫炎症反应的自身免疫性疾病(AIDs)与MDS的关系也引起了众多学者的关注。AIDs对MDS患者疾病临床特征及生存预后的影响目前仍存在争议。国外几个大型病例对照研究认为合并AIDs的MDS患者常拥有较好的基线特征及预后 [2] [3] [4] [5] [6] ,而国内几个小样本量案例报道则认为合并AIDs的MDS患者生存时间短、预后不佳 [7] [8] [9]。本研究中共纳入206例初治MDS患者(其中57例合并AIDs),通过回顾性分析比较合并AIDs组与不合并组的临床资料,探讨合并AIDs对于原发性MDS患者的临床特征及预后影响,以期为临床诊疗工作提供一定的参考。
2. 资料与方法
2.1. 病例
回顾性分析2013-1月至2019-12月青岛大学附属医院血液内科收治的206例初诊MDS患者的临床资料,其中男125例,女81例,平均年龄59.51 ± 13.35岁。根据是否合并自身免疫性疾病,分为合并自身免疫性疾病(AIDs)组(n = 57)和不合并组(n = 149)。所有合并AIDs患者均既往已确诊或相关免疫学检查已完善。相关免疫学检查包括可提取性抗原(ENA)抗体谱、抗核抗体(ANA)、类风湿因子RF、血沉、C反应蛋白、免疫球蛋白。自身免疫性疾病的诊断参照葛均波等主编的第8版《内科学》相关章节。MDS诊断按骨髓增生异常综合征中国诊断与治疗指南(2019年版)标准进行(或重新进行)诊断分型 [1]。
2.2. 纳入及排除标准
纳入标准:全部患者均符合骨髓增生异常综合征中国诊断与治疗指南(2019年版)最低诊断标准,且均为初诊、既往未接受化疗、免疫检查学完善。
排除标准:年龄 < 18岁、曾接受化疗、随访资料丢失、随访时间不足3个月的患者予以排除。
2.3. 收集指标及评估
收集患者的一般情况(年龄、性别),初诊时的实验室指标,包括:血常规、血沉、血清乳酸脱氢酶、骨髓原始细胞比例、骨髓增生程度及纤维化程度分级、染色体核型等指标,统计患者疾病分型分期、有无转白。分型分期参照2016年WHO分型、国际预后积分系统(IPSS)、WHO分型预后积分系统(WPSS)、修订的国际预后积分系统(IPSS-R)进行 [1]。
2.4. 随访
随访资料来源于住院和门诊病历,自明确诊断为MDS之日起随访,死亡病例随访至死亡时间,存活病例随访至2020年6月1日,统计患者的疾病进展生存时间(OS)、总体生存时间(PFS)等指标。
2.5. 统计学分析
采用SPSS 25.0统计软件进行统计学处理。计量资料的分布以均值或中位数表示,计量资料的比较采用t检验或Mann Whitney-U检验,分类变量比较采用卡方检验或秩和检验,Kaplan-Meier进行单因素生存分析,Log-rank做显著性检验,多因素分析采用COX回归模型。所有检验均为双侧检验,P < 0.05视为差异有统计学意义。
3. 结果
3.1. 合并AIDs患者特点
在全部206例MDS患者中,共57例(27.7%)合并AIDs (表1)。所有并发AIDs的MDS患者中,血管炎占比最多共11例(19.3%),其中包括小血管炎相关的白塞病8例、皮肤变应性血管炎2例、风湿性多肌痛1例;其次为类风湿性关节炎,约占12.3% (n = 7)。其他AIDs还包括甲状腺炎5例、系统性红斑狼疮4例、未分化结缔组织病4例、炎症性肠病4例、骨关节炎3例、干燥综合征3例、脊柱关节病2例、自身免疫性肝病2例、IgG4相关疾病1例、嗜中性粒细胞脓皮病1例。另有10例患者仅血清免疫学阳性而无相关临床表现。在本研究中,73%的血管炎为白塞病(n = 8/11),而8例白塞病患者中有6例伴有 + 8异常染色体核型。所有合并AIDs患者中,6例(10.5%)患者合并1种以上AIDs。
3.2. 两组间一般资料及其他特殊指标比较
合并AIDs组患者中女性36人(63.2%),男性21人(36.8%);不合并组女性45人(30.2%),男性104人(69.8%),合并AIDs组女性患者比例明显多于不合并组(p < 0.001,表3);血沉在合并AIDs组中为57.1 ± 4.9 mm/h,高于不合并组(38.7 ± 6.2 mm/h, p = 0.020),差异均具有统计学意义(表3)。两组患者在其他基本特征,如年龄、外周血全血细胞计数(血红蛋白、白细胞计数、中性粒细胞计数、血小板计数)、红细胞压积、平均红细胞体积、血清乳酸脱氢酶水平间无显著差异;两组间骨髓纤维化程度、染色体分级也无显著差异(p > 0.05,表3)。

Table 1. Prevalence of autoimmune diseases among MDS patients
表1. AIDs在MDS患者中的分布
3.3. 两组间转白率及转白时间比较
合并AIDs组患者共10例转化为急性白血病(AML) (n = 10/57),转白率为17.5%,而不合并组36例转白,转白率24.2% (n = 36/149, p = 0.204),两组间转白时间分别为12.8 (±3.4)个月对14.5 (±1.8)个月,但差异无统计学意义(表2)。

Table 2. Rate and time of two groups transformation into AML
表2. 两组患者转白率及转白时间比较
3.4. 两组患者诊断分型及预后分级比较
在2016年WHO分型中,合并AIDs组患者最常见类型为MDS伴多系血细胞发育异常(MDS-MLD型),占比达43.9%;不合并组患者则多为MDS伴多系血细胞发育异常(MDS-MLD型,34.9%)、MDS伴原始细胞增多(MDS-RAEB型,53.7%) (p = 0.003,表3)。在IPSS预后分级中,因极端值低危组及高危组患者数较少,故将低危、中危1合并为低风险组,中危2、高危患者合并为高风险组,分析显示合并AIDs患者低风险组比例明显偏高(70.2%),显著高于不合并组(55.1%,p = 0.046,表3,表4)。在WPSS预后分级及IPSS-R预后分级中两组间分布亦存在此种差异,但无统计学意义。

Table 3. Baseline characteristics of MDS patients with and without AIDs
表3. 合并AIDs组患者与不合并组的基线特征
*p值有统计学意义。
3.5. 合并AIDs患者与不合并组的生存分析
所有患者的中位随访时间为19.9个月(3~90个月)。用K-M曲线进行单因素分析发现,合并AIDs组患者的无疾病进展生存时间(PFS)为18.6个月(95%CI 4.6~32.6,图1),不合并组为12.4个月(95%CI 23.5~34.1; p = 0.010);合并AIDs组与不合并组的中位总生存时间(OS)分别为40个月(95%CI 3.6~76.4) vs 28.8个月(95%CI 9.2~15.6;p = 0.043,图2),即合并组PFS及OS值均优于不合并组。
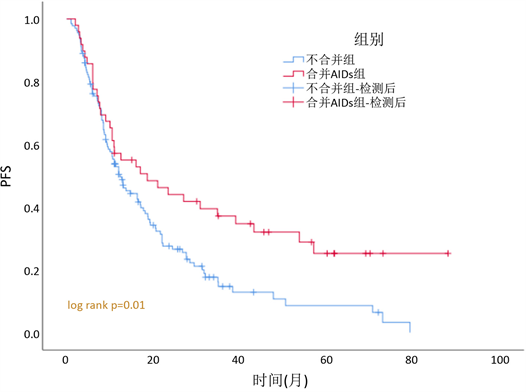
Figure 1. PFS among MDS patients with or without autoimmune disease
图1. 合并AIDs组与不合并组的无疾病进展生存(PFS)
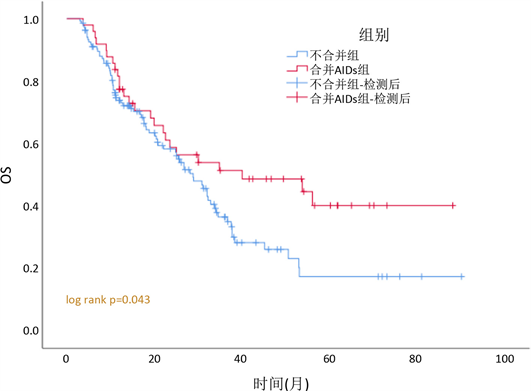
Figure 2. OS among MDS patients with or without autoimmune disease
图2. 合并AIDs组与不合并组的总体生存曲线(OS)
3.6. 调整IPSS分级后两组间分布及预后
对本研究调整后的IPSS预后分级进行生存分析,低风险组(低危、中危1)中,合并AIDs患者与不合并组的PFS分别为30.8 vs 16.5月(p = 0.011),两组OS分别为56.0 vs 32.8月(p = 0.139),而高风险组(中危2,高危)中两组间PFS、OS无显著差异(表4)。
Table4. Distribution and outcomes of two groups with adjusting IPSS
表4. 调整IPSS分级后合并AIDs组与不合并组患者的分布及预后
*p值有统计学意义。
3.7. 两组患者的多因素生存分析
对可能影响患者生存期的危险因素进行COX回归分析,包括年龄、性别、是否合并AIDs分组、2016 WHO分型、IPSS预后分级、染色体核型分级、转白率、输血依赖、骨髓纤维化程度,结果表明合并AIDs不是影响患者生存的独立危险因素(p = 0.350)。
4. 讨论
近年来临床研究发现,AIDs与MDS常同时或先后出现,两者间关系并非偶然。此前有文献报道AIDs患者出现MDS的概率明显增加 [2] [10] [11] [12]。来自瑞典中心的一项大型研究,对纳入的9219名AML患者、1662名MDS患者和42,878名对照者进行分析,发现既往有慢性免疫炎症病史的患者发生AML风险增加1.7倍(95% CI, 1.5~1.9),MDS风险增加2.1倍(95% CI, 1.7~2.6) [10]。另有Wilson等人基于GPRD (General Practice Research Database)的巢式病例对照研究表明,诊断超过10年(OR 2.1, 95% CI 1.4-3.2)的AIDs患者发生MDS的风险可增加2.1倍 [13] ,提示MDS可能为慢性炎症的晚期表现。本研究中,有27.7%的MDS患者(n = 57/206)合并AIDs,其发生率远高于普通人群中自身免疫性疾病5%的综合患病率 [14] [15] ,这进一步提示MDS与AIDs关系密切,两者间可能存在共同的发病机制。
MDS合并AIDs的内在机理目前尚未明确。部分学者认为,免疫调节功能失衡是二者发病的潜在基础。MDS患者的细胞免疫中,普遍认为细胞调节性T细胞(Tregs)可抑制细胞毒性T细胞对恶性克隆的免疫活性,并促进疾病进展。在MDS早期阶段,Tregs功能受损,细胞毒性T细胞免疫激活导致骨髓及外周血细胞减少,并倾向于引发自身免疫,猜测其可能对AIDs有促进作用。在MDS晚期,Tregs扩增且免疫抑制功能恢复,细胞毒性T细胞的肿瘤杀伤作用下降导致肿瘤细胞的免疫逃避,进而引发MDS恶性克隆,疾病进展 [5]。即MDS与AIDs可能源自同一类型免疫异常,而部分MDS患者在给予免疫抑制剂治疗后病情可缓解 [16] ,可为这一说法提供佐证。
国外相关研究报道AIDs在MDS患者中发病率常在10%~30%之间 [4] [6] ,合并的AIDs种类常见包括血管炎、炎症性关节炎、结缔组织疾病或未分类的疾病 [5]。本研究中观察到合并的AIDs主要有血管炎11例、典型结缔组织病系统性红斑狼疮4例、未分化结缔组织病4例,类风湿性关节炎7例,余AIDs类型散发,与国外报道一致。Liozon [17] 等人报道,在所有并发的血管炎类型中,中、小血管炎最为常见且预后较好。本研究中小血管炎类白塞病占比高达73% (n = 8/11),这些患者受累血管病变通常较轻,与其他合并AIDs患者相比,都拥有更长的PFS及OS。国外报道MDS相关的白塞病患者+8异常染色体核型常见 [18] [19] ,本研究中8例合并白塞病患者中6例伴有+8异常染色体核型,暂未发现其他与AIDs疾病相关的特异性细胞遗传学异常。
本研究观察到合并AIDs组患者女性占比偏高,这可能与AIDs多好发于女性相关。有报道分析男女间免疫环境可能存在差异,女性在接受抗原刺激后更容易发展为以TH1为主的免疫反应,TH1分泌的IL-2、IFN-γ等细胞因子可形成致炎环境从而促进自身免疫性疾病的高发 [7]。
分析发现合并AIDs组患者的总体PFS、OS均优于不合并组,与两大型研究Komrokji、Seguier [2] [5] 等的报道一致,这可能与本研究中合并AIDs组患者在WHO分型中倾向于MDS-MLD型,在IPSS预后分级里低危、中危-1占比偏高有关。此类MDS患者在疾病分型中偏向于轻型,预后分期中为中低危,多处于疾病发展前期,有较好预后。进一步分析中低危MDS患者预后,调整后的IPSS分组提示低风险组(低危、中危1)中合并AIDs的患者PFS及OS亦显著高于不合并组,而此类患者接受的类固醇激素及免疫抑制剂治疗可能是造成该结果的原因之一(不合并组未接受相关治疗)。Seguier等人的研究认为以下几点可能是造成合并AIDs的MDS患者总体生存率更高、预后更好的原因:IPSS分级为低危或中危-1比例偏高、正常或有利的染色体核型占比偏高、患者平均年龄偏低、无治疗相关MDS等 [2]。对可能影响患者生存预后的多种因素(年龄、性别、WHO分型、IPSS分级、有无合并AIDs、染色体核型、血沉等)进行COX分析,结果显示合并AIDs不是影响MDS患者预后的独立危险因素,这可能是由于MDS合并的AIDs种类较多,难以比较所致。
本研究的局限性是未能进行多中心随访研究,及未能观察收集到患者治疗方案及疗效相关资料进行进一步深入分析,在随后的研究中将补足上述不足,分析探讨MDS合并AIDs患者的治疗对于预后的影响。总之,免疫失调可能是MDS与AIDs共同的发病基础,并AIDs的MDS患者多好发于女性,WHO分型上倾向于MDS-SLD,IPSS分期上偏向中低危,多有较好的PFS及OS。
同意书
该研究已获得病人知情同意。