1. 引言
抗生素自问世以来被广泛应用到医疗、养殖等领域,但其大量使用和不当处理与排放带来的水污染问题日益严峻。光催化技术作为一种绿色高效的新型降解技术备受瞩目。在过去的几十年里,半导体光催化技术研究有了长足的发展,研究人员也发现了许多具有光催化活性的半导体光催化剂,如TiO2 [1]、ZnO [2]、CuO [3]、CdS [4]、g-C3N4 [5]、Bi2O3 [6] 和Bi2WO6 [7] 等,这些半导体光催化剂各具特色且应用广泛。其中,铋基光催化剂Bi2WO6自1999年首次被报道对可见光下的O2析出反应具有活性后 [8],Bi2WO6凭借铋资源丰富、合成方法简单、化学性质稳定、禁带宽度适宜等优点成为备受瞩目的铋基半导体光催化剂之一。
Bi2WO6是n型直接带隙半导体材料,属于最简单的Aurivillius成员,通常具有层状结构和独特的性质。Bi2WO6是由
层和类钙钛矿的
层交替构成的正交晶型,这种层状结构可以看作是单层氧化物之间化学键堆积而成,有利于光生电子空穴对的迁移。目前,Bi2WO6因其合适的带隙宽度(2.7 ~2.9 eV)、简单的制备工艺、可见光响应和无毒等优点在光催化领域有广泛的应用。但是Bi2WO6在光催化过程中受到的主要的限制是光生电子空穴对的重组和较窄的光吸收范围。因此,为了增强Bi2WO6的光催化性能,需要对材料进行改性以提高其可见光下光催化降解性能。
而构筑半导体异质结是改性的一条有效策略,目前已有许多研究表明,与其他半导体复合可以在界面形成电荷区,可以改善Bi2WO6可见光响应范围,改变电荷转移路径,达到快速降解抗生素的目的。过渡金属硫化物MoS2是典型的类石墨烯材料 [9],具有比表面积大、催化活性高和光电性能优越的优点,是潜在的吸附剂材料和光催化剂。与片状的MoS2相比,MoS2量子点表现出小尺寸的量子效应 [10],在水介质中具有更高的稳定性。此外,MoS2量子点与光催化剂复合,可以捕获光生载流子,进一步降低光生载流子复合几率 [11]。MoS2量子点的制备方法有液相剥离法 [12]、水热法 [13] 和冷冻辅助超声法 [14] 等。
本文以Bi2WO6为基体材料,采用一步水热法制备出MoS2量子点,再通过静电自组装法制备出MoS2/Bi2WO6复合光催化剂。重点研究MoS2量子点的不同负载量对MoS2/Bi2WO6复合光催化剂的光催化降解左氧氟沙星(LVFX)性能的影响,并分析光催化降解机理。
2. 实验部分
2.1. 样品制备
将5 mmolBi (NO3)3·5H2O (分析纯)与25 mL去离子水混合搅拌均匀,记为A溶液;将2.5 mmol Na2WO4·2H2O (分析纯)与25 mL去离子水超声均匀,记为B溶液;将B溶液缓慢逐滴加入A溶液后,再经磁力搅拌后转移至反应釜,在140℃条件下保温12 h。反应完成,等反应釜自然冷却至室温后,进行离心处理,然后再用去离子水和乙醇(分析纯)离心洗涤5~6次。将得到的白色沉淀在60℃下干燥12 h,研磨后标记为BWO。
以Na2MoO4·2H2O (分析纯)和二苄基二硫化物(分析纯)作为前驱体,采用水热法制备MoS2量子点。反应公式如下:
(1)
首先,称取0.4 g Na2MoO4·2H2O通过超声处理溶解在30 mL水中。然后,将0.38 g的二苄基二硫化物和30 mL的乙醇加入到溶液中,超声处理30 min。然后将混合物转移到衬有不锈钢高压釜中,并在220℃温度下保温18 h。反应结束,待反应釜自然冷却至室温后,将得到的悬浮液以10,000 rpm离心60 min以分离上清液。上清液即为MoS2量子点。
采用静电自组装的方法制备MoS2/BWO复合光催化剂。具体操作如下:首先,称取0.1 g的BWO粉末分散到20 mL的乙醇溶液,搅拌混合均匀之后,滴入X体积的MoS2量子点溶液,X = 0.1、0.5、1.0 mL。将混合溶液进行磁力搅拌,然后进行离心处理,干燥后收集到的粉末即为MoS2/Bi2WO6复合光催化剂,记为MoS2(X)/BWO。
2.2. 样品表征
采用D/MAX2500V型X射线衍射仪分析样品的物相组成。采用SU8020型场发射扫描电子显微镜观察样品的微观形貌。采用JEM-2100F型场发射透射电子显微镜观察样品的微观形貌和结构。采用ESCALAB250Xi型X射线光电子能谱分析样品表面的元素和价态。采用Carry5000型紫外可见分光光度计分析样品对可见光的吸收情况。采用F-4500型荧光分光光度计分析样品的光生电子空穴对复合几率。
2.3. 样品光催化降解性能测试
光催化降解实验采用南京胥江电子厂制造的XPA-7型光催化反应仪,在可见光下对制备的光催化剂样品进行光催化降解左氧氟沙星(LVFX)实验。实验选择250 W金卤灯为光源,并安装420 nm截止滤波片以确保光催化降解实验在可见光下进行。
称取0.01 g的MoS2(X)/BWO,加入10 mL配置好的浓度为20 mg/L的LVFX溶液在石英试管中搅拌。黑暗条件下持续搅拌40 min,使体系中光催化剂与降解物之间达到吸附–脱附平衡;光照条件下每隔15 min取一支试管,离心后取上层清液测试降解后的溶液吸光度,测量287 nm处的吸收峰值强度,并根据公式1计算得到光催化降解后溶液中的LVFX剩余浓度。降解公式如下:
(2)
为了进一步研究不同活性基团在光催化降解过程中产生的贡献,使用对苯醌(2 mmol/L)、异丙醇(10 mmol/L)和乙二胺四乙酸(2 mmol/L)作为
、
和h+的捕获剂。活性基团检测的实验过程与光催化降解LVFX过程相似,捕获剂在降解实验前添加到试管中。
3. 结果与讨论
图1是BWO和不同MoS2量子点负载量的MoS2(X)/BWO复合光催化剂XRD图谱。BWO和MoS2(X)/BWO复合材料的衍射峰形状相似,说明负载MoS2量子点过程对BWO样品的结晶性没有影响,其中2θ值在28.3˚、32.7˚、47.1˚和56.0˚处衍射峰峰值分别对应于(131)、(200)、(202)和(133)晶面(JCPDS卡片号:39-0256)。此外,由于MoS2量子点的含量较低,在图谱中没有观察到MoS2的特征峰。
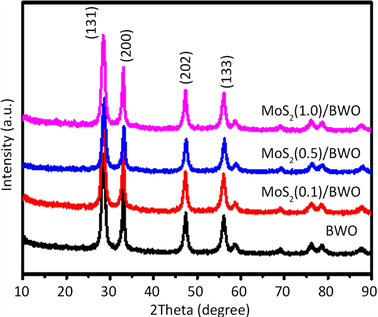
Figure 1. XRD patterns of BWO and MoS2(X)/BWO loaded with different MoS2 quantum dots
图1. BWO和不同MoS2量子点负载量的MoS2(X)/BWO样品的XRD图谱
为了分析所制备的MoS2(0.5)/BWO样品所含元素及元素化学价态,我们对样品进行XPS分析,结果如图2所示。图2(a)是MoS2(0.5)/BWO样品的XPS全谱图,证明存在Bi、W和O元素。图2(b)是样品的Mo 3d电子高分辨图谱,经过拟合后,结合能在235.38 eV和232.23 eV处有两个特征峰,分别归属于Mo 3d 3/2和Mo 3d 5/2电子轨道,此时Mo元素的存在价态是Mo4+ [13],结合能在228.33 eV处的特征峰对应于S2s电子。此外,未发现有其他价态的Mo,说明制备的MoS2量子点稳定性较好,在空气中未被氧化。图2(c)是样品的Bi4f电子高分辨图谱,结合能在164.53 eV和159.23 eV处有两个特征峰,分别归属于Bi4f5/2和Bi4f7/2电子轨道,此时Bi元素的存在价态是Bi3+。图2(d)是样品的O 1s电子高分辨图谱,结合能在530.23 eV、530.98 eV和532.28 eV处有三个特征峰,分别对应了Bi-O键、W-O键和样品表面吸附的氧。图2(e)是样品的W 4f电子高分辨图谱,结合能在37.68 eV和35.53 eV处有两个特征峰,分别归属于W 4f5/2和W 4f7/2电子轨道,其中W元素的价态为W6+。
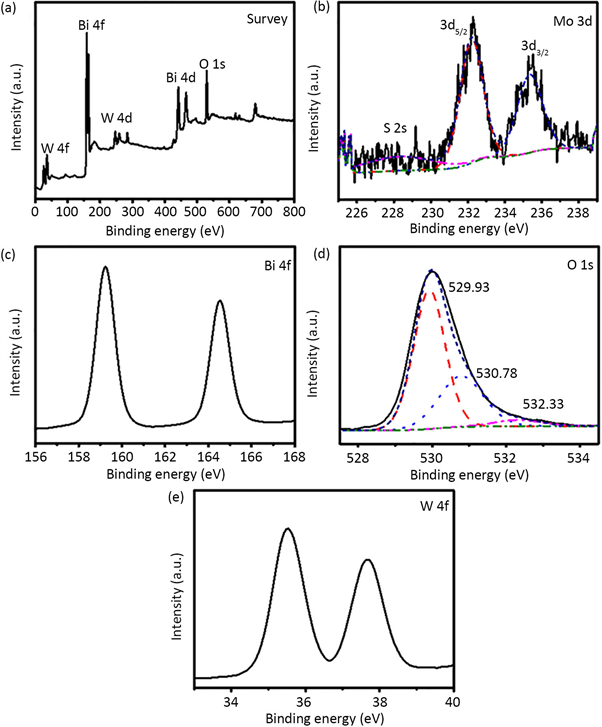
Figure 2. XPS spectra of MoS2(0.5)/BWO: (a) survey spectrum, (b) high resolution patterns of Mo 3d electrons, (c) high resolution patterns of Bi 4f electrons, (d) high resolution patterns of O 1s electrons and (e) high resolution patterns of O 1s electrons
图2. MoS2(0.5)/BWO样品的XPS图谱:(a) 全谱、(b) Mo 3d电子、(c) Bi 4f电子、(d) O 1s电子和(e)W 4f电子的高分辨图谱
图3(a,b)是BWO和MoS2(0.5)/BWO光催化剂的SEM形貌图,负载MoS2量子点后,Bi2WO6球状结构没有明显变化,依然由纳米片组装而成,结构直径在3 μm左右。图3(c)可看出,MoS2(0.5)/BWO样品中心部分是较为清晰的粗大片层,较薄的纳米片向边缘延伸生长。图3(d)是MoS2(0.5)/BWO的HRTEM图片,测量其晶面间距为0.31 nm,与正交晶系Bi2WO6 (JCPDS卡片号:39-0256)的(131)晶面间距相对应。图3(e)是MoS2量子点的TEM图,由图可知,量子点尺寸在3~5 nm左右。为了更进一步确定MoS2量子点成功的负载在样品表面,我们对MoS2(0.5)/BWO样品进行了面扫描测试,图3(f)是MoS2(0.5)/BWO的面扫描图,根据元素分布图,Mo和S元素分布范围与在面扫描样品范围重合,可以判断MoS2(0.5)/BWO样品表面存在MoS2量子点。
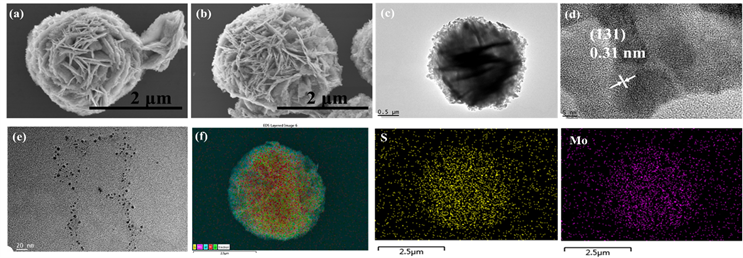
Figure 3. SEM morphology of (a) BWO and (b) MoS2(0.5)/BWO, TEM morphology of (c) MoS2(0.5)/BWO and (e) MoS2, HRTEM morphology of(d) MoS2(0.5)/BWO, mapping patterns of (f) MoS2(0.5)/BWO
图3. (a) BWO和(b) MoS2(0.5)/BWO样品的SEM图,(c) MoS2(0.5)/BWO样品的TEM图,(d) MoS2(0.5)/BWO样品的HRTEM图,(e) MoS2样品的TEM图,(f) MoS2(0.5)/BWO的面扫描图
良好的光吸收性能在半导体光催化体系中扮演着重要的角色。图4(a)是BWO和MoS2(X)/BWO复合光催化剂的紫外可见漫反射光谱,由图可知,BWO的吸收边为443 nm,MoS2(0.5)/BWO复合光催化剂的吸收边为468 nm,与BWO相比,吸收边有明显红移,说明在负载MoS2量子点后提升了BWO样品可见光吸收能力。这一现象可以归因于MoS2量子点的光吸收能力较强。图4(b)是根据Kubelk-Munk方法计算得到的BWO和MoS2(X)/BWO复合光催化剂的禁带宽度,BWO、MoS2(0.1)/BWO、MoS2(0.5)/BWO和MoS2(1.0)/BWO的带隙分别约为2.68 eV、2.42 eV、2.40 eV和2.28 eV。图4(c)是BWO和MoS2(X)/BWO复合光催化剂在激发波长为320 nm的光致发光光谱。由图可知,MoS2(0.5)/BWO具有最弱的峰强,表明在Bi2WO6样品中负载适量的MoS2量子点可以有效抑制光生载流子的复合,也因此MoS2(0.5)/BWO具有比BWO更优越的光催化活性。

Figure 4. BWO and MoS2(X)/BWO loaded with different MoS2 quantum dots: (a) UV-Vis diffusereflectance spectra; (b) Band gap; (c) Photoluminescence spectra
图4. BWO和MoS2量子点不同负载量的MoS2(X)/BWO样品:(a) 紫外可见漫反射光谱;(b) 禁带宽度;(c) 光致发光光谱
为了评价制备的MoS2(X)/BWO复合光催化剂的光催化活性,以20 mg/L的左氧氟沙星(LVFX)为目标降解物来进行测试。图5(a)是所有MoS2(X)/BWO样品在可见光照射1 h后光降解效率曲线,最优的MoS2(0.5)/BWO的最大光催化降解率达到82.32%。BWO、MoS2(0.1)/BWO和MoS2(1.0)/BWO的最终光催化降解率分别为69.17%、71.27%和76.31%。由此可见,MoS2(X)/BWO复合光催化剂均表现出比BWO更高的可见光光催化降解性能。图5(b)是BWO和MoS2(X)/BWO复合光催化剂在可见光照射下对LVFX的降解动力学曲线。由图可知,BWO、MoS2(0.1)/BWO、MoS2(0.5)/BWO和MoS2(1.0)/BWO的动力学常数分别为0.0150、0.0136、0.0183和0.0158 min−1。显然,引入MoS2量子点可以帮助提高光催化降解性能。这也与光致发光光谱分析结果一致,MoS2(0.5)/BWO复合光催化剂具有最高的光催化活性。

Figure 5. Photocatalytic performance of BWO and MoS2(X)/BWO loaded with different MoS2 quantum dots: (a) photocatalytic degradation rates of LVFX under visible light irradiation, (b) degradation kinetics curves
图5. BWO和不同MoS2量子点负载量的MoS2(X)/BWO样品光催化性能:(a) 可见光照射下降解左氧氟沙星的光催化降解率曲线,(b) 降解动力学曲线
进行活性基团捕获实验以鉴定参与光催化降解反应的主要活性基团,并阐明光催化降解机理。图6是在添加了不同捕获剂的情况下,可见光照射1 h后BWO和MoS2(0.5)/BWO样品对LVFX的降解效率。可以看出,没有任何捕获剂时,MoS2(0.5)/BWO和BWO对LVFX的光催化降解效率分别为82.32%和69.17%。使用BQ和EDTA作为捕获剂时,MoS2(0.5)/BWO的降解效率分别降至8.79%和49.66%。当使用IPA作为捕获剂时,降解效率仍能达到81.03%。因此,可以证明MoS2(0.5)/BWO在光催化降解过程中产生的催化活性基团主要是
,其次是h+。相应地,在加入BQ和EDTA作为捕获剂后,BWO的降解效率分别降至5.78%和20.56%。添加IPA后降解率达到55.61%,略有降低。因此,我们可以判断,BWO和MoS2(0.5)/BWO样品在光催化过程中起主要作用的活性基团为
,其次是h+。

Figure 6. Photocatalytic degradation rates of BWO and MoS2(0.5)/BWO for LVFX with three different capture agents
图6. 在加入三种不同捕获剂后BWO和MoS2(0.5)/BWO样品对左氧氟沙星光催化降解率
图7所示为MoS2(0.5)/BWO复合光催化剂的光生电子–空穴分离传输示意图。由图可见,在可见光照射下,BWO价带(VB)上的电子(e−)在光能激发下跃迁至导带(CB)位置,并在VB上留下空穴(h+)。因为MoS2量子点尺寸较小,BWO上的光生电子可以更快的转移到边缘位置参与反应,同时降低光生电子空穴对复合几率,这与前面PL测试结果一致。光生电子e−与O2反应生成
,同时价带上的空穴h+也可以与复合光催化剂吸附的LVFX发生催化降解反应。
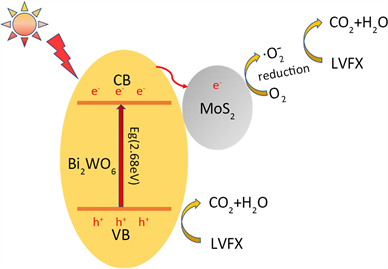
Figure7. Schematic diagram of band structure and electron-hole separation and transport of MoS2(0.5)/BWO
图7. MoS2(0.5)/BWO样品的电子-空穴分离传输示意图
4. 结论
采用水热法制备Bi2WO6,以Na2MoO4·2H2O和二苄基二硫化物作为前驱体,采用水热法制备出MoS2量子点,再通过静电自组装法制备出MoS2/Bi2WO6复合光催化剂,通过XPS和mapping等证实了成功制备出MoS2(X)/BWO复合光催化剂;负载MoS2量子点前后对基体BWO样品结构无明显影响;通过UV-vis DRS和PL表征得到,与BWO相比,负载MoS2量子点后,MoS2(X)/BWO复合光催化剂的光吸收能力有所改善、光生载流子迁移效率明显提升。在可见光照射60 min后,最优的MoS2(0.5)/BWO复合光催化剂对20 mg/L的LVFX的降解率达到82.32%,降解动力学常数为0.0183 min−1,降解速率是BWO的1.22倍。光催化降解捕获实验表明,在MoS2(0.5)/BWO的光催化反应中,起主要作用的活性基团是
,其次是h+。与BWO相比,负载MoS2量子点后,复合光催化剂降解性能的提升原因主要是Bi2WO6和MoS2量子点之间形成异质结,光生载流子迁移效率得到明显提升。
基金项目
本项目得到国家自然科学基金(52072107)的支持。