1. 引言
自1972年Fushijima等人 [1] 首次发现TiO2光催化水制氢的现象,半导体光催化技术备受关注。其中,纳米TiO2由于成本低、化学性质稳定、光催化活性高、无毒无害及耐腐蚀等特点 [2],得到了广泛的研究和应用,但是其存在缺陷限制了其应用,一是TiO2对可见光的响应范围较差;二是其产生的光生电子与空穴易发生复合。对纳米TiO2进行修饰如贵金属沉积 [3]、金属离子掺杂 [4]、非金属离子掺杂 [5] 和半导体复合 [6] 等,拓宽其激发波段、降低带隙能、抑制光生载流子的复合 [7] 或者制成各种形态的纳米TiO2如纳米线 [8]、纳米管 [9]、纳米片 [10]、纳米粒 [11]、纳米纤维 [12] 等,提高其比表面积、增加其表面活性位点,提高其光响应范围,降低TiO2的带隙能,降低光生电子–空穴复合率,提高其催化性能。此外,光、电协同作用 [13] 能够提高电极的催化活性,通过外加电压能及时导走TiO2表面产生的光生电子,降低光生载流子复合率,提高光电催化降解率。
本文采用二次阳极氧化法制备TiO2纳米管/Ti,高压水热掺杂C、电镀沉积CoNi合金,制备CoNi/TiO2-C纳米管电极,对其进行形貌结构表征,并测试了该电极的太阳光电催化性能。
2. 实验部分
2.1. 试剂
钛片(99.5%),上海代远金属制品有限公司;无水乙醇、氢氟酸,上海凌峰化学试剂有限公司;氟化铵、硫酸、乙二醇、七水合硫酸钴、六水合硫酸镍、冰醋酸、甲基橙,西陇化工股份有限公司;乙二胺四乙酸二钠,天津市登峰化学试剂厂;葡萄糖,国药集团容生制药有限公司,均为AR。
2.2. CoNi/TiO2-C纳米管电极的制备
将钛片(2 cm × 2.5 cm × 0.5 mm)用金相砂纸打磨至表面光亮,加入到2%的HF溶液中预处理2 h,无水乙醇、去离子水超声清洗三次,烘干。2.5 g氟化铵溶于50 mL去离子水和450 mL乙二醇形成阳极氧化电解液。以钛片作为阳极,铂电极为阴极,第一次阳极氧化在30 V电压下反应2 h。一次阳极氧化后的钛片无水乙醇超声清洗10 min。晾干后20 V电压下二次阳极氧化3 h,马弗炉500℃焙烧3 h后得TiO2纳米管/Ti。以0.02 g/mL的葡萄糖溶液为碳源,将TiO2纳米管/Ti在160℃下进行高压水热掺碳,反应24 h,掺碳后管式炉450℃、N2氛下焙烧3 h,得到TiO2-C纳米管电极。称取0.14 g七水合硫酸钴、0.131 g六水合硫酸镍、0.158 g乙二胺四乙酸二钠,溶于50 mL的去离子水中形成电镀液。以TiO2-C纳米管电极为阴极,铂电极为阳极,在1.5 V左右的电压下进行电沉积20 min,得到CoNi /TiO2-C纳米管电极。
2.3. 结构与形貌表征
用D8 Advance型X射线衍射仪(BRUKER AXS)对样品Ti片、TiO2纳米管/Ti、TiO2-C纳米管电极和CoNi/TiO2-C纳米管电极进行扫描,扫描速度为5 min−1,扫描范围为5˚~80˚;用JEM-2100F型透射电子显微镜(TEM, JOE)观察TiO2纳米管/Ti的形貌。
2.4. CoNi/TiO2-C纳米管电极的光电催化降解实验
以10 mg/L的甲基橙为模拟染料废水,55 W模拟太阳灯,铜棒为阴极、CoNi/TiO2-C纳米管电极为阳极。每隔10 min取一次样,测试时间为100 min,探究不同电压、pH条件下该电极对甲基橙的降解率。分别测定甲基橙在不同时间的吸光度,通过比较吸光度的变化计算降解率。
3. 结果与讨论
3.1. XRD测试结果
纯Ti片、TiO2纳米管/Ti、TiO2-C纳米管电极和CoNi/TiO2-C纳米管电极的XRD测试结果如图1所示。
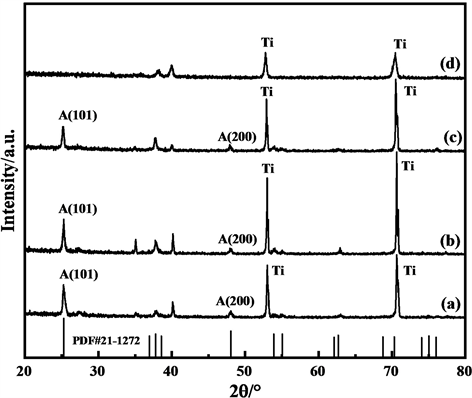 (a) CoNi/TiO2-C纳米管电极;(b) TiO2-C纳米管电极;(c) TiO2纳米管/Ti;(d) Ti片
(a) CoNi/TiO2-C纳米管电极;(b) TiO2-C纳米管电极;(c) TiO2纳米管/Ti;(d) Ti片
Figure 1. XRD spectrum of electrode material
图1. 电极材料的XRD谱图
图1可见,Ti片、TiO2纳米管/Ti、TiO2-C纳米管电极和CoNi/TiO2-C纳米管电极在35.093˚、38.421˚、40.170˚、53.004˚和70.660˚处均出现了Ti的特征峰,表明TiO2纳米管/Ti、TiO2-C纳米管电极和CoNi/TiO2-C纳米管电极仍然以Ti为主;CoNi/TiO2-C纳米管电极、TiO2-C纳米管电极和TiO2纳米管/Ti在25.28˚、37.8˚、48.05˚和53.89˚出现了锐钛矿相TiO2(101)晶面、(004)晶面、(200)晶面和(105)晶面的特征衍射峰,表明经过阳极氧化反应和马弗炉500℃高温焙烧后成功得到锐钛矿相的TiO2,且经过高温水热反应掺碳、电化学沉积CoNi合金并未破坏TiO2的锐钛矿晶相结构。C掺杂后锐钛矿特征峰衍射角从25.22˚偏移至25.28˚,说明高温处理后C成功掺杂进入TiO2的晶格,引起晶格畸变,从而使其催化活性提高。XRD谱图中未出现Co、Ni的特征峰,这可能是由于Co、Ni的掺杂量较低,难以检测出来。
3.2. TEM测试结果
TiO2纳米管/Ti的TEM测试结果如图2所示。图中可见,在钛片表面出现了许多管状结构,这些管状结构为TiO2纳米管,经过阳极氧化后的钛片表面成功生长出较长的TiO2纳米管,孔径也较大,但是排列较为杂乱无序,可能是由于一次阳极氧化后进行超声处理的时候,时间较短,并未能完全去除第一次阳极氧化生长出来的纳米管,导致第二次生长时结构不够规整,且有部分聚集的现象。TiO2纳米管结构以及较大的孔径使其具有较大比表面积,提高其催化性能。

Figure 2. TEM picture of TiO2 nanomaterial
图2. TiO2纳米材料的TEM图
3.3. CoNi/TiO2-C纳米管电极的光电催化性能测试结果
以10 mg/L的甲基橙溶液为目标降解物,研究CoNi/TiO2-C纳米管电极的光电催化降解的最佳pH值和外加电压,测定TiO2纳米管/Ti、TiO2-C纳米管电极和CoNi/TiO2-C纳米管电极分别在最佳pH值和外加电压下的光电催化降解效果,研究电催化、光催化、光电催化对CoNi/TiO2-C纳米管电极的催化降解效果的影响。
3.3.1. 电压的影响
在2 V、4 V、6 V、8 V、10 V的条件下对甲基橙进行了光电催化降解实验。结果如图3所示。
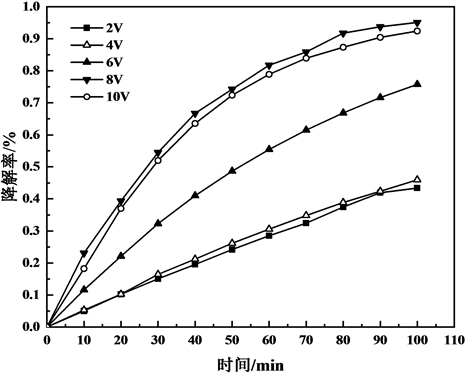
Figure 3. Curve of degradation rate to time of the CoNi/TiO2-C electrode at different voltage
图3. 不同电压下的CoNi/TiO2-C纳米管电极的降解率–时间曲线图
图3可见,光电降解率先随着电压增大而增大,达到最佳值后降解率开始随电压增大而下降。对于CoNi/TiO2-C纳米管电极,在8 V电压下对甲基橙光电催化效果最佳。电压对降解反应能够起一定的促进作用,在外加电压的条件下,光生电子与空穴能够得到有效分离,提高催化剂的光电催化活性。但是当电压过高时反而会抑制降解反应,这可能是因为在过高的电压下使得TiO2表面的纳米管结构被破坏,反而降低了降解效果。
3.3.2. 甲基橙溶液pH的影响
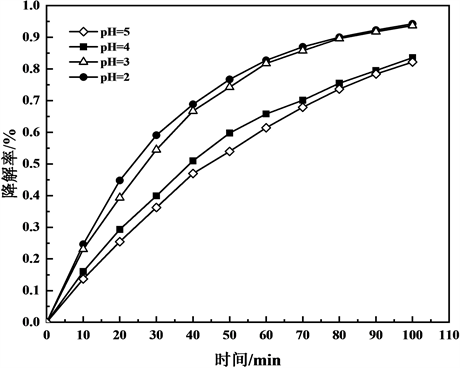
Figure 4. Curve of degradation rate to time of the CoNi/TiO2-C electrode at different pH
图4. 不同pH下的CoNi/TiO2-C纳米管电极的降解率–时间曲线图
分别测定了pH为2、3、4、5时CoNi/TiO2-C纳米管电极对甲基橙的光电降解效果,其结果如图4所示。图中可以看出,pH对光电降解反应有较大影响,当pH为2和3时,CoNi/TiO2-C纳米管电极对甲基橙的光电降解效果均较好,经过太阳光照射100 min后,甲基橙的降解率均达到95%左右,但总的趋势是降解率随着pH变大而降低。可能是以甲基橙为目标降解物时,酸性条件下其主要以醌式结构存在,醌式结构的甲基橙比偶氮式结构的甲基橙更容易降解,且当pH值较低时,TiO2表面带正电,甲基橙表面带负电,故酸性条件下TiO2能够吸附更多的甲基橙 [14],使其能够与TiO2表面产生的活性自由基充分接触并反应。
3.3.3. 杂前后降解对比
在电压为8 V、pH为2的条件下,分别以TiO2纳米管/Ti、TiO2-C纳米管电极、CoNi/TiO2-C纳米管电极为阳极进行光电催化降解实验,结果如图5所示。
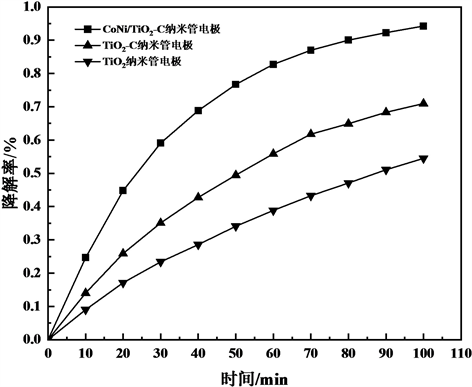
Figure 5. Curve of degradation rate to time of different electrode
图5. 不同电极材料的降解率–时间曲线图
图5可见,不同电极的光电降解效果差异较为明显,其中CoNi/TiO2-C纳米管电极的降解效果比TiO2-C纳米管电极和TiO2纳米管/Ti高,CoNi/TiO2-C纳米管电极100 min阳光照射下光电催化降解率高达95%,而TiO2纳米管/Ti仅为54.6%,CoNi-C的共掺杂、C掺杂均能提高纳米TiO2的光电催化性能且CoNi-C的共掺杂对其催化性能提高作用最大。可能原因是高压水热掺碳及管式炉高温焙烧使得C原子成功进入TiO2的晶格并取代O原子,引入杂质能级,降低TiO2的带隙能,拓展其激发波段,提高催化活性。C的掺杂能够提高TiO2纳米管/Ti的导电性,使光生电子和空穴复合的几率降低,从而提高TiO2的光电催化性能。CoNi沉积在TiO2表面,也可以增强其导电性,促进光生电子、空穴的分离,提高光电催化性能,其协同作用使得CoNi/TiO2-C纳米管电极的催化性能大大提高。
3.3.4. 光源、电源的影响
CoNi/TiO2-C纳米管电极在暗室电催化、光催化以及光电催化的降解率结果如图6所示。
图6可以看出,与单独的光催化和暗室电催化相比,光电催化降解的效果最佳。CoNi/TiO2-C纳米管电极对模拟废水100 min太阳光照射下的光电催化降解率能达到95%左右;光催化降解的效果最差,降
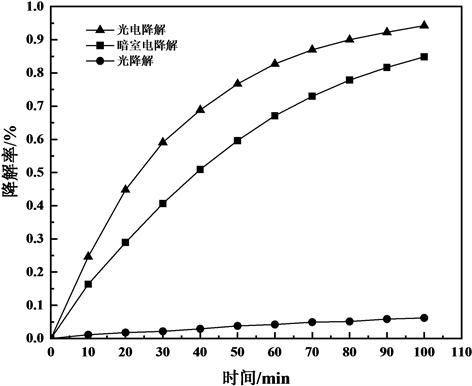
Figure 6. Curve of degradation rate to time of the CoNi/TiO2-C electrode at different external conditions
图6. 不同外加条件下CoNi/TiO2-C纳米管电极的降解率–时间曲线图
解率只能达到10 %左右,虽然非金属C、Co、Ni掺杂能够提高TiO2的光催化活性,但可能由于催化剂面积过小,且负载在Ti基底上的催化剂不能均匀分散在模拟废水溶液中,使光催化降解效果较低。暗室电降解的效果也明显优于光催化降解,这可能是因为在暗室条件下电压起了主要作用。光电催化时,甲基橙溶液的降解率最高,光、电对电极的协同作用,大大提高了TiO2的催化性能。
4. 结论
实验得出以下结论:
1) 以NH4F的乙二醇溶液作为阳极氧化电解液,成功制备出TiO2纳米管/Ti,TiO2为锐钛矿相,高压水热掺C、电镀沉积CoNi对其晶相无影响。
2) CoNi/TiO2-C纳米管电极的光电催化性能比TiO2-C纳米管电极、TiO2纳米管/Ti高,CoNi合金与非金属C的共掺杂有效提高了纳米TiO2的催化活性。
3) CoNi/TiO2-C纳米管电极的最佳光电催化降解条件为甲基橙溶液的pH值为2、外加电压为8 V,光电催化降解效果>电催化降解>光催化降解,说明CoNi/TiO2-C纳米管电极中CoNi/TiO2-C纳米管催化剂具有较高的催化活性。
4) CoNi/TiO2-C纳米管电极如用于处理废水,可大大降低废水处理成本,具有较好的应用前景。