1. 引言
科技成果不仅要转化为实际生产,还要促进实验教学的发展。开发出与科研和生产相结合的新实验项目,不仅可以激发学生实验兴趣,还可锻炼学生动手能力,更能培养学生创新思维。药食两用苦杏仁是蔷薇科植物山杏Prunus armeniaca L. varansu Maxim.、西伯利亚杏Prunus sibirica L.、东北杏Prunus mandshurica (Maxim.) Koehne或杏Prunus armeniaca L.的干燥成熟种子 [1],盛产于我国华北、东北和西北。根据《神农本草经》记载,苦杏仁性苦,微温,有小毒,具有止咳平喘、润肠通便的功效。《本草纲目》记载苦杏仁能祛风寒、止咳、治疗哮喘、消肿通气、解燥气。近年来研究发现苦杏仁不仅具有显著的止咳、祛痰作用 [2],还对高血压、冠心病、动脉硬化、高血脂等疾病也具有良好的预防和辅助治疗作用 [3]。研究发现,其主要有效成分是苦杏仁苷。自1803年Schrader发现苦杏仁苷,到1830年Robiquet从苦杏仁中分离出苦杏仁苷以来 [4],人们便一直致力于苦杏仁中苦杏仁苷的开发及其提取工艺 [5],发展了水提法、醇提法、超声波辅助和微波辅助提取等方法,并通过单因素实验、正交实验、响应面法等优化提取工艺参数 [5] - [10]。目前乙醇提取法已应用于苦杏仁苷的工业生产,并且已有食用苦杏仁苷产品上市。因此适时地将苦杏仁苷的提取技术设计开发成适合教学的综合实验项目,与时俱进地更新实验教学内容,可以为《有机化学实验》课程中糖苷类天然物提取提供更多实验项目选择。本实验根据化学实验教学特点,在前人已报道相关研究工作基础上,改进其不利于实验教学的工艺步骤,增加现代仪器操作,提高大型仪器设备使用效率。
2. 实验部分
2.1. 实验目的
掌握有机溶剂提取法从去皮苦杏仁粕中提取苦杏仁苷的原理和方法;掌握重结晶法纯化苦杏仁苷的原理和方法;掌握天然产物结构鉴定技术。
2.2. 实验原理
苦杏仁苷(amygdalin)又名扁桃苷、苦杏仁甙、维生素B17,是分子中含有腈基的腈苷类化合物,具有镇咳平喘、抗炎镇痛、降血脂等作用,是传统中药苦杏仁的有效成分,含量达2%~4%,广泛存在于蔷薇科植物(杏、桃、李子、苹果、山碴等)的果仁中 [9] [11]。
苦杏仁苷在美国化学文摘社(CAS)的登录号为29883-15-6,分子式为C20H27O11N,分子量457.43,分子结构式如图1所示。熔点为223℃~226℃。苦杏仁苷在水中溶解度较大,为83 g/L (25℃)。易溶于沸乙醇(1 g能溶于11 mL沸乙醇)而在冷乙醇中溶解性较差(1 g溶于900 mL冷乙醇),难溶或不溶于乙醚、石油醚、苯、二硫化碳等有机溶剂。
苦杏仁苷不稳定,易被分解。根据不同水解条件产生不同产物 [5] [12]。用苦杏仁酶(苦杏仁酶amygdalase和樱叶酶prunase等的混合酶)水解时先得到野樱皮甙,继续用其它方法水解时才能得到杏仁腈苷元,图2。若用稀硫酸水解,则生成两分子葡萄糖、氢氰酸和苯甲醛。而用浓盐酸水解则产生两分子葡萄糖、氢氰酸和杏仁酸。

Figure 1. Structure of amygdalin (The Arabic numbers are the carbon atomic numbers)
图1. 苦杏仁苷的分子结构式(阿拉伯数字是碳原子编号)
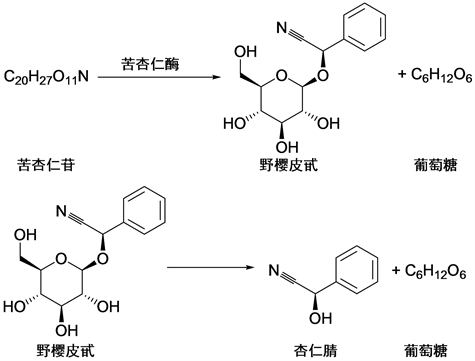
Figure 2. Enzymatic reaction of amygdalin
图2. 苦杏仁苷的酶解反应
2.3. 仪器与试剂
苦杏仁苷提取主要用到仪器设备有:JJ 500型电子天平(0.01 g,常熟市双杰测试仪器厂),MX9小型榨油机(家和美榨油机工厂),101-0A型电热鼓风干燥箱(天津市泰斯特仪器有限公司),DF-101S集热式恒温加热磁力搅拌器(上海力辰邦西科技有限公司),RV8真空旋转蒸发仪(德国IKA公司)。苦杏仁苷结构鉴定主要用到仪器设备有:X4型显微熔点测定仪(上海精密科学仪器有限公司),UV2600紫外可见分光光度计(日本岛津公司),LC3000高压液相色谱仪(北京创新通恒科技有限公司),EFT-60无液氦核磁共振波谱仪(美国ANASAZI公司),AscendTM 400核磁共振波谱仪(德国BRUKER公司)。
试剂:苦杏仁苷标准品(HPLC ≥ 98%,中原植提标准品经销中心),无水乙醇(分析纯,汕头市光华化学厂),乙醚(分析纯,广东西陇化工有限公司),甲醇(色谱纯,上海麦克林生化科技有限公司),超纯水(自制)。
材料:去皮苦杏仁是购自河北安国诚信药业有限公司的初级农产品。
2.4. 实验内容设计
2.4.1. 苦杏仁苷提取
灭酶:将去皮苦杏仁置于80℃烘箱中,灭酶1 h。
脱脂:将灭酶后去皮苦杏仁用家用榨油机压榨除去油脂,得到去皮苦杏仁粕和苦杏仁油。
提取:称取去皮苦杏仁粕10.00 g,用研钵研成粉末后,置于250 mL磨口锥形瓶中,加入100 mL无水乙醇,放入磁力搅拌子,安装到集热式磁力搅拌器中,套上球形冷凝管,接通冷却水,在85℃水浴搅拌回流提取30 min,趁热抽滤,得乙醇提取液。滤渣再重复提取一次。两次滤液合并,于60℃真空旋转蒸发回收大部分乙醇,浓缩至20~30 mL。
析晶:将浓缩液转移至100 mL锥形瓶,加入等体积石油醚,摇晃或搅拌均匀,塞上塞子,室温静置30~60 min,析出大量白色晶体,吸滤除去母液,固体再用少量冷无水乙醇洗涤一次,于105℃烘干,得到苦杏仁苷产品,称重,计算提取率。
2.4.2. 苦杏仁苷结构鉴定
熔点测定:用尖嘴镊子取微量实验产品,置于一盖玻片中央,盖上另一盖玻片,压碎,用X4-型显微熔点测定仪测定熔点。另取微量实验产品和苦杏仁苷标准品混合,按同法测定熔点。
紫外吸收光谱分析:取适量实验产品,用蒸馏水溶解后,装入1 cm石英比色皿,另取一石英比色皿装入蒸馏水作为参比,用紫外可见分光光度计分析,扫描范围185~400 nm。
高效液相色谱分析:取适量苦杏仁苷标准品和实验产品,分别用甲醇–水(35:65,v/v)溶解,针头滤器过滤,分别得到标准品样液和实验品样液,用高效液相色谱仪分析。色谱分析条件:Ultimate XB型C18液相色谱柱(10 mm × 250 mm,5 μm),流动相:甲醇–水(35:65,v/v),流速:2 mL/min,进样量:2 mL。
1H NMR谱分析:取20 mg实验产品装入核磁管,用0.5 mL含四甲基硅烷(TMS)的氘代二甲基亚砜(DMSO-d6)溶解,用核磁共振波谱仪分析。
3. 结果与讨论
3.1. 苦杏仁苷提取
苦杏仁苷不稳定,可被同存于植物中的苦杏仁酶分解生成苷元杏仁腈和葡萄糖 [13],因此,苦杏仁破碎前需要进行灭酶处理 [14]。可以将苦杏仁用沸乙醇或沸水加热灭酶,但操作繁琐并会损失有效成分。本实验采用烘箱80℃高温灭酶,操作简易方便。
灭酶后的苦杏仁中含有大量的油脂,会影响提取效率和产品纯度,因此提取前需要先进行脱脂处理。脱脂常用乙醚或石油醚加热回流萃取 [10] [14],时间耗时较长。也有的研究 [6] 不脱脂处理,直接提取,产品再用乙醚或石油醚除油。本实验采用压榨法脱脂,先得到苦杏仁油和去皮苦杏仁粕,再从去皮苦杏仁粕中提取苦杏仁苷。为了节省教学时间,去皮苦杏仁高温灭酶和压榨脱脂步骤可以在实验前由实验教师提前完成,准备好去皮苦杏仁粕作为实验材料供学生实验用。
有研究表明,用水提取苦杏仁苷,提取液中蛋白质和其它杂质比较多 [5] [9],易发霉变质,且后处理困难 [6] [14],特别是苦杏仁苷在水中易异构化 [13]。因此,大多数研究都选用乙醇为提取剂。苦杏仁苷易溶于沸乙醇,但在冷乙醇中的溶解度较小,易于结晶析出。
根据多个研究小组 [6] [7] [8] [9] [10] 对苦杏仁苷提取工艺的研究可知,苦杏仁苷提取率受到提取次数、提取温度、提取时间、料液比等因素的影响。研究表明,提取温度越高,提取率越大 [7]。但加热温度越高,能耗越大。又因为乙醇的沸点为78℃,即使继续增加温度,也无非是使沸腾更加剧烈,反而使得不安全因素增加。所以多个研究组 [6] [8] [9] [10] 都直接用80℃~90℃为提取温度,而不考察提取温度的影响。研究 [6] [7] 还表明,苦杏仁苷提取率一开始随着提取时间和料液比的增加而升高,但当提取总时间达到60 min,料液比达到1:10之后,提取率变化不大。提取次数越多,一开始提取率越大,但随着提取次数增多,时间和成本都相应增加,故以提取2次为宜 [6] [8]。因此,根据前人研究结果 [6] [7] [8] [9] [10],综合考虑各因素的影响,本实验确定适合教学开展的苦杏仁苷提取工艺参数为:料液比为1:10,提取2次(每次30 min,提取总时间为60 min),用水浴85℃搅拌回流提取。
乙醇提取液浓缩后的体积和析晶时间对产品收率和纯度有较大影响。吴美兰 [6] 研究了乙醇提取浓缩液中溶剂量和结晶时间对产品收率和纯度的影响,发现剩余溶剂量越大,得到产品越纯,但收率相应降低,而结晶时间越长,产品纯度越低。得到最佳纯化工艺是每克脱脂苦杏仁粕原料剩余溶剂量为1.5 mL,静置结晶24 h,可以获得最大收率,产品纯度接近70%。产品再用20倍的无水乙醇重结晶三次,产品纯度可达98%以上。邓康颖等 [8] 的研究结果则是重结晶时,用苦杏仁苷粗品30倍的无水乙醇加热溶解,静置24 h,可以获得纯度接近70%的苦杏仁苷产品,继续用30倍的无水乙醇重结晶三次纯度提高到98%以上。综合分析文献 [6] [7] [8] 研究结果,将乙醇提取液浓缩至原料样品的20~30倍是适宜的,但结晶时间过长,不利于实验教学。分析表明,影响苦杏仁苷析晶时间和产品纯度的主要原因可能是乙醇提取液浓缩后的体积和浓缩液中含有的鞣质和压榨未除净的脂类等杂质。为了加快晶体析出时间,提高实验产品纯度,适合实验教学的开展,本实验研究发现将乙醇提取液浓缩至20~30 mL (去皮苦杏仁粕样品的2~3倍),在乙醇提取浓缩液中加入5%乙醚,搅拌均匀后室温静置30~60 min,便可得到1.54 ± 0.08 g苦杏仁苷产品,提取率达15.40% ± 0.80% (按10.00 g去皮苦杏仁粕计算)。产品不需要重结晶,只需要用冷乙醇洗涤一次,纯度便达到96.00%以上,完全可以满足实验教学的需要。
3.2. 苦杏仁苷结构鉴定
3.2.1. 熔点测定
测得实验产品的熔点为220℃~223℃,与苦杏仁苷文献值 [6] 基本一致。另外,实验产品与苦杏仁苷标准品混合后熔点不下降,初步证明本实验产品为苦杏仁苷。
3.2.2. 紫外吸收光谱分析
苦杏仁苷高效液相色谱检测中,有文献 [6] [15] 采用药典规定的检测波长207 nm。但也有文献采用263 nm [16] [17]、215 nm [8] [9] [10]、210 nm [18] [19] 和208 nm [20] 为检测波长。分析本实验产品的紫外吸收光谱图(图3)可知,本实验产品最大吸收波长分别在194 nm、208 nm和262 nm。因此,本实验选用208 nm为高效液相色谱检测波长。
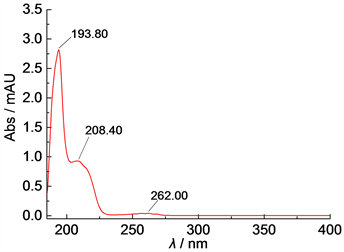
Figure 3. UV spectrogram of the experimental products
图3. 实验产品的紫外吸收光谱图
3.2.3. 高效液相色谱分析
本实验在相同色谱条件下测得苦杏仁苷标准品和本实验产品的液相色谱图如图4。高效液相色谱分析表明,本实验产品和苦杏仁苷标准品的保留时间基本相同,分别在14.309 min (标准品,图4(a))和13.998 min (实验产品,图4(b)),进一步证明本实验产品是苦杏仁苷。将色谱峰进行归一化处理,得到各色谱峰的面积,从而计算得到实验产品中苦杏仁苷面积百分比含量为96.78%。

Figure 4. HPLC of amygdalin standard (a) and experimental product (b)
图4. 苦杏仁苷标准品 (a) 和实验产品 (b) 的高效液相色谱图
3.2.4. 1H NMR波谱分析
有研究 [21] [22] 证明,用D2O溶解苦杏仁苷得到的氢谱不会显示活泼羟基质子特征峰,而用DMSO-d6溶解苦杏仁苷得到的氢谱则会出现明显的活泼羟基质子信号。本实验用DMSO-d6溶解实验产品,分别用60 MHz和400 MHz核磁共振波谱仪测得其1H NMR谱图如图5。从谱图可以看出,仪器频率越大,质子裂分信息越丰富,分辨率越高。比如,苯环上的三种芳香质子,在60 MHz氢谱中没有完全裂分,显示1个宽单峰,而在400 MHz氢谱中,则裂分出3组信号。氢谱中均出现了明显的苦杏仁苷活泼羟基质子信号,而且给出了杂质信号峰,表明实验产品并不纯,但不影响对特征峰进行辨认和归属。通过仔细对比苦杏仁苷文献氢谱图 [21] [22] 和化学位移数据 [22] [23] [24],可对图5(a)信号进行归属。1H NMR (400 MHz, DMSO-d6) δppm:7.58 (2H, dd, J = 8, 4 Hz, H-4, 8),7.48 (2H, m, H-5, 7),7.47 (1H, m, H-6),5.99 (1H, s, H-2), 4.42 (1H, d, J = 8 Hz, H-1’),4.25 (1H, d, J = 4 Hz, H-1”),4.08~2.95 (12H, m, H-2’~6’和H-2”~6”),4.48 (1H, t, J = 4 Hz, OH-6”),5.35~4.85 (6H, OH-2’~4’和OH-2”~4”)。结果表明,实验产品的氢谱特征峰与文献 [24] 中用DMSO-d6为溶剂在400 MHz测得的苦杏仁苷氢谱数据一致,进一步证明本实验产品为苦杏仁苷。

Figure 5. 1H NMR spectrum of the experimental products
图5. 实验产品的1H NMR谱图:(a) 400 MHz, DMSO-d6,(b) 60 MHz, DMSO-d6
4. 结论
本实验确定并验证苦杏仁粕中苦杏仁苷的乙醇提取工艺条件为:料液比1:10,提取温度85℃,提取2次,每次提取时间30 min。苦杏仁苷析晶工艺条件为:乙醇提取液合并浓缩至样品2~3倍体积后,在浓缩液中加入5%乙醚,室温静置30~60 min析晶,可以得到纯度高于96%的实验产品,提取率15.40%。实验产品经与标准品的熔点和液相色谱对比分析,进一步通过1H NMR谱鉴定为苦杏仁苷。
本实验结合科研和生产,理论与实践相结合,通过改进苦杏仁苷提取关键实验步骤,综合运用大型仪器设备进行产品鉴定,将苦杏仁苷的提取与鉴定设计成新的实验项目,对提高仪器设备使用效率和高校高素质人才培养具有重要实践意义。
基金项目
本工作得到广东省教育厅大学生创新创业训练计划项目(S202111847052)资助。
NOTES
*通讯作者。