1. 引言
乳腺癌(BC)是最常见的癌症,也是女性癌症死亡的主要原因,占全球所有癌症的25%,占癌症死亡的15% [1]。目前乳腺癌的治疗有多种方法,如手术、化疗、内分泌治疗、放疗和靶向治疗等,虽然治疗效果较之前有很大提高,但由于乳腺癌是一种异质性很强的疾病,仍有部分患者很快出现复发及转移。目前临床治疗选择主要基于分子分型和病理分期系统,虽然出现了很多新的预后分子标志物,如PIP [2],CD24 [3],CXCR4 [4] 和AR [5] 等,但有效的个性化乳腺癌治疗仍然难以实现。因此,寻找新的乳腺癌治疗标志物对乳腺癌早期诊断和治疗是有重要作用的。
TMSB15A编码胸腺素β 15A (TMSB15A),是β胸腺素调节蛋白家族的成员 [6]。作为肌动蛋白螯合蛋白,它有抑制肌动蛋白聚合并破坏F-肌动蛋白的形成的作用 [7]。有研究表明TMSB15A在肝癌中的表达明显高于癌旁组织 [8] [9],在再生障碍性贫血患者中显着下调 [10],也是右侧结肠癌与左侧结肠癌基因组中表达显著差异的一个基因 [11],在前列腺癌中也是高度表达,并且与Gleason分级有关,可能是前列腺癌的候选生物标志物 [12]。对子宫内膜癌、卵巢癌和肾上腺皮质癌的预后有预测作用 [13] [14] [15]。但TMSB15A在乳腺癌患者中的具体表达、预后预测作用尚不清楚,还有待进一步阐明。
在本研究中,我们比较了BC和正常组织中TMSB15A mRNA的表达,评估了BC患者的临床特征与TMSB15A mRNA表达之间的相关性。我们使用GSEA分析了TMSB15A参与的主要相关的生物途径。我们的结果表明,TMSB15A是一种有前途的BC诊断和预后生物标志物。
2. 资料与方法
2.1. TMSB15A在泛癌和乳腺癌(BC)各临床特征亚组中的表达
我们从UCSC XENA的癌症基因组图谱(TCGA)数据库和基因型组织表达(GTEx)数据库下载了33种肿瘤类型和正常组织的RNA-seq数据和相关临床数据。TPM (transcripts per million reads)格式的RNAseq数据进行log2转化后进行分析比较。使用Wilcoxon秩和检验检测TMSB15A在泛癌和正常组织,及乳腺癌(BC)各临床特征亚组中的表达差异,p < 0.05被认为具有统计学意义(ns, p ≥ 0.05; *, p < 0.05; **, p < 0.01; ***, p < 0.001)。
2.2. 生存预后分析
我们使用Kaplan-Meier方法评估TMSB15A表达与BC患者预后之间的关系。Kaplan-Meier方法是一种用于估计生存的函数,可分析单个因素及分层控制混杂因素的生存分析方法,是生存分析的常用方法。此外,我们进一步研究了BC不同临床亚组中TMSB15A表达与预后之间的关系。survminer包用于可视化及统计分析。p < 0.05被认为具有统计学意义。
2.3. 基因集富集分析
我们使用GSEA4.1.0软件进行基因集富集分析(GSEA)以分析TCGA队列中高TMSB15A组和低TMSB15A组之间差异基因的富集通路。错误发现率 < 0.25和nom p值 < 0.05的基因集被认为是显著的。
2.4. 统计学分析
所有统计分析使用R (4.0.2版)软件进行,可视化使用ggplot2包。Wilcoxon秩和检验用于比较两组数据的差异,p < 0.05被认为具有统计学意义(ns, p ≥ 0.05; *, p < 0.05; **, p < 0.01; ***, p < 0.001)。
3. 结果
3.1. TMSB15A mRNA在泛癌及乳腺癌各临床亚组中的表达
TMSB15A在泛癌和癌旁正常组织中的mRNA表达差异见图1(A),可见相较于正常组织,TMSB15A mRNA在绝大部分癌症(包括乳腺癌,图1(B))中表达水平显著升高(p < 0.001)。进一步分析其在乳腺癌(BC)各临床亚组中的表达,可见TMSB15A在雌激素受体(ER)阴性,孕激素受体(PR)阴性亚组中表达显著高于阳性亚组(p < 0.001),在人表皮生长因子受体(HER2)阳性亚组中表达水平显著高于阴性亚组,有统计学意义(p < 0.01),在PAM50分子分型中的Basal (三阴性)亚型中表达量最高,显著高于其他所有亚型(均p < 0.05)。
3.2. TMSB15A高表达是BC患者的不良预后因素
TMSB15A表达水平与BC生存关系的Kaplan-Meier分析显示,TMSB15A低表达患者的总生存(OS),疾病特异性生存(DSS)和无进展生存期(PFI)均优于高表达组(图2(A)~(C),p < 0.01)。进一步的临床亚组Kaplan-Meier分析显示TMSB15A在T1-2,T3-4,N1-3,M0,Stage III-IV,年龄 ≤ 60,Luminal B型和绝经后亚组中低表达的患者预后OS均优于高表达患者(图2(D)~(K),p < 0.05)。
3.3. 基因集富集分析(GSEA)
在本研究中,GSEA用于分析TMSB15A高表达和低表达患者之间的显著生物学途径和功能差异。结果显示在TMSB15A高表达患者中主要富集在细胞周期,DNA复制,p53通路和多个代谢通路等肿瘤增殖相关通路(图3)。
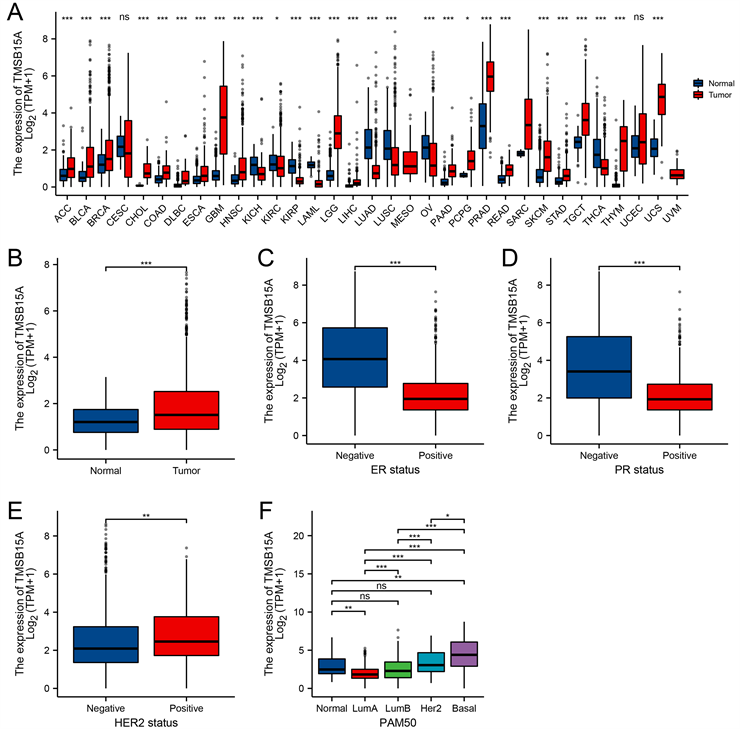
Figure 1. Differences in the expression of TMSB15A mRNA. (A) In pan-cancer and normal tissues; (B) In BC and normal tissues; (C) In ER subgroup; (D) In PR subgroup; (E) In HER2 subgroup; (F) In PAM50 subgroup (p < 0.05).
图1. TMSB15A mRNA的表达差异。(A) 泛癌和正常组织中;(B) BC和正常组织中;(C) ER亚组中;(D) PR亚组中;(E) HER2亚组中;(F) PAM50亚组中(p均 < 0.05)。
4. 讨论
在这项研究中,我们的结果证实TMSB15A mRNA在BC组织中的表达显著高于正常组织,并主要与分子分型中的3个主要分子检测指标(ER, PR, HER2)有关,与其他临床特征如TNM分期,年龄等无明显关联。TMSB15A在Basal乳腺癌,也就是在三阴性乳腺癌中表达量最高,说明了它可能作为三阴性乳腺癌(TNBC)的一个新的治疗靶向。这与先前的研究一致,研究表明在TNBC中TMSB15A的表达显著高于管腔型乳腺癌 [6]。此外,TMSB15A mRNA高表达与较差的OS,DSS和PFI相关,进一步的临床亚组分析显示TMSB15A在所有的T分期,淋巴结转移,无远处转移,病理分期较晚,年轻患者,Luminal B型和绝经后亚组中更加适用,表明TMSB15A确实是BC的一个不良预后预测因素。

Figure 2. Prognostic analysis of TMSB15A mRNA expression. (A), (B), (C) Kaplan-Meier curves of OS, DSS and PFI of patients between high and low expression of TMSB15A group in BC; (D) T1-2; (E) T3-4; (F) N1-3; (G) M0; (H) Stage III-IV; (I) Age ≤ 60; (J) Luminal B subtype; (K) Postmenopausal
图2. TMSB15A mRNA表达的预后分析。(A),(B),(C) BC中TMSB15A高低表达患者的OS,DSS和PFI的Kaplan-Meier曲线;(D) T1-2;(E) T3-4;(F) N1-3;(G) M0;(H) StageIII-IV;(I) 年龄 ≤ 60;(J) LuminalB亚型;(K) 绝经后

Figure 3. Analysis of the main enrichment pathways in patients with high expression of TMSB15A by GSEA method
图3. 用GSEA方法分析TMSB15A高表达患者的主要富集通路
为了研究TMSB15A在乳腺癌中的作用机制,我们进行了GSEA分析显示TMSB15A主要是通过促进DNA复制,细胞周期和代谢及p53等相关肿瘤通路来促进乳腺癌的发生及进展的。此外,先前研究表明TMSB15A基因表达是TNBC对新辅助化疗药物如蒽环,紫杉类和卡铂类治疗反应的阳性预测因子 [6] [16] [17]。并且是原发性乳腺癌中有淋巴结转移和无淋巴结转移的中的一个显著差异基因,说明其在乳腺癌中确实是起重要作用的。TMSB15A还有另一种同种型,命名为TMSB15B,它们在不同的肿瘤细胞系和组织中具有不同的表达模式,这两种基因同种型也受不同的转录调控,并且用转化生长因子β1处理MCF-7乳腺癌细胞抑制了TMSB15A表达 [18]。
总的来说,我们的研究证实了TMSB15A mRNA在BC患者的表达和预后价值。然而,也有一些限制。例如,我们只进行了生物信息学挖掘,我们的结果将来需要在临床样本中进行验证,还有本研究关注的是TMSB15A的mRNA水平,而不是蛋白水平,它在BC中的具体机制有待进一步研究。
5. 结论
TMSB15A mRNA在BC组织中表达升高。而且,较高的TMSB15A表达与BC患者的总生存率较低相关。此外,TMSB15A mRNA的表达是BC独立的预后因素,使其成为未来具有巨大潜力的生物标志物。
基金项目
泰安市科技发展规划(引导计划)项目(2018NS0222)。
NOTES
*第一作者。
#通讯作者。