1. 引言
医疗器械是直接或间接作用于人体的用于医学诊断和治疗的一类医疗设备,医疗器械的发展提高了对疾病的诊疗水平,但同时医疗器械也是重要的微生物病原菌传播载体,在使用过程中可能引发细菌菌落定植,诱发更严重的局部感染和全身感染。据统计,2002年美国发生医疗相关感染(healthcare-associated infections, HAI)达700万例,与病原体相关因素的众多研究表明,其中至少55%~70%的医疗相关感染与医疗器械感染有关。而根据世界卫生组织(WHO)提供的《院内感染防治实用手册》相关数据显示,全世界每天有超过1400万人发生院内感染,其中60%的细菌感染不良事件与医疗器械感染相关 [1] [2]。与此同时HAI具有较高的死亡风险,在一项五年期意外住院死亡病例研究中,这些意外死亡中有31%与HAI有关 [3]。总之医疗器械相关感染已成为威胁患者安全、降低医疗质量和增加医疗成本的重要原因,如何使医疗器械在临床应用中发挥最佳性能的同时避免随之而来的感染风险具有重要意义。
对医疗器械表面改性赋予其抗菌功能是解决该类接触界面感染问题的有效途径。通过赋予材料表面抗菌性能,既能减小全身系统性给药的依赖性和药物副作用,同时减少临床实践中的感染风险,在实验研究中或临床应用上均取得了良好的效果。迄今为止,多种抗菌物质已被广泛地运用到抗菌涂层设计中。比如金属离子和金属纳米粒子(银、铜等),抗生素(氯己定、利福平等),天然抗菌剂(壳聚糖、植物多酚等),有机合成抗菌剂(季铵盐类等),一氧化氮(NO),抗菌肽等。Fu J等人报导了层层自组装制备了含银纳米颗粒的抗菌多层薄膜,用1,6-己二胺对PET膜进行氨解引入氨基,将壳聚糖–硝酸银络合物和肝素交替沉积在经氨解的PET膜表面,随后利用抗坏血酸还原多层膜中的银离子以形成银纳米颗粒 [4]。H Phuengkham等人在体液接触器械表面包覆负载氯己定的纳米球(CHX NPs)来维持氯己定(CHX)的释放。其采用高压乳化溶剂蒸发技术制备氯己定纳米粒子,并将其喷涂在硅酮表面制备负载氯己定的纳米球 [5]。Liu等人通过单宁酸(TA)和苯扎氯铵(BAC)一步静电组装,在医用导管的管腔和外表面合成了疏水性单宁酸(TBA)的稳定无色涂层,具有较好的抗菌活性和生物相容性 [6]。M D’Almeida等人以三乙氧基硅丙基丁二酸酐(TESSA)为偶联剂,在钛合金表面接枝壳聚糖赋予其抗菌活性 [7]。He W等人制备了一种结合了以季铵盐为抗菌上层和聚乙二醇(PEG)为防污下层的表面结构 [8]。Jones等人发现NO会促使细菌肌苷5'-单磷酸脱氢酶失活,导致GTP急剧消耗,无法给FtsZ蛋白组装成环提供能量,从而抑制细菌分裂繁殖 [9]。尽管这些策略都取得了不错的研究进展,然而一些问题仍然尚未解决:例如金属纳米粒子及重金属离子在人体内的代谢毒性及对环境的潜在威胁;抗生素的滥用会增加细菌的耐药性造成人体的药物依赖及超级细菌的产生;抗污涂层只能被动防止细菌的沉着和定植而不能避免细菌向人体其他部位转移;多酚类化合物对致病菌的抑菌作用是高度异质性的,依赖于具体菌株 [10]。同时涂层制备过程复杂且效率不高都是制约研究成果转化的关键因素。因此,构建一种简单高效无毒副作用且无耐药性的抗菌涂层技术是有效抑制医疗器械感染的重要研究方向,具有重要的临床意义和应用前景。
自然界中许多生物可以通过分泌多种抗菌多肽和抗菌蛋白来杀死细菌维持系统稳态避免感染 [11],而溶菌酶作为一种广泛存在于包括哺乳动物唾液、泪、血浆等生物组织中天然抗菌蛋白,是生物机体对抗外源病原菌侵袭的重要防御因子。溶菌酶可以水解破坏细菌细胞壁中的N-乙酰胞壁酸和N-乙酰氨基葡糖之间的β-1,4糖苷键,导致细菌细胞壁破坏使内容物流出,从而造成细菌的死亡 [12] [13]。更重要的是,目前的研究发现大多数细菌对于抗菌多肽以及抗菌蛋白还未表现出明显的耐药特性 [14]。因此,将该类天然抗菌分子应用到抗菌涂层中有独特的优势和潜在应用前景。
基于此,我们报导一种基于贻贝黏附灵感及共价固定具有抗菌活性功能分子的抗菌表面构建策略。受贻贝强大的黏附能力所启发,贻贝足丝通过分泌黏附蛋白使其牢固黏附在岩壁上,黏附蛋白中存在大量的3,4-二羟基苯丙氨酸(3,4-dihydroxyphenyalanine, DOPA) [15] [16] [17]。如图1所示,DOPA中邻苯二酚官能团通过自身或氨基的协助下实现在有机物、无机物以及金属等不同材料表面的高效黏附,而且儿茶酚基团经氧化后形成单体或低聚物(如醌,5,6-二羟基吲哚等)聚集的超分子聚集体,通过非共价相互作用(例如氢键、电荷转移、π-π堆积和阳离子-π)组装形成致密的涂层 [18] [19] [20]。此外,DOPA分子提供了大量具有反应活性的胺基和羧基官能团,为DOPA涂层二次接枝生物活性功能分子提供了可能 [21]。

Figure 1. Schematic diagram of DOPA-LZM coating deposition
图1. DOPA-LZM涂层制备示意图
在DOPA涂层的基础上,选取溶菌酶为抗菌活性功能分子,通过碳二亚胺化学来实现溶菌酶在DOPA涂层表面的有效固定。如图1(a)所示,使用碳二亚胺EDC和Sulfo-NHS将DOPA涂层的羧基与溶菌酶伯氨基进行交联。EDC作为一种零长度交联剂,在弱酸性(pH = 5.6)条件下,它能使羧基(-COOH)与伯氨基基(-NH2)直接偶联形成酰胺键 [22] [23]。由于蛋白质通常含有多个伯氨基,EDC介导的交联通常会造成蛋白质与羧基的随机偶联。而Sulfo-NHS的加入可生成稳定的中间体从而提高偶联效率。反应过程中EDC与羧酸基团反应形成活性O-酰基异脲中间体,在NHS的存在下EDC使NHS与羧基偶联,形成比O-酰基异脲中间体稳定许多的具有氨基反应性的NHS酯中间体,该中间体易于被溶菌酶中伯氨基团亲核攻击并取代,发生有效偶联,从而在DOPA涂层表面共价固定溶菌酶分子。
2. 材料与方法
2.1. 试剂与仪器
本实验中,鸡蛋清溶菌酶(egg white Lysozyme),MES (2-(N-morpholino) ethanesulfonic acid hydrate),左旋多巴(3,4-dihydrox yphenyalanine, DOPA),EDC (N-(3-dimethylaminopropyl)-N'-Ethylcarbodiimide),NHS (Nhydroxysuccinimide),Tris-HCl,酸性橙II (AO II),甲苯胺蓝(Toluidine Blue O; TBO)购自Sigma-Aldrich,琼脂培养基,液体培养基购自苏州高新生物技术有限公司中国,表皮葡萄球菌(S. epidermidis)菌株ATCC 6538和革兰氏阴性大肠杆菌(E. coli)菌株ATCC 25922购自上海微生物保藏中心。
红外光谱数据由Nicolet 5700测得,酶标仪为Bio-tek instruments Inc mQuant,水接触角由Krüss GmbH DSA 100 Mk 2测得,椭圆偏光仪为J.A. Woollam M-2000V,SEM由JSM 7800F测得。
2.2. 抗菌蛋白涂层的制备
称取一定量的左旋多巴粉末用Tris缓冲溶液(pH = 8.5)配制为1 mg/mL的左旋多巴溶液。
将洗净的10 mm × 10 mm的316 L不锈钢薄片放入24孔板,每个孔板加入1 mL的左旋多巴溶液,在25℃,有氧条件下沉积24小时,将316 L不锈钢薄片用RO水洗净,氮气吹干备用。
重复上述步骤再次沉积得到DOPA涂层。
称取一定量的EDC和NHS粉末,加入MES缓冲溶液(pH = 5.6),使EDC和NHS的最终浓度分别为0.23 mg/mL和0.4 mg/mL,配制得到EDC和NHS混合溶液。
将经过DOPA改性的不锈钢薄片放入24孔板,每个孔板加入0.5 mL的EDC和NHS混合溶液,在37℃条件下孵育30分钟活化羧基。
称取一定量的鸡蛋清溶菌酶(LZM),用MES缓冲溶液(pH = 5.6)配制1 mg/mL的溶菌酶溶液。
在活化完的反应液中加入0.5 mL的溶菌酶溶液,在37℃条件下反应8小时。将316 L不锈钢薄片用RO水洗净,氮气吹干即可得到抗菌蛋白涂层(DOPA-LZM)。
2.3. 涂层宏观形貌和表面性质分析
2.3.1. 水接触角
静态水接触角采用KrüssGmbH DSA 100 Mk 2接触角测定仪进行检测。在常温下,将5 μL的up水滴于样品表面,待液滴稳定时,拍取液滴图片,并用DSA 1.8软件进行接触角分析。
2.3.2. 厚度分析
采用光谱型椭偏仪(M-2000V, J.A. Woollam, USA)进行薄膜厚度检测。在波长370~1000 nm测定的Δ和Ψ值,采用柯西(Cauchy)分析模式计算薄膜厚度。
2.3.3. 表面形貌
涂层表面形貌由型号为JSM 7800F的扫描电子显微镜测得。
2.4. 涂层表面化学结构分析
2.4.1. 涂层表面官能团密度检测
羧基官能团定量检测:采取甲苯胺蓝(Toluidine Blue O;TBO)法测定表面羧基密度。首先用pH为10的氢氧化钠溶液配制浓度为4 × 10−5 M的TBO溶液,在每个样品表面加入100 μL的TBO溶液,在37℃条件下孵育6小时。孵育完毕后用pH值为10的氢氧化钠溶液充分清洗后干燥。在干燥好的样品中加入1 mL的50 wt%的醋酸在37℃条件下孵育30分钟,随后吸取150 μL置于96孔板中,使用酶标仪在631 nm下测试其吸光度值。同时,配制一定浓度的TBO溶液梯度稀释后在631 nm吸收波长下测定其吸光度值,绘制标准曲线,并于标准曲线拟合方程计算样品表面羧基官能团的密度。
氨基官能团定量检测:首先在样品表面加入pH值为3浓度为500 nM的100 μL的酸性橙II (AO II)溶液,在25℃条件下孵育12小时。孵育完毕后用pH值为3的盐酸清洗并干燥。在干燥好的样品中加入pH值为12的1 mL的NaOH溶液,在25℃条件下孵育30分钟,待残余的AO II解离完全后吸取150 μL解离液放入96孔板中,在485 nm吸收波长下用酶标仪测定其吸光度值。同时,配制一定浓度的AO II溶液梯度稀释后在485 nm吸收波长下测定其吸光度值,绘制标准曲线,并于标准曲线拟合方程计算样品表面氨基官能团的密度。
2.4.2. GATR-FTIR检测
将样品制备在金片表面并采用掠角衰减全反射傅里叶变换红外光谱(GATR-FTIR)检测样品表面化学结构。
2.5. 表面抗菌实验
根据ISO 22196-2011评估涂层的抗菌活性。选择革兰氏阳性表皮葡萄球菌(S. epidermidis)菌株ATCC 6538和革兰氏阴性大肠杆菌(E. coli)菌株ATCC 25922进行抗菌实验。首先,培养菌株获得单克隆菌落,刮取一个菌落用液体培养基培养12小时并稀释至数量为6 × 105 mL−1。然后,把经紫外线消毒样品后放置在无菌培养孔板中。每个孔板添加0.1 mL稀释菌液并使其均匀分布在样品表面,用一片聚乙烯薄膜覆盖。在37℃ ± 1℃和不低于90%的湿度下培养24小时。在每个孔板中添加1 mL生理盐水并吸管反复吹打,使样品和覆盖膜上的细菌完全冲洗下来。最后吸取100 μL细菌悬浮液均匀涂于琼脂平板,在35℃ ± 1℃和不低于90%的湿度下培养24小时。24 h后,对培养基表面的菌落拍照并计数。用公式
计算抗菌率,其中NC和N分别代表对照样品和涂层样品上的菌落数。
样品表面细菌形态观测的前部分步骤与上述相同,当细菌在样品表面培养培养24小时后取出样品,轻微漂洗后加入5% wt的戊二醛固定细菌保持12小时,干燥后喷金,通过SEM观察样品表面细菌形态。
3. 结果与分析
3.1. 涂层基本性质
涂层宏观颜色变化与水接触角的变化是聚多巴胺类涂层是否制备成功的显著特征。如图2(a)所示为不锈钢圆片经不同涂层表面改性后在自然光下所拍摄的照片。不锈钢圆片沉积多巴涂层后呈现明显的黄褐色,而再进一步接枝溶菌酶分子后其颜色发生明显变化,呈现出浅黄色。其次水接触角测定仪测量涂层表面亲疏水性变化结果显示,裸基底316 L不锈钢表面的水接触角范围在73.4˚ ± 0.5˚,而经左旋多巴沉积后的DOPA涂层表面的水接触角降低到了54.1˚ ± 0.7˚,这归因于DOPA涂层引入了大量的亲水性酚羟基、醌、氨基及羧基。但在接枝溶菌酶之后,DOPA-LZM涂层表面的水接触角又增加到了77.2˚ ± 0.4˚,这可能是在涂层沉积及干燥过程中,为了降低体系能量,使表面能降低,溶菌酶表面亲水域更靠近DOPA涂层一侧,而疏水域更倾向于暴露在空气一侧,同时在接枝过程中,蛋白质分子逐渐掩盖了次表层的亲水基团,从而使涂层体现出疏水的性质。

Figure 2. (a) Macroscopic morphology and water contact angle of coating; (b) Thickness of coating
图2. (a) 涂层的宏观形貌和水接触角;(b) 涂层厚度
为了进一步确定涂层的成功制备以及观察涂层表面性质的变化,通过椭偏仪测定涂层的厚度,结果如图2(b)显示,DOPA涂层的厚度为26.7 nm,而接枝溶菌酶后厚度有所增加,DOPA-LZM涂层厚度达到了44.6 nm,厚度增长了67%。
通过SEM观察涂层微观形态,结果如图3所示,DOPA-LZM涂层表面有少许蛋白颗粒黏附。

Figure 3. The microstructure of coating was observed by SEM
图3. 扫描电镜观察了涂层的微观形貌
3.2. 涂层表面化学结构分析
材料表面具有反应性的官能团是实现生物分子共价固定的前提条件,通过甲苯胺蓝(Toluidine Blue O; TBO)法和酸性橙II (AO II)染色法可以确定DOPA涂层及其接枝溶菌酶分子后表面-COOH和-NHx官能团密度。甲苯胺蓝(Toluidine Blue O; TBO)是一种常用的醌亚胺染料,其主要含有胺基和醌型苯环两个发色团,从而成色原显色。甲苯胺蓝中的阳离子有染色作用,其中的阳离子与酸性物质以大致1:1的比例相结合而被染色。甲苯胺蓝还含有两个助色团,能促使染料产生电离成盐类,帮助发色团对组织产生染色力。而酸性橙II染色法是利用酸性橙II的负电磺酸基团与表面正电位氨基进行大致的1:1结合,可以测得涂层表面氨基量,与传统染料(如考马斯亮蓝)相比,它较低的空间位阻,能够在较大的氨基表面密度范围内提供更可靠的基团定量 [24]。基团密度定量结果如图4(a)所示,DOPA涂层表面-COOH和-NHx官能团分别为3.2 nmol/cm2和2.7 nmol/cm2,意味着DOPA涂层具有了利用表面羧基和氨基进行二次接枝的实用价值。而接枝溶菌酶后DOPA-LZM涂层其表面-COOH官能团变化略微降低到2.9 nmol/cm2,DOPA涂层的-COOH官能并未被消耗的原因是溶菌酶肽链侧基依然具有大量的羧基基团补充了其消耗量。此外DOPA-LZM涂层表面–NHx官能团大大增加,达到了7.2 nmol/cm2,这是由于溶菌酶含有大量肽键以及胺基侧基所导致,证明了溶菌酶分子的成功接枝。总之涂层表面官能团定量结果证明了DOPA涂层表面二次接枝生物功能分子的可能性以及DOPA-LAM涂层的成功制备。

Figure 4. (a) Functional group density of coating surface. (b) GATR-FTIR of coating
图4. (a) 涂层表面的官能团密度;(b) 涂层的傅里叶全反射红外光谱
利用GATR-FTIR对涂层表面化学结构和组成进行检测。结果如图4(b)所示,经左旋多巴沉积后,涂层在1604 cm−2出现了C=O的伸缩振动峰,证明了DOPA涂层的成功构建。在接枝溶菌酶后,涂层在2936 cm−2出现了蛋白质甲基和亚甲基侧基的对称或不对称伸缩振动峰,在1662 cm−2附近出现了蛋白质酰胺Ⅰ带C=O伸缩振动峰,在1546 cm−2附近出现了酰胺II带N-H弯曲振动峰,而在1213 cm−2附近出现了酰胺Ⅲ带C-N伸缩振动峰。以上结果进一步证实了DOPA-LZM涂层的成功制备。
3.3. 抗菌实验
涂板法抗菌评价是根据国际标准(ISO 22196-2011)改进的一种较为常见的评价涂层抗菌性能的表征手段。将菌液添加到评价材料表面,菌液内细菌在沉降、自身运动或布朗运动的作用下使得菌体与材料表面直接接触,从而可以直接评价材料的表面状态对细菌的影响,表征材料表面的抗菌性能。本实验选用的表皮葡萄球菌和大肠杆菌是典型的革兰氏阳性和革兰氏阴性菌。通过涂板法如图5(a)评价DOPA涂层和DOPA-LZM涂层对两种细菌的抗菌性能。菌落计数结果如图5(b)所示,结果显示DOPA涂层几乎没有抗菌效果,而对于DOPA-LZM涂层,其对表皮葡萄球菌和大肠杆菌的抗菌率分别为97.3%和81.4%。
DOPA-LZM涂层对葡萄球菌具有较高的抗菌效果,而其对大肠杆菌的抗菌效果有所降低。从溶菌酶的抗菌作用机理来看,鸡蛋清溶菌酶分子呈椭圆形结构,其椭圆形体上有一条明显的狭长裂缝为溶菌酶的活性中心。研究表明,活性中心的狭长裂缝内含有6个单糖的结合位点(A-F),当溶菌酶发挥胞壁质酶活性作用时,细菌细胞壁肽聚糖糖链正好嵌入椭球形上的裂缝,溶菌酶“抓住”糖链并沿其移动,致使所有的糖苷键被打断 [25]。因此,溶菌酶特殊的空间结构和催化特点决定了溶菌酶对不同细菌具有不同的细菌肽聚糖骨架分解能力。对于革兰氏阳性菌溶菌酶可充分发挥其胞壁质酶活性分解细菌,而对于兰氏阴性菌,由于其细胞壁外额外包覆着一层厚约8 nm的脂多糖外膜,外膜的存在阻碍溶菌酶活性中心与肽聚糖糖链的直接接触,使得溶菌酶对革兰氏阴性菌的杀灭能力有所降低。
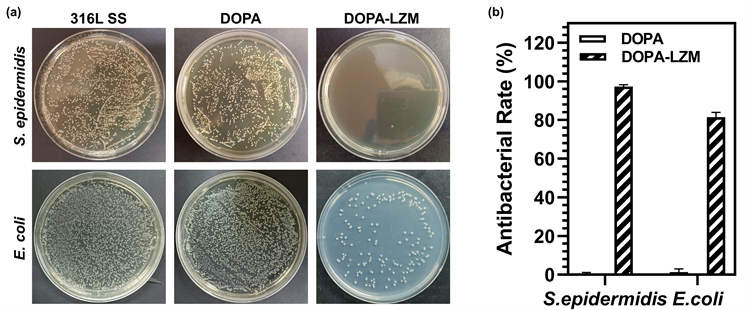
Figure 5. (a) The colonization photographs of bacteria; (b) Antibacterial rate of coating
图5. (a) 涂板法细菌培养照片;(b) 涂层的抗菌率
利用SEM可以观察样品表面粘附细菌形态,推测抗菌物质与细菌的相互作用。结果如图6所示,对照组316L不锈钢和DOPA涂层上大肠杆菌及表皮葡萄球菌的菌体形状光滑,菌膜未出现明显异常。而在DOPA-LZM涂层中,大肠杆菌及表皮葡萄球菌发生显著形变,整体表现为皱缩形态,且菌膜均出现孔洞结构并伴随少量内容物流出,这可能是溶菌酶与菌膜作用使菌膜破裂穿孔,细菌内容物流出导致细菌死亡。
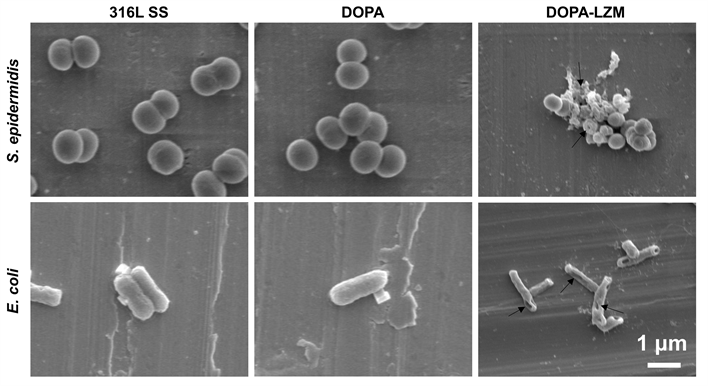
Figure 6. SEM was used to characterize the surface bacterial morphology of the samples
图6. 样品表面细菌形态SEM图
抗菌评价结果证实DOPA涂层表面共价固定溶菌酶能充分发挥生物分子的功能特性,DOPA-LZM涂层能有效杀灭常见病原菌,特别是对革兰氏阳性菌有较强的抗菌能力,有望减少医疗器械感染病发率。
4. 总结
我们报导了一种基于贻贝黏附灵感及共价固定生物活性功能分子的抗菌表面构建策略。使用左旋多巴改性基底引入具有二次接枝活性的官能团,并采用碳二亚胺化学成功在其表面共价固定具有抗菌生物活性的溶菌酶分子,探究了涂层的基本性质及表面化学组成,并对其抗菌功能进行验证,结果显示DOPA-LZM涂层对表皮葡萄球菌和大肠杆菌有较好的杀灭效果。本研究为医疗器械抗菌表面涂层设计提供了新的方法,同时也为生物活性功能分子的共价固定提供了新的思路。
基金项目
南方医科大学附属东莞医院高层次人才支持与发展计划(项目号:K202102);
国家自然科学基金(项目号:82072072);
四川省国际科技创新合作项目(项目号:2021YFH0056)。
NOTES
*通讯作者。