1. 引言
药物警戒(Pharmacovigilance, PV)这一专有名词,最早于20世纪70年代由法国人提出,当时无明确定义,与药品不良反应监测并无显著差异 [1]。2002年,世界卫生组织(WHO)首次将药物警戒完整定义为:发现、评价、理解和预防不良反应或其他任何可能与药物有关问题的科学研究与活动 [2]。这个定义不仅包括收集和评估疑似药品不良反应的自发病例报告,还包括药物流行病学研究 [3]。药物警戒工作涉及药物研发至上市后的风险管理,紧紧相扣,其最终目的是保障公众合理用药,提升公众用药安全。目前,共有143个国家成为世界卫生组织国际药物监测规划的成员,另外28个准成员国正处于建立药物警戒系统的初期阶段,为正式成员资格做准备 [4]。
2019年新版中国《药品管理法》第十二条规定:国家建立药物警戒制度,对药品不良反应及其他与用药有关的有害反应进行监测、识别、评估和控制 [5]。该制度的提出,意味着我国从药品不良反应监测制度逐步升级为药物警戒制度,随后,2021年05月中国发布《药物警戒质量管理规范》,也进一步表明我国对实施药物警戒工作的决心。美国药物警戒体系经过多年探索已相对成熟,我国可借鉴其实施情况,结合我国自身现状,构建适合我国的药物警戒体系。
2. 美国药物警戒体系介绍
美国对药品安全的监管是世界各国所公认最为严格的,也是最早开展药物警戒工作的 [6]。经过多年探索,现今的美国药物警戒体系已有健全的法律法规、明确的组织架构、完善的监测方式,涵盖了药品整个生命周期的监管。
2.1. 法律法规历程
1936年,《联邦法规》 [7] (Code of Federal Regulations, CFR)的编纂给美国带来了重要影响,该法则在美国具有广泛实用性和执法效应。CFR共有50章节,21章涉及药物警戒内容。1938年《联邦食品、药品和化妆品法》 [8] (Federal Food, Drug, and Cosmetic Act, FD&C Act)在美国国会上批准执行,授权美国食品药品监督管理局(FDA)对食品、药品和化妆品安全性和有效性进行监督的法律。在355部分对药物警戒工作提出了要求,FDA需建立药品信息网站,并包含以下各项:药品标签与说明书、药品最新安全信息和警报、风险评估和缓解策略的信息、与药品安全有关的指导文件和规定等等,从而提高信息透明度,使大众有效获取药品安全信息。此后,为进一步推动药物警戒发展,美国与欧盟、日本成立人用药品注册技术要求国际协调会(ICH),在不同时期内推出ICH E2系列原则,拟解决上市前至上市后的药物警戒活动问题(见表1)。FDA还推出上市后药品风险管理指南,指导制药企业开展工作,如《药物警戒管理规范和药物流行病学评估指南》 [9] 及2019年的《REMS计划和报告指南》 [10] 等。

Table 1. ICH E2 guidelines related to pharmacovigilance
表1. 药物警戒相关ICH E2系列原则
2.2. 组织架构
美国食品药品监督管理局(FDA)属于卫生与公共服务部门,药品审评和研究中心(CDER)作为FDA的一部分,负责日常药物警戒方面工作,包括药品上市前的审批和上市后的监管,是全国独有的药物警戒中心 [11]。随着药品审评工作的不断完善,该中心成立的部门已达13个 [12],如中心主任办公室、沟通交流办公室、合规办公室等。其中,监测与流行病学办公室(Office of Surveillance and Epidemiology, OSE)在药物警戒工作中发挥着重要角色 [13],主要任务有以下几个方面:监测药物、评价安全性、与药企合作交流,减少药品标签、包装有关的用药错误、制定和实施风险管理措施。OSE每年会向FDA的MedWatch (自愿报告项目)提交超过200万例不良事件报告,其下设有药物警戒与流行病学办公室(Office of Pharmacovigilance and Epidemiology, OPE)、预防用药错误与风险管理办公室(Office of Medication Error Prevention and Risk Management, OMEPRM) (见图1)。
2.2.1. 药物警戒与流行病学办公室(OPE)
药物警戒与流行病学办公室(OPE)设有药物警戒部(I、II)、流行病学部(I、II)。药物警戒部的工作人员针对所有上市药物和治疗用的生物制品监测其安全信号并评价安全性相关问题。通过使用不同的监测手段,如不良事件报告、已发表的科学文献等,进行科学评估,确保上市的药品能够安全使用;流行病学部的流行病学专家使用专用系统对药物进行监测,审评药企上市后要求和承诺的与药物安全相关的流行病学研究方案和报告,帮助FDA提高监测影响能力。
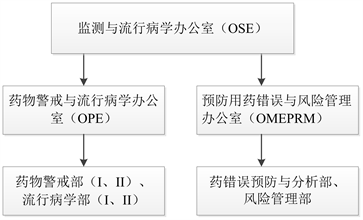
Figure 1. Agencies under the Office of Surveillance and Epidemiology (OSE)
图1. 监测与流行病学办公室(OSE)下设机构
2.2.2. 预防用药错误与风险管理办公室(OMEPRM)
预防用药错误与风险管理办公室(OMEPRM)分为预防用药错误与分析部(DMEPA)、风险管理部(DRM)。DMEPA职责是减少与CDER规定的药品命名、标签、包装或设计相关的使用错误,提高药品使用性,并监测分析上市后药品的用药错误报告。DRM是CDER风险管理活动中的重点,负责制定和实施风险管理计划。
2.3. 监测方式
2.3.1. FDA不良事件报告系统(FDA Adverse Event Reporting System, FAERS)
早期的不良事件报告和用药错误事件由医务人员、消费者和制药企业自发向美国不良事件报告系统(FAERS)上报,FAERS是一个储存超过400多万份病例报告数据库 [14],数据信息结构按照ICH E2B发布的国际安全报告指南执行 [15] [16],对于不良事件和用药错误的术语均使用MedDRA编码 [17]。FAERS中的报告由药品审评和研究中心(CDER)与生物制品审评和研究中心(CBER)的工作人员审查,保证上市后的安全性。虽然FAERS是一个公开数据库,可让大众免费进入,但在监测过程中存在一些局限性,如存在重复报告、无法通过报告确定发生率、从数据收集到发布数据滞留时间较长以及公开发布的文件格式不易操作等。
2.3.2. “哨点行动”计划(Sentinel Initiative)
2007年,国会要求FDA建立快速识别产品相关性并进行验证的系统。FDA可与大众、学术研究者和私人团体合作,共同开发该系统。2008年5月FDA启动“哨点行动”计划(Sentinel Initiative),评估产品安全性的同时还能保护患者隐私。2009年,FDA进行第一阶段方案“迷你哨点(Mini-Sentinel)”试点,旨在测试可行性及开发建立这一套体系所需要的科学方法。2016年,“哨点行动”正式纳入FDA监管计划。经过不断完善与发展,2019年9月,FDA在“哨点行动”计划中新增三个协调中心 [18]:哨点运营中心(Sentinel Operations Center)、创新中心(Innovation Center)及团体建设与推广中心(Community Building and Outreach Center),其主要目的是扩大公众了解“哨点行动”,提高产品上市后安全性能力。
3. 中国药物警戒体系现状
中国药物警戒工作起步较晚,早期从事于药品不良反应监测,2017年6月1日,中国加入国际人用药品注册技术协调会(ICH),2018年1月25日,食品药品监管总局发布《关于适用国际人用药品注册技术协调会二级指导原则的公告》 [19],首次采用ICH指导原则。ICH指导原则共有四大类:质量性(Quality)、安全性(Safety)、有效性(Efficacy)和多学科性(Multidisciplinary),其中药物警戒内容在E2系列。
3.1. 法律法规历程
1999年11月,《药品不良反应监测管理办法(试行)》 [20] 的出台,使我国对药品不良反应监测有了初步认识;2001年12月1日《药品管理法》第71条要求,国家实行药品不良反应报告制度,意味着我国对药品不良反应监测有了明确规定,也体现了国家对药品不良反应监测重视程度;2018年9月,国家食品药品监督管理局发布《关于药品上市许可持有人直接报告不良反应事宜的公告》 [21],要求持有人承担药物警戒主体责任;2019年,新修订的《药品管理法》中规定:国家建立药物警戒制度,这一制度比药品不良反应监测涉及范围更广、更全面;2021年05月国家药监局发布关于药物警戒配套文件《药物警戒质量管理规范》 [22],全文共9章,2~7章对持有人开展药物警戒活动进行规定,要求持有人建立药物警戒体系并确保符合法律法规要求;8章则为临床试验期间药物警戒活动的规定,申办者需落实安全风险管理主体责任,降低风险最小化,保护受试者安全。随着我国相应的药物警戒法律法规出台,为我国药物警戒体系达到一流水平奠定了基础。
3.2. 组织架构
我国上市前的药物警戒工作由国家药品监督管理局药品审评中心(CDE)负责,承担药物临床试验和药品上市许可的办理及审评。国家药品监督管理局药品评价中心(国家药品不良反应监测中心)负责上市后的工作,对全国药品不良反应报告监测,制定药品不良反应技术标准和规范,以及对地方各级药品不良反应监测机构进行技术指导。各省份不良反应监测中心承担行政区域内不良事件报告并定期汇报上级部门(见图2)。

Figure 2. Organizational structure of pre/post marketing pharmacovigilance in China
图2. 国内上市前/后药物警戒工作组织架构
3.3. 监测方式
20世纪80年代之前,只能通过医务人员发表在医学杂志上获知药品不良反应,用于内部交流;1984年,《药品管理法》颁布实施,由于条件有限,只有几家医疗机构试行药品不良反应监测工作;1989年,国家级药品不良反应监测中心成立,指定相关医疗机构作为定点监测单位 [23];1999年,各省、市及地方相继成立药品不良反应监测中心,主要负责管辖内的药品不良反应事件并收集汇总,上报给国家局;2001年,国家药品不良反应监测信息网络运行 [23],除配备基础录入信息外,还能进行相关性评价、自动汇总不良事件报告,并与国际药品监测中心合作交流,改变了以往人工逐一上报模式;2012年,国家药品不良反应监测系统成立,药品不良事件主要由医疗机构、药品生产企业和经营企业或个人报告给该系统。根据2020年国家药品不良反应监测年度报告,医疗机构上报率占大部分,个人报告比相对较低 [24] (见图3)。
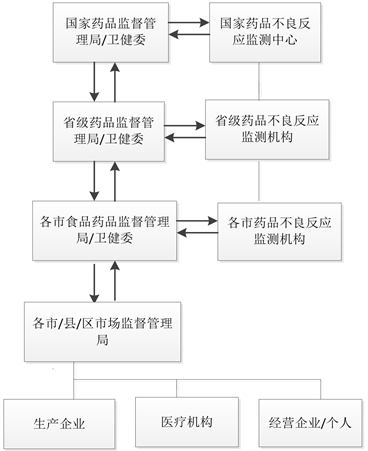
Figure 3. Flow diagram of monitoring method
图3. 监测方式流程图
4. 分析比较
美国与中国在法律法规、组织架构及监测方式上都有所不同(见表2),具体包括:1) 法律法规:美国已较早发布关于药品风险管理指南,在处置措施上相对完善,中国缺少系统性指导;2) 组织架构:美国药品上市前后均由药品审评和研究中心(CDER)参与负责,中国由不同部门进行监管;3) 监测系统:美国通过多数据源建立了大范围的监测系统,覆盖人群广、信息量大,中国医院药物警戒系统(Chinese Hospital Pharmacovigilance System, CHPS)处于初期阶段,在数据处理、评估、共享等方面还需改进。

Table 2. Comparison of the implementation of pharmacovigilance in the United States and China
表2. 美国与中国药物警戒实施情况比较
5. 建议
我国医药产业发展迅速,已成为世界第二大药品市场。因此,优化药品审评审批、深化学习药品全生命周期监管理念,探索出一条适合我国的药物警戒体系是必然选择。
5.1. 完善组织架构,推进我国药物警戒持续发展
目前,我国药品上市前和上市后的药品安全问题由不同部门进行监管,药品审评中心主要负责对药品上市前进行评价,药品不良反应监测中心对药品上市后的安全性进行评价,部门之间缺乏沟通机制。随着越来越多的新药获得药监部门批准,部门协同合作交流,将使药品安全性得到有效评估与控制。
5.2. 多维度利用CHPS,降低药品安全风险
2016年,中国医院药物警戒系统启用,从事于医疗机构的不良事件上报,该系统既能主动监测,还能对药品风险进行提示,降低药品不良反应。利用CHPS系统向持有人与申办者共享药品安全监测数据,通过监测、识别、评估和控制药品不良反应,保护和促进公众健康。
5.3. 加强培养药物警戒专业人才,保障药品安全
我国从事药物警戒工作时限较晚,从业人员的专业水平有待提升,制约了我国药物警戒行业可持续发展。重视人才培养,规范从业人员专业化水平,保障产学研平台的发展和企业规范化运行,是促进我国药物警戒发展的重要举措之一。目前,国家药品不良反应监测中心与南京医科大学、重庆医科大学共同成立药物警戒研究院,搭建了人才培养平台,推动药物警戒制度实施。随着各大高校陆续关注药物警戒发展,在未来的道路上,我国专业人才队伍将极大改善,更加适应、满足监管部门和制药企业需求。
5.4. 大力宣传和培训,提升持有人与公众参与
我国不良事件报告数量一直呈增长趋势,但持有人、个人报告统计量,相比发达国家还有所差距。结合现有基本情况,可以从以下几个方面入手:1) 针对持有人方面:监管部门作为行政主体,定期对持有人开展药品不良反应监测培训工作,实行奖惩制度,强化持有人上报药品不良反应责任;其次,持有人在高效实施药物警戒体系工作环节中还有所薄弱,缺乏专业指导,建议监管部门深入调研,为持有人提出切实可行的指导方针,调动持有人积极性,既能充分保障群众用药安全的同时,也能提升持有人主体责任意识;2) 针对公众方面:公众作为药品消费者,能够直观反映出药品对身体产生的作用,但由于对药品不良反应认识度不高,大多都未能及时上报。监管部门利用互联网平台,积极开展宣传工作,让公众了解何为药品不良反应及上报途径有哪些。我国监管部门可采纳公众号、小程序等软件,简化上报程序,鼓励公众参与。
NOTES
*通讯作者。