1. 前言
宫颈癌是女性恶性肿瘤的第二大杀手,近些年其发病率趋于年轻化,病死率也处于上升态势 [1],而晚期宫颈癌的预后差是死亡率高的最主要因素。所以宫颈癌疾病的发生发展,逐渐成为临床医生的研究目标,其中侵袭转移成了重中之重 [2] [3]。目前,宫颈癌疫苗的广泛应用提供预防策略。但仍有宫颈癌晚期患者预后极差,生活质量低下等问题有待解决,宫颈癌侵袭转移与预后存在正相关,现阶段对于宫颈癌侵袭转移方面的研究尚无定论。1996年Lee找到kiss-1基因,它分离自黑色素瘤细胞,至此一个新的肿瘤抑制基因诞生,它分子量为15.4 KD,且位于染色体1q32,共有771个碱基单位组成,编码第164个氨基酸单位残基,也称作转移抑素(metastin) [4] [5] [6]。多篇国外文献中提及KiSS-1基因在恶性肿瘤中有显著抑制作用,尤其体现在肿瘤的侵袭转移过程中的抑制作用,kiss-1最为一个新的肿瘤抑制基因在多个领域已被证实其抑制作用 [7] [8] [9] [10] [11]。然而Kiss-1基因在宫颈癌中的抑制作用一直鲜有人探讨研究。本文旨在研究过表达Kiss-1基因对宫颈癌SiHa细胞侵袭和转移的影响,并进一步探讨其抑制肿瘤细胞的工作机制,为kiss-1成为新的靶向治疗提供理论依据。本次研究经医院伦理委员会批准。
2. 资料与方法
2.1. 细胞培养
使用购自于北京中国科学院细胞库的宫颈癌细胞SiHa,用百分之十的胎牛血清和100 U/ml青霉素链霉素的培养基进行宫颈癌SiHa细胞培养,置于培养箱维持37摄氏度,每隔1天更换新鲜培养基。充分胰蛋白酶消化,并收集细胞进行传代。实验选取的细胞均保证为对数生长期的宫颈癌细胞。
2.2. 主要试剂
KISS-1、E-cadherin、Vimentin及β-actin单克隆抗体均是美国Santa Cruz公司产品,碱性磷酸酶(AP)标记鼠抗兔二抗IgG是美国Jackon公司产品。Transwell 6孔板和96孔板均是美国Corning公司产品,PCR试剂盒子为美国Qiagen公司产品,脂质体是美国Invitrogen公司产品,matrigel胶是BD公司产品,PCR引物序列由上海英骏生物技术有限公司合成。
2.3. 细胞分组
细胞分为3组:SiHa细胞组(空白组)、转染空载体的 SiHa细胞组(空载体组)及转染Kiss-1基因的SiHa细胞组(过表达组)。
2.4. 实验方法
1) 依据kiss-1 (AY117143.1)基因序列,引入上下游双酶切位点HinDIII和酶切位点BamH I,设计kiss-1基因全长,并进行扩增引物PCR。提取SiHa宫颈癌细胞系中总RNA,然后将SiHa RNA逆转录成SiHa cDNA。PCR反应条件为:95摄氏度维持2分钟,94摄氏度维持30秒,63度维持30秒,82度维持1分钟,82度维持10分钟,总共为30个循环。使用PCR产物进行凝胶电泳,使用PCR试剂盒纯化PCR,与HinDIII和BamH I酶切后的载体粘端先后进行连接,然后转化并测序,最终得到pEGFPC1/kiss-1过表达载体。kiss-1全长表达引物序列如下:上游: 5'-ggcagctactgcttttcct-3',下游:5'-agtagcagctggcttcctc-3'。将pEGFPC1 (空载体组)、pEGFPC1/kiss-1 (过表达组)转入宫颈癌细胞SiHa。以常规宫颈癌细胞SiHa作为空白组。
2) Western blot方法检测kiss-1基因蛋白表达,并提取3组SiHa细胞蛋白质。分别用3组SiHa细胞50 μg蛋白样品,用百分之十的SDS-PAGE凝胶进行电泳分离,转移相应的蛋白到PVDF膜上,用百分之五的脱脂奶维持37度封闭1至1.5小时,3组分别加相应的一抗维持4摄氏度进行孵育过一整夜。取百分之0.05 Tween20的缓冲液一共充分漂洗3次,每次维持5分钟,用碱性磷酸酶(AP)来标记二抗(浓度1:1000稀释)维持37摄氏度情况下共孵育1小时,TBST洗膜3次,每次维持10分钟,然后加入底物,采用(NBT或者BCIP)显色,使用化学发光法和ChemiImager 5500软件进行结果分析,每组别需要重复3次。
3) 将3组宫颈癌SiHa细胞用胰酶消化后分别计数,细胞需要维持在1 × 105个每毫升的密度,在96孔板中加入100 μl宫颈癌SiHa细胞悬液,保证每孔至少有1 × 104个宫颈癌SiHa细胞,切记每组需要设计平行副孔,并且至少需要设计5个孔,分别在不同的时间点(24 h、36 h、48 h、60 h、72 h)进行检测,置于避光的条件,然后加10 μl的CCK-8检测液,再次置于避光条件孵育时间维持在2 h,用酶标仪检测在450 nm处的吸光度A值,A值的大小为细胞增殖活力。
4) Transwell模型细胞:采用稀释的matrigel胶平铺于Transwell上室,待风干,然后加无血清培养液于Transwell下室,避免有气泡生成,Transwell上室每孔加200 μl,密度要求含10,000个细胞,各组再设3个复孔,持续培养细胞24 h,取出滤膜后用多聚甲醛固定20 min,PBS洗膜2次,待风干后采用结晶紫染色再持续培养细胞15 min,PBS再次彻底洗涤2次,待滤膜完全干后用棉签轻拭上室宫颈癌SiHa细胞,随机选取200倍显微镜下中心5个视野,计穿过滤膜的宫颈癌SiHa细胞数,细胞个数为侵袭和迁移能力。每组设置为3个平行样本,每组均需要重复3次,最后取宫颈癌SiHa细胞数的平均值。
2.5. 统计学处理
使用spss21.0统计软件分析,各组样本均数比较均采用单因素方差分析,所有实验结果均表示为均值±标准差,组间两两比较采用t检验,以P < 0.05表示差异有统计学意义。
3. 结果
3.1. 转染kiss-1后相关基因蛋白的改变
选取β-actin为内参,转染kiss-1基因过表达kiss-1后宫颈癌SiHa细胞中Ecadherin的表达较空载体组有明显上调,同时Vimentin的表达则明显显著下调。(P < 0.05)见图1,表1。
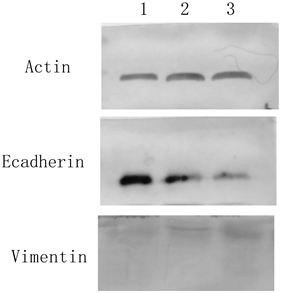 1为过表达组,2为空载体组,3 为SiHa空白组。
1为过表达组,2为空载体组,3 为SiHa空白组。
Figure 1. Western blot was used to detect the protein expression of Kiss-1, e-cadherin and Vimentin in transfected Kiss-1 overexpression group
图1. Western blot法检测转染kiss-1过表达组对kiss-1、E-cadherin、Vimentin蛋白表达的影响

Table 1. Protein expression of Kiss-1, E-cadherin and vimentin in different treatment groups of SiHa cells (
)
表1. SiHa 细胞不同处理组kiss-1、E-cadherin和Vimentin的蛋白表达(
)
3.2. Kiss-1对SiHa细胞的增殖能力的影响
转染kiss-1后过表达组细胞增殖活力低于空载体组和SiHa空白组(P < 0.05),而空载体组和SiHa空白组细胞增殖活力比较差异无统计学意义(P > 0.05),见图2。
3.3. 肿瘤细胞迁移能力
以穿过Matrigel侵袭膜的细胞平均数表示肿瘤细胞的体外侵袭能力。图3示SiHa细胞中转染kiss-1过表达组与空载体组相比,穿膜细胞数明显减少。SiHa细胞空白组、空载组及过表达组,12 h穿膜细胞数分别为275 ± 11、269 ± 15、115 ± 7,前两组细胞数无显著性差异,转染kiss-1过表达组与前两组相比有显著性差异(P < 0.05),见图3。
4. 讨论
上皮细胞向间质细胞的转化过程称为EMT,整个过程中随着细胞极性消失和黏附性减弱,而且其丝
 pEGFPC1 (空载体组)、pEGFPC1/ kiss-1 (过表达组)、SiHa细胞Control (空白组)。
pEGFPC1 (空载体组)、pEGFPC1/ kiss-1 (过表达组)、SiHa细胞Control (空白组)。
Figure 2. The proliferation activity of cells in each group at different times was detected by CCK-8 method
图2. CCK-8法检测各组细胞不同时间的增殖活力
 pEGFPC1 (空载体组)、pEGFPC1/kiss-1 (过表达组)、SiHa细胞Control (空白组)。
pEGFPC1 (空载体组)、pEGFPC1/kiss-1 (过表达组)、SiHa细胞Control (空白组)。
Figure 3. Transwell model reflects the invasion and metastasis ability of SiHa cervical cancer cells in each group
图3. Transwell模型反映各组宫颈癌细胞SiHa侵袭转移能力
状肌动蛋白重新排列,丝状和片状伪足形成从而获得迁移与侵袭的能力,进而最终称为间质细胞。肿瘤细胞的侵袭和转移已经在多项研究中证明与细胞间EMT相关 [12] [13] [14] [15]。EMT过程中关键性因素的E-cadherin与Vimentin呈负相关。因此,本研究着重讨论kiss-1与宫颈癌侵袭转移之间的关系。我们成功构建了kiss-1过表达载体,并成功转染宫颈癌细胞系SiHa,E-cadherin表达明显上调,Vimentin是间质细胞的运动能力强弱。因此Vimentin表达明显下调,Transwell模型是评估侵袭与转移较为经典的方法。通过实验证明:过表达kiss-1可以抑制宫颈癌细胞的运动侵袭能力,从而抑制宫颈癌转移的作用,这与其在大肠癌组织及前列腺癌等多种癌细胞中的作用一致。这为kiss-1基因成为防治宫颈癌转移的治疗的新靶点提供了理论基础,它天然的无毒性或将成为新的抗癌药物 [16] [17] [18] [19]。
未来在裸鼠模型上可以进一步验证kiss-1基因在哺乳动物的宫颈癌转移的过程,选用更接近人类的裸鼠敲基因模型更直观,更能验证试验的有效性。Kiss-1基因未来或可成为真正防治宫颈癌转移的靶基因。
基金项目
深圳市宝安区医疗卫生基础研究项目(2019JD030)。