1. 引言
恶性肿瘤是对人类健康威胁最大的疾病之一,据世界卫生组织发布的全球癌症报告显示2020年全球新发癌症病例1929万例,其中死亡病例达到了996万例。因此,抗癌治癌是提高人类健康水平中显得尤为重要。传统的肿瘤治疗手段有外科手术、放射治疗、化学治疗,这些治疗方法对患者有较大的创伤或毒副作用,且时常治疗效果不佳 [1] [2] [3] [4]。近年来,随着纳米技术和纳米医学的不断发展为解决这些挑战提供了新的机会。其中,光热治疗作为一种非侵入式的肿瘤治疗新方法收到了人们的广泛关注,其基本原理是利用纳米材料吸收近红外光并将其转化为热能,通过升温的物理方法来杀死肿瘤细胞是一种安全的治疗方式 [5] [6] [7] [8]。除了可以直接治疗肿瘤外,光热治疗还可以利用其升温的过程来促进其他化疗药物的释放,实现化疗药物的可控释放,并协同肿瘤光热治疗,使得疗效显著提高 [9] [10] [11] [12]。光热治疗在增加肿瘤治疗效果和减少副作用上面具有巨大的优势,在过去的几十年里,已经开发出了许多光疗药物和设备,但是光疗法面临着表面瘤之外的广泛临床应用的挑战。
金属硫族化合物作为一种窄禁带半导体,其具有非常好的局域表面等离子激元性能,在近红外照射下也能发射不同波段的可见光,可实现组织穿透,并能将近红外在原位转化成光敏剂所需的可见光,使其广泛用于癌症成像和光热治疗 [13] [14] [15]。然而,由于金属硫化物的毒性和生物体正常系统的排异反应,使其在生物医学应用中受到了很大的限制。此外,如何提高金属硫化物的光热转换效率成为另一个研究难点。聚多巴胺是一种广泛存在于生物体各组织的天然聚合物,具有良好的生物相容性和生物可降解性,以及热调节、抗氧化、自由基清除、光声性能、金属离子螯合能力、强的近红外区吸收、光致电子态的非辐射弛豫等多种物理化学特性,在生物体中发挥着重要的生理作用 [16] [17] [18] [19]。这些优异性能使得类聚多巴胺纳米材料作为一种多功能纳米平台具有广阔的生物应用前景。基于此,在本研究中,我们利用原位聚合的方法在Cu2−xSe纳米颗粒的表面聚合了聚多巴胺的外壳(见图1)。这层聚多巴胺的外壳不仅可以改善Cu2−xSe纳米颗粒的细胞毒性,还增强了其光热转换的效率。该纳米光热治疗剂的成功制备可为改善传统的纳米粒子的生物相容性提供了一种新的思路,而且有望实现纳米光热治疗剂的临床转化应用。
2. 实验部分
2.1. 仪器与试剂
扫描电子显微镜(ZEISS Gemini SEM 300);透射电子显微镜(Talos F200X);紫外–可见吸收光谱(UV-Vis);傅立叶转换红外光谱仪(FTIR);马尔文粒径电位分析仪;荧光显微镜(Leica TCS SP8)。

Figure 1. Schematic illustration of the synthetic procedure of core-shell structured Cu2−xSe@PDA nanoparticles
图1. 核壳结构Cu2−xSe@PDA纳米粒子合成示意图
聚乙烯吡咯烷酮(PVP,Mw = 55 kDa),硫酸铜,二氧化硒,抗坏血酸(Vc),盐酸多巴胺,Tris,无水乙醇等均为分析纯购买自上海阿拉丁试剂有限公司;实验所用均为去离子水。
2.2. 基于Cu2−xSe@PDA复合纳米粒子光热治疗体系的构建
2.2.1. Cu2−xSe纳米颗粒的合成
将1.6 mL 10 mg/mL的PVP溶液和5.5 mL的去离子水混合后加入到锥形瓶中,依次加入0.1 mL的0.2 M的SeO2和0.3 mL的0.4 M的Vc的水溶液。搅拌10 min后,滴加入0.1 mL的硫酸铜(0.4 M)和0.4 mL的Vc (0.4 M)的混合溶液并剧烈搅拌。在常温下反应10 h得到PVP稳定的Cu2−xSe纳米颗粒。待反应完成后,离心收集产物,用去离子水和乙醇各洗涤三次,保存在无水乙醇中。对所得到的产物的其结构、形貌进行SEM、TEM、红外光谱、紫外可见光谱等表征。
2.2.2. Cu2−xSe@PDA核壳结构纳米粒子的合成
将上述合成的Cu2−xSe加入到在20 mL乙醇和15 mL的去离子水的混合溶液中,磁力搅拌下加入不同质量的盐酸多巴胺(5 mg,10 mg,20 mg,40 mg)加入到混合溶液中。搅拌5 min后,加入10 mL的Tris溶液(25 mM)。保持在室温条件下继续搅拌反应24 h。最后得到黑色的溶液经过离心收集沉淀,并用乙醇和去离子水洗涤三次后分散在去离子水中待用。
2.2.3. Cu2−xSe@PDA光热转换性能测试
用波长为808 nm的激光(1 W/cm2)照射不同浓度的Cu2−XSe@PDA水溶液,以纯水为对照,照射时间为5 min,每隔30 s测试一次溶液的温度,并用红外热成像仪记录下不同时间点纯水和Cu2−XSe@PDA水溶液的温度变化情况。同时,为研究材料的光热稳定性,用激光照射Cu2−XSe@PDA水溶液5 min,每隔30 s测试一次溶液温度,待溶液温度冷却至室温,再次打开激光,重复上述步骤,激光开/关五次以测定材料的光热循环稳定性能。
2.2.4. 体外细胞毒性试验
MCF-7肿瘤细胞安排每个孔1 × 106个细胞浓度分散到培养液中,接着取200 μL培养液分别加入到96孔板中,在37℃下5%的CO2条件下培养24 h。接着每个孔中加入不同浓度的Cu2−xSe和Cu2−xSe@PDA进行培养。继续培养24 h后,加入新鲜的含有5 mg/mL的MTT的DMED溶液,并孵育4 h。除去上清液并加入150 µL的DMSO溶剂并震荡10 min后,用酶标仪测定。
2.2.5. 死活染色
MCF-7细胞(1 × 106个/孔)分散到200 µL培养液中并加入96孔板中37℃下5%的CO2中培养24小时。将细胞分别与不同浓度的Cu2−xSe和Cu2−xSe@PDA共同培养12 h,死细胞和活细胞分别用EthD-1 (红色)/calcein AM (绿色)进行染色。细胞用激光共聚焦显微镜荧光成像。同样地,将上述含有Cu2−xSe组的细胞的培养基换成新鲜的培养液后置于808 nm波长的激光(1 W/cm2)下照射10 min后,死活细胞染色后用激光共聚焦显微镜荧光成像。
3. 结果与讨论
3.1. Cu2−xSe和Cu2−xSe@PDA纳米颗粒的形貌与组成表征
如图2(a)所示,通过模板法合成的Cu2−xSe纳米颗粒具有单分散性球形,粒径分布均匀大小在95 nm左右。这些纳米颗粒由于表面具有PVP分子稳定可以很好地分散在水溶液中。图2(b)是产物的X-射线粉末衍射,结果表明所合成的Cu2−xSe纳米颗粒结晶性非常好,通过对比标准卡片显示对应于立方硒铜矿相的(111),(220),(311),(400)晶面衍射 [20]。图2(c)和图2(d)是Cu2−xSe纳米颗粒的元素分布图片。从图中可以看出纳米颗粒是由铜元素和硒元素组成,且两种元素在纳米颗粒中是呈现均匀分布的。通过以上电镜图片、结构与物相结果分析证明所合成的纳米颗粒为Cu2−xSe纳米球。

Figure 2. (a) TEM image of Cu2−xSe nanoparticles; (b) XRD pattern of Cu2−xSe nanoparticles; Element mapping images of Cu2−xSe nanoparticles: (c) Se element; (d) Cu element
图2. (a) Cu2−xSe纳米颗粒的透射电镜照片;(b) Cu2−xSe纳米颗粒的粉末X-射线衍射图谱;Cu2−xSe纳米颗粒的元素分析:(c) 硒元素;(d) 铜元素
进一步地,通过原位聚合的方法在Cu2−xSe纳米颗粒的表面生长了一层聚多巴胺的壳层。如图3中所示,所合成的复合纳米粒子任然呈现单分散性,内核Cu2−xSe纳米颗粒被聚多巴胺壳层均匀包裹形成了核壳结构的纳米粒子。实验结果表明,通过控制反应加入的多巴胺的量可以实现对外壳聚多巴胺壳层的厚度的控制。例如,当加入的多巴胺反应物量为5 mg时得到的聚多巴胺壳层厚度约为3.5 nm (图3(a)所示);当多巴胺的量增加到40 mg时,外壳聚多巴胺的厚度增加到了25 nm (图3(d)所示)。
3.2. Cu2−xSe和Cu2−xSe@PDA纳米颗粒的光学性质表征
我们详细研究了所制备的纳米颗粒的光学性质。将制备的Cu2−xSe纳米颗粒分散在水溶液中,溶液出现墨绿色(图4中的插图)。在图4中,紫外–可见–近红外光谱中绿色曲线显示,所合成的Cu2−xSe纳米颗粒在近红外光区(λ = 800~1000 nm)有很宽的吸收峰。说明Cu2−xSe纳米颗粒可作为一种潜在的近红外光诱导的光热转换剂。经过表面原位聚合多巴胺壳层过后,纳米颗粒的水分散液的颜色变有原来的墨绿色变为了黑色,从紫外–可见–近红外光谱中可以看出包裹后的纳米粒子在近红外区任具有很好的光吸收,且吸收强度提高了。这说明经过包裹聚多巴胺壳层后,复合纳米粒子在近红外光区的光热转换性能将得到提升。

Figure 3. TEM images of Cu2−xSe@PDA nanocomposites with different thickness: (a) 3.5 nm; (b) 15 nm; (c) 19 nm; (d) 25 nm
图3. 不同壳层厚度的Cu2−xSe@PDA纳米复合结构的透射电镜图片:(a) 3.5 nm;(b) 15 nm;(c) 19 nm;(d) 25 nm
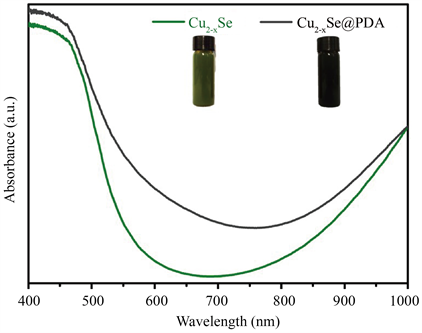
Figure 4. UV-vis-NIR absorbance spectra of Cu2−xSe and Cu2−xSe@PDA aqueous solutions
图4. Cu2−xSe和Cu2−xSe@PDA的水溶液的紫外-可见-近红外光谱
3.3. Cu2−xSe@PDA纳米颗粒的光热性能研究
为了验证复合纳米粒子Cu2−xSe@PDA的光热治疗作用,我们使用了808 nm的近红外激光照射不同浓度的Cu2−xSe@PDA溶液,照射时间为5 min,激光密度为1.0 W/cm2,同时用纯水作为对照组。结果显示在808 nm的近红外光照射下,Cu2−xSe@PDA溶液升温速率很快,且随着Cu2−xSe@PDA溶液浓度的增加更加迅速,而作为对照组的纯水则基本上没有明显的升温(图5(a))。在照射时间为5 min的情况下,浓度为25,50,100,200,400 μg/mL的Cu2−xSe@PDA溶液的温度分别提高了12.2,15.5,20.6,24.2,28.8℃ (图5(b))。此外,合成的复合纳米粒子Cu2−xSe@PDA具有非常好的光稳定性,经过五次激光照射升温循环实验后,光热转换性能没有明显的变化,且光热转换性能要比Cu2−xSe纳米颗粒优异(图5(c))。红外热成像的颜色变化也显示出同样的实验结果(图5(d))。以100 μg/mL的Cu2−xSe@PDA溶液和纯水溶液为例。红外热成像下,Cu2−xSe@PDA溶液在激光照射下颜色变化非常明显,由刚开始的深蓝色最终变为白色,表明温度升高非常快。而作为对照组的纯水则颜色变化不大(图5(d))。以上实验结果表明,Cu2−xSe@PDA纳米粒子具有非常好的光热转换性能,可作为一种潜在的肿瘤近红外光热治疗剂。
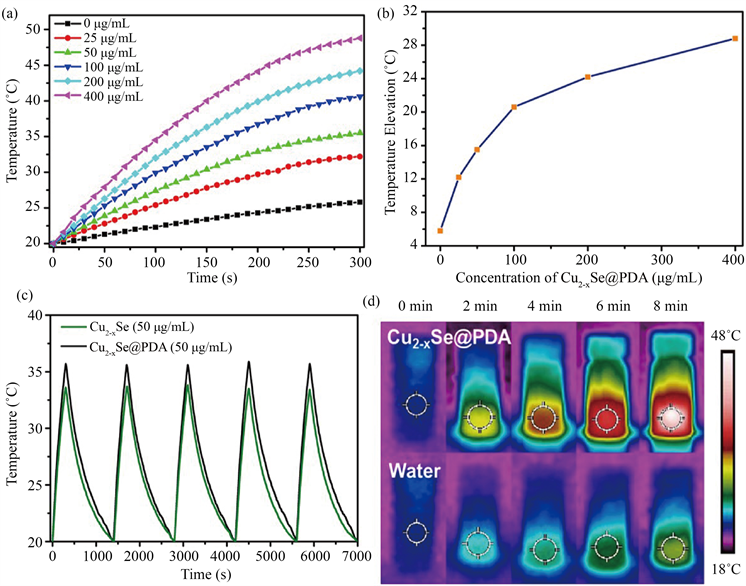
Figure 5. (a) The temperature curves of Cu2−xSe@PDA with different concentrations under 808 nm laser irradiation (1.0 W/cm2); (b) plot of temperature changeover a period of 5 min versus the concentration of the Cu2−xSe@PDA aqueousdispersion; (c) temperature curves of Cu2−xSe and Cu2−xSe@PDA with concentrations of 50 μg/mL for five laser on/off cycles; (d) photothermal images of 100 mg/mL of Cu2−xSe@PDA solution and pure water exposed to 808 nm laser (1.0 W/cm2) recorded at different time intervals (0, 2, 4, 6, and 8 min)
图5. (a)不同浓度的Cu2−XSe@PDA溶液在808 nm激光(1.0 W/cm2)照射下的升温曲线;(b) 5分钟内温度变化相对于Cu2−xSe@PDA浓度的变化图;(c)浓度为50 μg/mL的Cu2−XSe和Cu2−XSe@PDA溶液在五次激光开/关循环下的温度变化曲线;(c)浓度为100 μg/mL的Cu2−XSe@PDA溶液和纯水在808 nm激光(1.0 W/cm2)照射不同时间内(0, 2, 4, 6, 8 min)的光热成像照片
3.4. Cu2−xSe@PDA纳米颗粒的肿瘤细胞光热治疗研究
为了测定Cu2−xSe@PDA纳米粒子的光热治疗效果,我们进行了体外的肿瘤细胞实验。MCF-7细胞分别与不同浓度的Cu2−xSe和Cu2−xSe@PDA进行共培养,并加上808 nm激光照射。利用MTT的方法来分别测定每个实验组的细胞的相对活度,如图6(a)所示。测试结果显示,在浓度5~160 μg/mL的范围内,Cu2−xSe@PDA纳米粒子对肿瘤细胞没有表现出明显的细胞毒性,即使在高浓度(160 μg/mL)下,其细胞活性保持在98%以上。这说明Cu2−xSe@PDA纳米粒子是一种低毒的具有非常好的生物相容性的纳米治疗剂。而未包裹聚多巴胺的Cu2−xSe纳米颗粒在高浓度下开始显示出了其毒性,说明外壳聚多巴胺能够改善纳米颗粒的生物毒性提高其生物相容性。在808 nm激光照射下,实验组Cu2−xSe纳米颗粒对MCF-7细胞显示出非常明显的细胞毒性。当浓度为160 μg/mL的Cu2−xSe纳米颗粒与细胞共培养,经过5 min的激光照射后,大约有74%的细胞死亡了;相同条件下,Cu2−xSe@PDA纳米粒子能够杀死大约95%的肿瘤细胞。这些结果说明,经过聚多巴胺包裹后提升了纳米颗粒的光热治疗效果。图6(b)是不同实验组的MCF-7细胞的荧光死活染色结果。图中绿色的荧光表示活细胞,红色的荧光表示细胞死亡。单独的Cu2−xSe@PDA纳米粒子与细胞培养并未表现出毒性,即表明Cu2−xSe@PDA纳米粒子具有非常好的生物相容性。而Cu2−xSe@PDA组在激光照射下对细胞的杀死效果最为明显。这与前面的MTT的实验结果是一致的,都说明了在激光照射下Cu2−xSe@PDA纳米粒子表现出对肿瘤细胞具有非常高的杀伤效果。
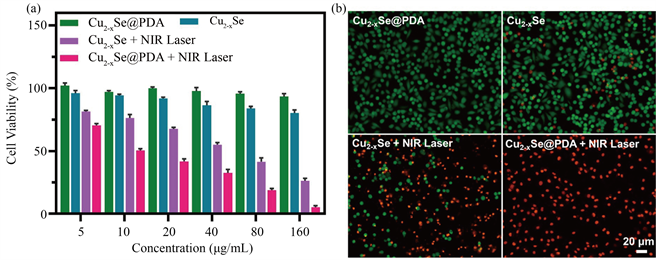
Figure 6. (a) MCF-7 cell viabilities incubation with different concentrations of Cu2−xSe and Cu2−xSe@PDA with or without 808 nm laser irradiation for 5 min; (b) live/dead fluorescent images of MCF-7 cells underdifferent treatments
图6. (a)分别与不同浓度的Cu2−xSe和Cu2−xSe@PDA共培养并加上或不加上808 nm激光照射5分钟后的MCF-7肿瘤细胞的细胞活性;(b)不同处理组的MCF-7肿瘤细胞的死活染色的荧光照片
4. 结论
在本文中,我们合成了一种核壳结构的Cu2−xSe@PDA纳米粒子,并将其应用到肿瘤光热治疗中。通过壳层PDA的包裹不仅提高了Cu2−xSe纳米颗粒的生物相容性,而且增强了纳米粒子的光热转换性能。进一步细胞实验结果表明合成的Cu2−xSe@PDA纳米粒子具有非常好的生物相容性,并且在近红外光照下可以实现高效光热治疗肿瘤细胞的效果。此外,本论文也为合成核壳结构纳米粒子以及各种材料表面修饰聚多巴胺生物涂层提供了一种新的方法。
基金项目
本项目由国家自然科学基金(批准号:22007052),江苏省自然科学基金(批准号:BK20190917)和南通大学博士科研启动基金支持。
参考文献
NOTES
*通讯作者。