1. 引言
葛根,又名葛藤、葛麻叶、粉葛藤等 [1],是豆科植物葛(Pueraria lobata (Willd.) Ohwi)的块根,乃我国常用的传统中药材,性凉,味甘、辛。有解肌退热,透疹,生津止渴,升阳止泻之功 [2]。异黄酮类化合物是葛根主要的活性成分,包括葛根素、大豆甙元、大豆甙、大豆素、葛根醇及异黄酮甙等有效活性物质 [3]。
宏基因组测序(Metagenome)最初由Handelsman [4] 提出,泛指测定特定环境样品(如人类和动物的肠道、母乳、土壤、冰川和海洋等环境)中所有微生物群落的基因组,主要分为全基因组测序和16S rDNA测序两大类。16S rDNA扩增子测序(16S rDNA Amplicon Sequencing)是以环境样品中的16S rDNA序列为研究对象,以测序分析和功能基因筛选为研究手段,以阐明微生物多样性、种群结构、进化关系、相互协作关系为研究目标的一种微生物学研究方法 [5]。流式细胞仪(Flowcytometer)是对细胞进行自动分析和分选的装置,是综合运用各学科知识的结晶 [6]。随着荧光色素化学、单克隆抗体技术的不断发展,流式细胞仪已广泛用于测量分析经特异荧光标记的免疫细胞。流式细胞仪存在定量、灵活、快速等特点,在现代免疫技术中占据着十分重要的地位 [6]。
人类肠道是一个多元化和充满活力的微生态系统,人体肠道内有1000~1150种,约100万亿细菌,是人体细胞数量的10倍,每个人至少有160种优势菌群 [7]。在健康人体的胃肠道微生物中,拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicute)为主,包括拟杆菌属、乳杆菌属、卟啉单胞菌属、梭状芽孢杆菌、柔嫩梭菌属等。其他丰度较少的门类有放线菌门(Actinobacteria),如双歧杆菌属、产气柯林斯菌属;变形菌门(Proteobacteria),如肠杆菌属、幽门螺杆菌;疣微菌门(Verrucomicrobia)和产甲烷古菌等 [8]。诸多研究证明肠道微生物菌群与肥胖、糖尿病、心脑血管疾病、炎症性肠炎、胃肠道癌症和自身免疫性疾病等具有一定的相关性 [9]。
有研究表明,肠道微生物的种类和代谢产物不仅促进机体免疫系统的发育,而且参与调节机体的免疫系统 [10]。黏液层的存在可有效防止细菌移位(bacterial translocation, BT),而肠道微生物的存在则可激发杯状细胞分泌黏蛋白(Mucin, MUC),尤其是MUC-2,保障黏液层结构的完整,从而发挥生物屏障作用。MUC-2缺失或黏蛋白糖基化异常时,肠屏障完整性受损、肠粘膜通透性增加,细菌过度增殖,进一步触发全身性反应和多系统器官功能衰竭 [11] [12] [13]。此外,肠道微生物诱导淋巴组织发育 [14]。肠道黏膜相关淋巴组织(gut-associated lymphoid tissues, GALT)是机体黏膜免疫的重要部分,由集合淋巴小结(Peyer’s patches, PP)、孤立淋巴滤泡(isolatedlymphoid follicles, ILF)和肠系膜淋巴结(mesenteric lymph nodes, MLN)共同组成 [15]。而肠道微生物及其代谢产物则是重要的抗原,经树突状细胞(dendritic cells, DC)吞噬而提呈 [16],刺激GALT的发育成熟。不仅如此,GALT所诱导的免疫反应又受控于肠道菌群物种结构及其代谢活性。此外,肠道菌群可被不同家族的Toll样受体(Toll-like receptors, TLR)识别,激活MAL-MYD88和TRAM-TRIF信号通路,产生不同的细胞因子调节T细胞向不同亚群分化,维持辅助性T (helper T, Th)细胞和调节性T (regulatory T, Treg)细胞动态平衡,保障机体免疫平衡。
本课题组前期研究发现葛根喷干速溶粉(Pueraria Spray Dry Instant Powder, PSIP)灌胃四周较空白组能提高小鼠胸腺比,显著提高小鼠脾脏比(P < 0.05),显著提高间接反应B、T淋巴数量的血清溶血素、溶血空斑、迟发性超敏反应试验(P < 0.05)。为探索PSIP改善正常小鼠免疫的机制,本课题组运用流式细胞仪测定血清中B、T淋巴细胞数量,16S rDNA扩增子测序粪便中肠道微生物菌群,较空白组发现,PSIP组肠道中诸多与机体免疫系统产生与维持相关的肠道菌种出现了特异性表达或显著表达,提示PSIP可能通过影响肠道微生物菌种而发挥提高机体免疫的功能。
2. 材料与方法
2.1. 材料与仪器
葛根喷干速溶粉(Pueraria Spray Dry Instant Powder, PSIP) (葛根素10%)黄山华绿园生物科技有限公司;HH-4数显恒温水浴锅,常州奥华仪器有限公司;DWP-9082-II型电热恒温培养箱,上海龙跃仪器设备有限公司;TDZ5型台式低速离心机,湖南赫西仪器装备有限公司;Multiskan FC型酶标仪,上海赛默飞世尔仪器有限公司;小鼠血清TNF-α、IFN试剂盒,武汉博士德生物有限公司;小鼠血清IL-6试剂盒,南京建成生物工程研究所。
2.2. 实验方法
2.2.1. 实验动物及分组
清洁级ICR小鼠,由浙江省实验动物中心提供,实验动物使用许可证号为SYXK (浙) 2014~2008,实验动物于SPF级动物房适应环境5~7 d,环境温度20℃~25℃,湿度40%~70%,明暗交替时间12 h/12 h。实验动物共40只,分别用于:① 流式细胞仪测定血清T、B淋巴细胞数量;② 16S rDNA扩增子测序小鼠粪便。实验开始前,小鼠适应性饲养1周,称量实验小鼠初始体重,按初始体重随机分为4组:空白对照组、PSIP高剂量组、中剂量组和低剂量组,10只/组。空白对照组灌胃(Intraperitonealinjection, i.p.)给予生理盐水、样品组灌胃给予PSIP 3 g/Kg、1.5 g/Kg和0.75 g/Kg,灌胃体积0.1 ml/10 g,每天一次,连续4周。
2.2.2. 流式细胞仪对小鼠血清中T、B淋巴细胞的测定
实验结束当天采血,以3000 r/min离心10 min后分离血清,有色染料FITC标记CD3,PE标记CD19,BD FACSC Elesta型流式细胞仪405 nm/488 nm/640 nm三激光12色测定血清中T、B淋巴细胞的数量,Q1区代表B淋巴细胞,Q4区代表T淋巴细胞。
2.2.3. 小鼠粪便16S rDNA扩增子测序
在实验结束前两天收集小鼠粪便,−80℃保存。采用PowerSoil® DNA Isolation Kit (MO BIO, Cat.No.12888)试剂盒对样本基因组DNA进行提取,利用琼脂糖凝胶电泳检测DNA的纯度和浓度,利用保守区设计通用引物。取适量的基因组DNA为模板,根据测序区域进行选择性PCR扩增,使用带有Barcode的特异引物和高效高保真酶进行PCR扩增,确保扩增效率和准确性,纯化后建立标准化文库,采用Illumina测序仪进行测序。测序得到的原始数据存在一定比例的干扰数据,为使信息分析的结果更加准确可靠,首先对原始数据进行过滤、拼接,得到有效数据,随后以97%的一致性将序列聚类成为运算分类单位(Operational Taxonomic Units, OTUs),并对OTUs的代表序列进行物种注释。
2.2.4. 统计学处理
采用SPSS20.0软件进行分析,数据资料用均值加减标准差(
)表示,方差齐时采用单因素方差分析,组间差异显著性采用LSD方法进行多重比较检验;方差不齐时采用秩和检验,组间差异比较采用。P < 0.05,表示差异有统计学意义。
3. 实验结果
3.1. 流式细胞仪检测PSIP对小鼠血清中T、B淋巴细胞的影响
有色染料FITC标记CD3,PE标记CD19,分别对应T、B淋巴细胞特异的表面抗原。流式细胞仪测量血清中T、B淋巴细胞数量变化的结果见表1。与空白组相比,各剂量PSIP均显著提高血清中T、B淋巴细胞,低、中剂量PSIP组显著提高血清中T、B淋巴细胞(P < 0.01),高剂量PSIP增高幅度有所降低但仍具有显著性(P < 0.05)。并且血清中T、B淋巴细胞数量增高幅度随PSIP浓度增高而逐级降低,呈线性变化,以低剂量PSIP组增高最显著,该结果也与本课题组前期实验中低剂量PSIP组溶血空斑试验、血清凝集素试验、迟发性超敏反应试验较空白对照组显著提高相一致。流式细胞仪测量血清中T、B淋巴细胞分布见图1,其中Q1区代表B淋巴细胞,Q4区代表T淋巴细胞,可以直观得发现各剂量PSIP灌胃后Q1区和Q4区的细胞数量明显增高,从免疫学层面进一步验证PSIP改善小鼠免疫水平的功能。

Table 1. Percentage of B and T lymphocyte cells in serum of blank group and PSIP group at each dose
表1. 空白组与各剂量PSIP组血清中B、T淋巴细胞占细胞总数百分比
注:与空白组比较,*P < 0.05,**P < 0.01。
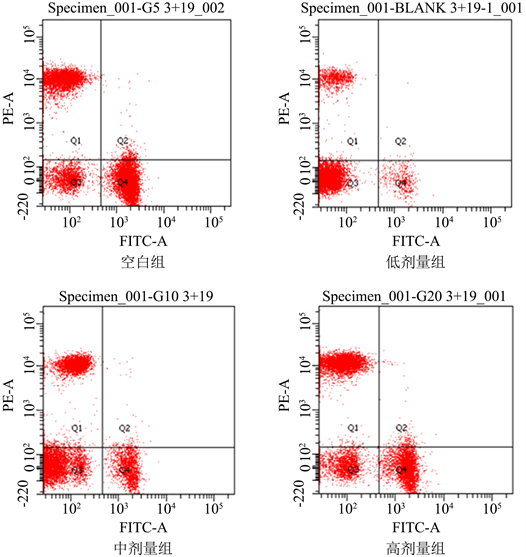
Figure 1. Serum B and T lymphocyte were measured in flow cytometry group and PSIP group
图1. 流式细胞仪测定空白组与各剂量PSIP组血清中B、T淋巴细胞
3.2. 16S rDNA扩增子测序分析PSIP对小鼠肠道微生物的影响
本实验就对小鼠肠道微生物的影响进行了初步研究,实验结果如下。我们将空白组与低剂量PSIP的粪便DNA测序得到原始数据,去除接头后,用PEAR软件将有overlap的序列进行拼接,使用QIME软件对拼接数据进行过滤,过滤掉含N较多或者低质量序列,最后进行嵌合体过滤得到有效序列(Effective Tags)。PSIP对小鼠各水平肠道微生物的影响见表2。空白组和低剂量组在界(Kingdom)门(Phylum)纲(Class)目(Order)科(Family)属(Genus)种(Species) 7个水平上两者并无显著性差异(P > 0.05)。

Table 2. Effects of Pueraria lobata extract on various levels of intestinal microbes in mice
表2. PSIP对小鼠各水平肠道微生物的影响
因此,我们进一步使用uparse软件对所有样品的有效序列进行聚类分析,以97%的一致性将序列聚类成为物种聚类单位(Operational Taxonomic Units, OTUs),一种OTUs往往对应一种肠道微生物,具体结果见图2。空白组OTUs数为451,低剂量组OTUs数为436,无显著性差异(P > 0.05)。两组共有388种OTUs,有48种OTUs为低剂量组特有。特有菌种经数据库查阅,主要包括毛螺旋菌_UCG_001、罗氏菌属、梭状芽孢杆菌属、毛螺旋菌_UCG_006、狄氏副拟杆菌、瘤胃球菌属、肠球菌属、厌氧棍状菌属、优杆菌属等。
对两组肠道微生物的物种丰度进一步分析,物种注释结果KRONA展示如图3,发现空白组肠道微生物以厚壁菌门(Firmicute)和拟杆菌门(Bacteroidetes)为主,其余为放线菌门(Actinobacteria)、变形菌门(Proteobacteria)等。相较于空白组,低剂量PSIP组表现出较低的厚壁菌门,更高的拟杆菌门和变形菌门,且具有更高的肠道微生物物种丰富性,这提示PSIP可能通过肠道微生物发挥免疫调节作用。
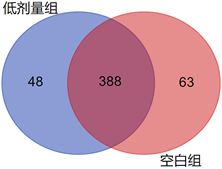
Figure 2. The distribution of OTUs in the blank group and the low-dose group
图2. 空白组与低剂量组OTUs分布情况
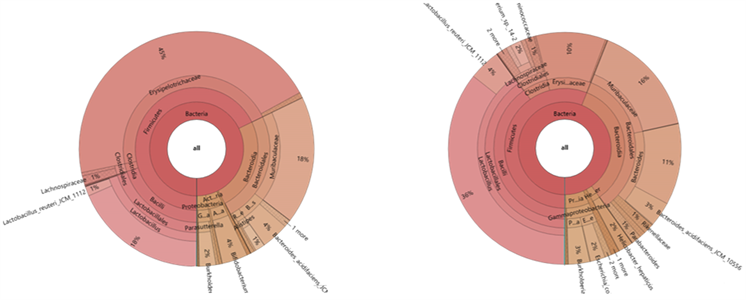 (a) (b)
(a) (b)
Figure 3. Species annotation results KRONA display. Note: (a) the visual display of KRONA in the blank group; (b) the visual display of KRONA in the low-dose group
图3. 物种注释结果KRONA展示。注:(a) 空白组KRONA可视化展示;(b) 低剂量组KRONA可视化展示
在种水平上对测序的菌种进行排序,选取最大丰度排名前10的物种,生成物种相对丰度柱形累加图,如图4,以便直观查看各样品在不同分类水平上,相对丰度较高的物种及其比例。其中低剂量PSIP嗜酸杆菌JCM_10556 (Bacteroides_acidlifaciens_JCM_10556)和罗伊氏乳杆菌JCM_1112 (Lactobacillus_reuteri_ JCM_1112)等益生菌的相对丰度较空白对照组显著上升,而啮齿类螺杆菌(Helicobacter_rodentium)、大肠埃希氏菌TA464 (Escherichia_coli_TA464)则显著下降。
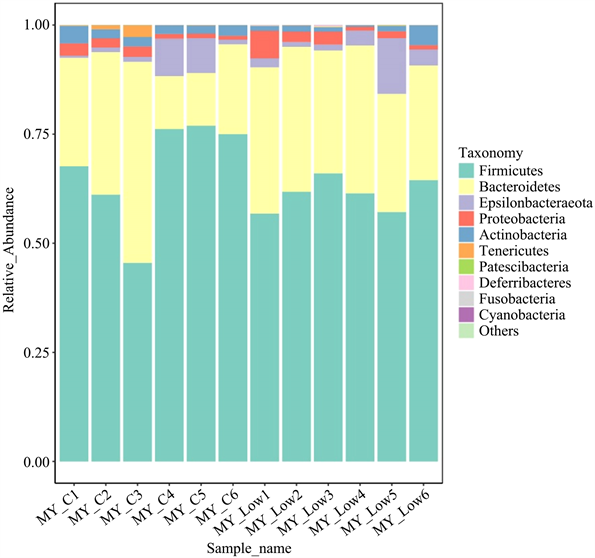
Figure 4. Column accumulation chart of the top 10 species relative abundance at two levels
图4. 2种水平上前10物种相对丰度柱形累加图
在属水平上选取丰度排名前35菌属,根据其在每个样品中的丰度信息,从物种和样品两个层面进行聚类,绘制成物种丰度聚类热图,如图5。我们分析发现,较空白对照组,低剂量PSIP组中毛螺旋菌_UCG_001、罗氏菌属、梭状芽孢杆菌属、毛螺旋菌_UCG_006、狄氏副拟杆菌、肠球菌等丰度特异性增高,物种热度最大。
为进一步对比低剂量PSIP组和空白对照组肠道微生物变化,我们采用LEFSE分析和T-test分析组间显著差异的物种,见图6。绘图后显示,较空白对照组,低剂量PSIP组中狄氏副拟杆菌(parebacteroides_YL27)、巴氏真杆菌(Eubacteriumbrachy)和Muribaculum的丰度显著增长,而罗姆布茨菌(Romboutsia)、丹毒丝菌目(Erysipelotrichales)、厌氧原体目(Anaeroplasmatales)、Duboliella等显著降低。为比较两组间肠道微生物分布的均匀性,我们采用Alpha多样性指数组间差异分析,选用simpson和chao1指数,如图7。结果显示低剂量PSIP组simpson和chao1指数均显示高于空白对照组。
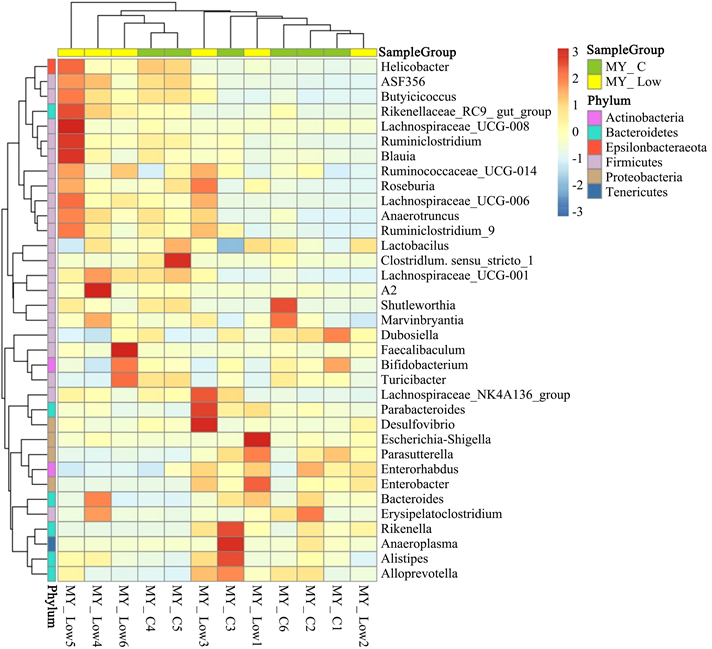
Figure 5. Cluster thermograms of species abundance at genus level
图5. 属水平上物种丰度聚类热图

Figure 6. Lefse analysis and T-test group significantly different microbial analysis
图6. LEFSE分析和T-test组间显著差异微生物分析
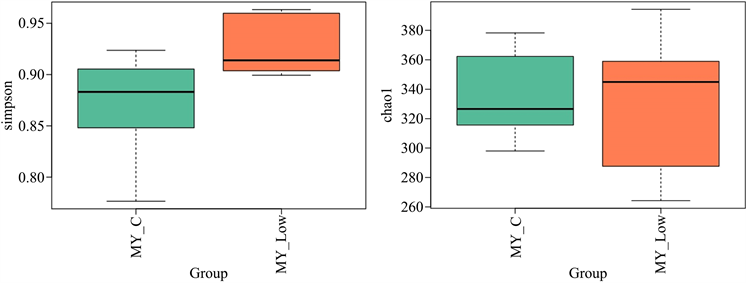
Figure 7. Analysis of microbial homogeneity between Simpson and chao1 groups
图7. Simpson和chao1组间微生物均匀性分析
最后,我们基于WeightedUnifrac距离和UnweightedUnifrac距离实施PCoA分析,并选取贡献率最大的主坐标组合进行作图,如图8。两样品距离越接近,表示物种组成结构越相似,因此群落结构相似度高的样品倾向于聚集在一起,群落差异很大的样品则会远远分开。结果显示低剂量PSIP组的样品主要分布于坐标轴的右上方,而空白对照组的样品则主要分布于坐标轴的左下方,提示PSIP能够较显著改变肠道内微生物的菌种丰度与组成结构。
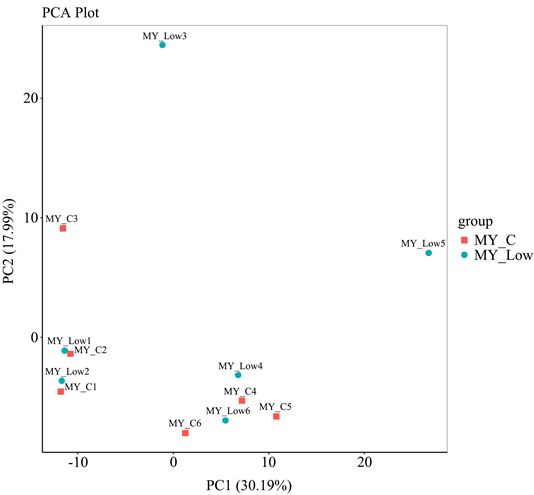
Figure 8. Analysis of PCoA in blank group and low-dose PSIP group
图8. 空白组与低剂量PSIP组PCoA分析
4. 结果与讨论
葛根总黄酮由葛根素、大豆甙等黄酮类化合物组成,是葛根发挥药效学作用的主要活性成分。肖嫩群等 [17] 发现,葛根芩连汤可促进肠道湿热证泄泻小鼠肠道乳杆菌和双歧杆菌增生,提高双歧杆菌与肠杆菌的数量比值(B/E值),从而抑制病原菌的黏附、定植和入侵,以提高机体对病原微生物的免疫防御能力。柏琳等 [18] 发现葛根总黄酮能够明显下调调佐剂性关节炎大鼠致炎因子IL-1β、TNF-α的表达,降低大鼠血清中致炎因子含量,进而改善炎症状态,提高免疫功能。我们的实验结果也证实葛根可以改善免疫功能,增强体液免疫和细胞免疫,特异性提高肠道内免疫相关微生物的丰度。
所有白细胞都有CD45特异性标志,其中T淋巴细胞表达CD3,B淋巴细胞表达CD19。表2结果显示三个剂量的PSIP能显著B、T淋巴细胞数量(P < 0.05),低剂量增长幅度最为显著(P < 0.01),提示PSIP能够通过B、T淋巴细胞提高体液和细胞免疫功能。B细胞在抗原刺激下可分化为浆细胞,浆细胞可合成和分泌抗体,主要执行机体的体液免疫。T淋巴细胞主要介导细胞免疫,根据表达CD4和CD8的不同而分为辅助T细胞(helper T cell)和细胞毒性T细胞(cytotoxic T cell)。正常机体免疫应答有赖于T淋巴细胞的调节作用,尤其是Th细胞和Treg细胞的相互制约和调节。在病理状态下,这两种T细胞之间的制约和平衡失调,可导致机体免疫功能紊乱 [19]。
图2显示低剂量PSIP小鼠粪便中具有48种特有菌群,其中罗氏菌属、梭状芽孢杆菌属等与机体免疫力的产生与维持密切相关。肠道内的梭状芽孢杆菌(Clostridium)是诱导黏膜免疫系统和全身免疫系统的重要因子 [20],通过刺激结肠上皮细胞产生TGF-β,诱导T细胞分化为Treg细胞 [21]。正常机体免疫应答有赖于T淋巴细胞的调节作用,尤其是Th细胞和Treg细胞的相互制约和调节。在病理状态下,这两种T细胞之间的制约和平衡失调,可导致机体免疫功能紊乱 [19]。当肠道中存在高丰度微生物菌群时会诱导产生较多的Th1和Th17调节性T细胞,而在无菌小鼠中这2个调节性T细胞的含量非常少 [22]。Geuking将无菌鼠和用ASF (alteredschaedlerflora)定植特定菌株(包括2个乳酸杆菌、1个拟杆菌、1 Flexistipes属的螺旋型细菌、4个氧敏感梭菌)的无菌鼠比对研究,发现ASF定植的无菌小鼠在结肠固有层黏膜激活和重新产生Treg细胞 [23]。
图3~6显示的低剂量PSIP较空白对照组增加的部分微生物菌群已被证明与免疫的产生维持与调节密切相关,如梭状芽孢杆菌属、罗氏菌属、肠球菌、狄氏副拟杆菌等。此外,PSIP还可降低丹毒丝菌目(Erysipelotrichales)、厌氧原体目(Anaeroplasmatales)、Duboliella等有害菌,提高肠道免疫屏障功能。因此,我们推测PSIP的提高免疫功能与肠道微生物菌群密切相关,尤其是显著增高的免疫相关微生物。
肠道内的梭状芽孢杆菌(Clostridium)是诱导黏膜免疫系统和全身免疫系统的重要因子 [20],通过刺激结肠上皮细胞产生TGF-β,诱导T细胞分化为Treg细胞 [21]。当肠道中存在高丰度微生物菌群时会诱导产生较多的Th1和Th17调节性T细胞,而在无菌小鼠中这2个调节性T细胞的含量非常少 [22]。Geuking将无菌鼠和用ASF (alteredschaedlerflora)定植特定菌株(包括2个乳酸杆菌、1个拟杆菌、1 Flexistipes属的螺旋型细菌、4个氧敏感梭菌)的无菌鼠比对研究,发现ASF定植的无菌小鼠在结肠固有层黏膜激活和重新产生Treg细胞 [23]。因此,PSIP增高的梭状芽孢杆菌丰度可能对维持和调节免疫平衡起重要作用。
典型的罗氏菌属能产生丁酸、丙酸等短链脂肪酸,改善肠道微生物多样性,提高葡萄糖耐受性。罗氏菌属丰度的减少可能影响多种代谢途径,并与肠易激综合征、II型糖尿病、神经系统疾病、过敏等多种疾病密切相关 [24]。丁酸盐可被游离脂肪酸受体(Free Fatty Acid Receptor, FFAR)识别并传递给肠道免疫细胞,通过多蛋白炎性复合物介导肠道免疫反应,进而有效维持抗炎和促炎之间的炎症状态平衡 [25]。PSIP可能通过提高肠道内罗氏菌属的丰度,增加肠道内丁酸盐浓度,平衡肠道内炎症状态,提高小鼠机体免疫力。
肠杆菌属以阴沟肠杆菌(Enterobactercloacae)为主,其余有产气肠杆菌(Enterobacteraerogenes)、泰洛肠杆菌(Enterobacter tylos)等,是人体常见的一种共生微生物 [10]。Macpherson [26] 证实肠杆菌属可能与机体免疫球蛋白A (Immunoglobulin A, IgA)密切相关。Macpherson [26] 将阴沟肠杆菌与其他共生微生物同时给小鼠灌胃,培养一段时间后通过清洗肠系膜淋巴结(Mesentericlymphnode, MLN)回收菌种,但在脾细胞和其他组织中没有发现肠杆菌。通过荧光激活技术发现共生菌主要存在于树突细胞(Dendritic Cell, DCs)。肠杆菌等共生细菌在黏膜位置被DCs携带并随其一起转移到肠系淋巴结,阴沟肠杆菌被吞噬后DCs就被激活。对小白鼠进行反复的胃内灌入阴沟肠杆菌,小白鼠黏膜和血清IgA可被选择性地诱导。
免疫球蛋白A (Immunoglobulin A, IgA)在正常人血清中的含量仅次于IgG,占血清免疫球蛋白含量的10%~20%,按免疫功能分为分泌型IgA (Secreted IgA, sIgA)与血清型IgA。分泌型IgA是机体粘膜局部抗感染免疫的主要抗体。故又称粘膜局部抗体。每天大约有3~5 g的IgA被分泌到肠腔,这个量占人体产生的全部免疫球蛋白的15% [27],IgA异常会引起许多免疫方面的疾病,例如IgA肾病、脂泻病、IgA大疱的皮肤病等疾病。因此PSIP极有可能通过阴沟肠杆菌等肠杆菌属诱导血清型及分泌型IgA分泌,进而提高小鼠体液免疫水平。
目前研究来看,狄氏副拟杆菌(Parabacteroidesdistasonis, P. distasonis)可能具有抗炎、免疫调节和代谢调节的潜在功能。P. distasonis的膜组分可以抑制多种促炎因子分泌并稳定DSS诱导的结肠炎小鼠的肠道微生物生态 [28],维持肠上皮免疫屏障完整 [29]。此外,人为添加P. distasonis或增加其丰度可用于抑制高危个体如肥胖者的结肠炎症和肿瘤发生 [30]。郭琳 [31] 等发现猴头菌与5-ASA联用可有效抑制小鼠溃疡性结肠炎症水平,重塑肠道微生态环境,显著提高P. distasonis相对丰度,可能通过增加P. distasonis发挥炎症抑制作用。PSIP组中P. distasonis丰度增加显著,提示PSIP的免疫改善功能可能与肠道微生物介导的黏膜免疫密切相关。
Simpson和chao1指数可反应肠道内组间物种多样性差异是否显著。图7显示低剂量PSIP组simpson和chao1指数均显著高于空白对照组,提示PSIP在提高肠道微生物的丰度同时,还能提高微生物分布均匀性,增加物种多样性,增强肠道黏膜免疫功能。PCoA分析中,如果样品距离越接近,表示物种组成结构越相似。因此群落结构相似度高的样品倾向于聚集在一起,群落差异很大的样品则会远远分开。图8显示低剂量PSIP组的样品主要分布于坐标轴的右上方,而空白对照组的样品则主要分布于坐标轴的左下方,提示PSIP能够较显著改变肠道内微生物的菌种丰度与组成结构。
综上所述,PSIP在前期研究能提高小鼠胸腺比,显著提高小鼠脾脏比(P < 0.05),显著提高间接反应B、T淋巴数量的血清溶血素、溶血空斑和迟发性超敏反应(P < 0.05)的基础上,PSIP能够提高血清中抗病毒因子IFN水平,降低炎性因子TNF-α和IL-6水平,显著增加血清中T、B淋巴细胞数量,并可能通过特异性改变肠道微生物,如狄氏副拟杆菌,增加肠道微生物多样性和均匀性,改善肠道微生物结构等途径发挥免疫调节作用。本实验为研究开发新型葛根保健食品提供了理论依据,但对葛根能否进一步改善免疫功能低下动物的免疫状态仍需进一步探索和研究。
基金项目
国家级创新创业训练项目(202113023003);浙江省大学生科技创新活动计划(新苗人才计划)项目(2021R424006);浙江省自然科学基金(LQY18H280001);浙江中医药大学中青年科研创新基金(KC201942);浙江中医药大学校级科研基金 (2019ZZ03);浙江省医药卫生科技计划(2021447171)。
NOTES
*通讯作者。