1. 引言
结直肠癌(colorectal cancer, CRC)在世界范围内癌症发病率和相关死亡率分别为第3位和第4位 [1] 。手术仍然是首选治疗方法,但对于诊断时潜在不可切除的结直肠癌患者,转化治疗是可行的选择。最佳的治疗方案应基于患者总体状况、肿瘤的病理、生物学特征以及手术方式 [2] 。大约15%的结直肠癌是错配修复缺陷或微卫星高度不稳定型(dMMR/MSI-H),然而,基于氟尿嘧啶的传统化疗并未显著提高该类患者的生存率 [3] 。目前,免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)已成为dMMR/MSI-H转移性结直肠癌的有效治疗策略。信迪利单抗作为一种国产重组全人源抗PD-1的单克隆抗体,目前正在中国进行多期临床试验,用于治疗各种实体瘤,如食管癌、黑色素瘤和非小细胞肺癌 [4] 。
2. 病例资料
患者徐某,男,49岁,因“腹痛、乏力1月余”于2020年12月就诊。既往史无特殊。无吸烟及饮酒史,无特殊药物服用史,无肿瘤遗传家族史。完善腹部强化CT示:升结肠浆膜浸润,考虑结肠癌(见图1)。肠镜检查显示升结肠有一肿物,病理示:腺癌(见图2)。癌胚抗原(CEA)、糖类抗原(CA19-9)水平均在正常范围。血常规示:血红蛋白:85 g/l,其余血、生化常规等无明显异常,查体:腹软,未触及异常肿块。根据AJCC/UICC第8版分期标准,他的病情分期为cT4aN2M0。考虑肿瘤体积大且侵犯周围淋巴结,根治性切除术困难大。我们为患者组织了肿瘤内科、胃肠外科、放射科的多学科会诊。结合患者青壮年、肿瘤无远处转移、一般状况良好等因素,会诊建议先行转化治疗,待肿瘤退缩后行手术切除。2020-12-17、2021-1-7给予1-2周期XELOX方案化疗,2021-1-19复查CT示病变较前无明显变化。2021-1-27、2021-2-20予以2周期XELOX联合贝伐珠单抗治疗。此时患者行肠癌基因检测示:KRAS、NRAS、BRAF均为野生型,高度微卫星不稳定型(MSI-H),PD-L1阴性。2021-03-09复查腹部CT示:结肠肝曲壁不均匀增厚,周围间隙密度增高,可见多发小结节影,较前变化不大。病情评估:SD (见图3)。患者转化治疗效果不明显,与患者及家属沟通并于2021-3-16始予以信迪利单抗联合伊立替康、雷替曲塞治疗6周期,2021-8复查CT示:肿瘤较前缩小,疗效评估:PR (见图4)。然而,2021-9完善术前CT示:肿块周围淋巴结较前增多(见图5)。2021-9-13于全麻下行“根治性右半结肠切除术(D3, CME) + 肠粘连松解术”,术中见:末端回肠扩张显著,回结肠系膜及阑尾周围可见大量肿大融合淋巴结,最大约
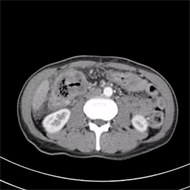
Figure 1. On December 7, 2020, CT of the upper abdomen revealed colon and hepatic flexure colon cancer with peripheral infiltration
图1. 2020年12月7日上腹部CT显示:结肠肝曲结肠癌并周围浸润
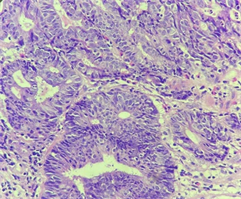
Figure 2. Colonoscopy pathology revealed adenocarcinoma
图2. 肠镜病理显示:腺癌
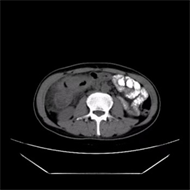
Figure 3. On March 9, 2021, upper abdominal CT showed colon cancer with surrounding infiltration, with no significant changes compared with the previous one
图3. 2021年3月9日上腹部CT显示:结肠癌并周围浸润,较前变化不明显
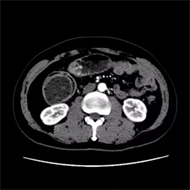
Figure 4. On August 10, 2021, upper abdominal CT showed colon cancer with multiple peripheral lymph node metastases, which was better than before
图4. 2021年8月10日上腹部CT显示:结肠癌伴周围多发淋巴结转移,较前好转
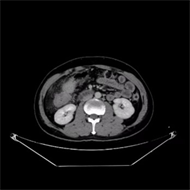
Figure 5. On September 10, 2021, an upper abdominal CT showed a slightly more advanced colon cancer
图5. 2021年9月10日上腹部CT显示:结肠癌较前略进展
1 × 1.5 cm,肿瘤位于结肠肝曲,大小约8 × 6 cm,侵及浆膜,肠管肿胀。术后病理示:1、(右半结肠)肠粘膜溃疡形成伴炎性肉芽组织增生,大量浆细胞及淋巴细胞浸润,残留小灶中分化腺癌(直径约0.6 cm),考虑治疗后改变(TRG 1级,中度反应),未累及回肠切缘及结肠切缘,网膜组织未见癌累及;肠周淋巴结内未见癌转移(0/15)。肿瘤出芽:Bd2级,中级别出芽。病理学分期:ypT2N0Mx (见图6)。免疫组化示:MLH1 (−),PMS2 (−),MSH2 (+),MSH6 (+),提示微卫星不稳定,分子检测结果:HER2 (0),S100示神经侵犯(−),CD31及D2-40示脉管癌栓(-),Ki-67 (+,约80%),PD-L1-22C3 (CPS约10),CD8 (+,约10%),CKpan (+)。特殊染色:弹力纤维染色示厚壁血管侵犯(−)。术后于2021-10-11始继续信迪利单抗单药治疗,目前已完成22周期,患者对药物耐受性良好,无Ⅲ级及以上免疫相关不良反应发生。
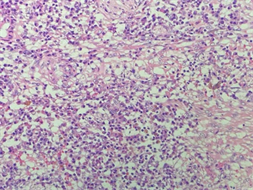
Figure 6. Postoperative pathology: intestinal mucosa ulcer formation (right half colon) accompanied by inflammatory granulation tissue hyperplasia, a large number of plasma cells and lymphocytes infiltrated, residual small focal moderately differentiated adenocarcinoma (diameter about 0.6 cm), which was considered to be changed after treatment
图6. 术后病理:(右半结肠)肠粘膜溃疡形成伴炎性肉芽组织增生,大量浆细胞及淋巴细胞浸润,残留小灶中分化腺癌(直径约0.6 cm),考虑治疗后改变
3. 讨论
MMR修复系统是根据DNA修复基因MLH1、MSH2、MSH6、PMS2、PMS1、MSH1纠正不匹配或错误的碱基。当这些基因中的一个或多个有缺陷时,这种修复机制将失效。这些错误的碱基将永久地整合到DNA中,形成微卫星序列。因此,dMMR/MSI-H肿瘤是由DNA修复系统缺陷引起的高水平微卫星序列不稳定性的肿瘤 [5] 。由于DNA错配修复系统的损伤,肿瘤具有更高频率的突变相关抗原,显著刺激了巨噬细胞和淋巴细胞的浸润。肿瘤微环境(tumor microenvironment, TME)组成表明,dMMR/MSI-H肿瘤中细胞毒性T细胞、Th1、Th2、CD8+ T和B细胞及巨噬细胞的表达高于pMMR/MSI-H肿瘤。免疫细胞的广泛浸润使dMMR/MSI-H肿瘤对免疫治疗有更高的反应率 [6] 。近年来,免疫检查点抑制剂在治疗dMMR/MSI-H结直肠癌中的应用已从二、三线发展到一线。Chalabi等人的NICHE研究显示,在20名局部晚期dMMR/MSI-H结直肠癌患者中,应用纳武利尤单抗(抗PD-1人源化单克隆抗体)联合依匹木单抗(抗CTLA-4人源化单克隆抗体)治疗的病理应答率达到100%,并且60%的患者实现了病理性完全缓解(pCR) [7] 。该研究为免疫检查点抑制剂作为新辅助治疗dMMR/MSI-H结直肠癌提供了基础。由于dMMR/MSI-H状态在预测肿瘤免疫应答效力中的重要性,NCCN指南(V1.2021)建议所有被诊断为结直肠癌的患者中使用聚合酶链检测MSI状态 [8] ,反观我们的病例,在确诊时应予以患者MSI状态检测以便及时开启免疫治疗。
2020年,中国国家医药产品管理局(NMPA)批准信迪利单抗用于治疗复发性或难治性霍奇金淋巴瘤,与纳武利尤单抗和帕博利珠单抗(抗PD-1的单克隆抗体)相比,它显示出相当的抗癌功效,且更安全,更具经济效益 [9] 。先前的研究表明,抗PD-1治疗在dMMR/MSI-H晚期结直肠癌中的有效率仅为32%~53% [10] 。肿瘤浸润淋巴细胞表达的PD-1与配体PD-L1结合,导致免疫细胞功能障碍,尤其效应T细胞。阻断PD-1/PD-L1轴可以恢复T细胞的正常作用并重新激活免疫。因此,扩大免疫药物疗效的策略可能涉及与诱导T细胞功能的治疗相结合。与早期认为化疗本身具有免疫抑制作用的假设不同,细胞毒性药物能够诱导细胞坏死和凋亡,释放新抗原并激活细胞毒性T淋巴细胞(CTL) [11] 。在目前提供的病例中,我们最初建议患者选择FOLFIRI方案与信迪利单抗联合使用。然而,由于经济原因,患者拒绝接受外周静脉插管;因此,我们氟尿嘧啶替换为雷替曲塞。作为喜树碱的衍生物,伊立替康是治疗结直肠癌的一线药物。它可以减少肿瘤细胞的免疫原性细胞死亡(ICD)并上调肿瘤特异性抗原。在一项早期研究中,Melichar等人报告称,伊立替康治疗后,淋巴细胞减少症患者的基线CD4/CD8细胞数量增加 [12] 。以CD4、CD25和Foxp3表达为特征的Treg抑制有效反应的发展,尤其是对肿瘤或感染性病原体的反应。肿瘤组织中的Treg浸润通常与不良临床结果相关 [13] 。在癌症患者中,VEGF-A表达与肿瘤内Tregs水平呈正相关。VEGF-A通过诱导未成熟的树突状细胞(DC)数量促进Treg分化,此外,VEGF-A通过与VEGFR2结合直接调节TME中Treg的募集,进而刺激Treg增殖,增强免疫抑制功能 [14] 。因此,贝伐单抗作为一种抗血管生成的靶向药物,能够阻断VEGF-VEGFR通路,进而降低机体Treg水平,建立免疫许可的肿瘤微环境 [15] 。
本病例中患者对免疫治疗联合化疗有深刻的反应,并且耐受性良好。但仍有一个问题需要探索,9月CT复查显示肿块周围淋巴结较上次CT增多。但最终的病理结果显示肿瘤直径仅约0.6 cm,被大量浆细胞及淋巴细胞浸润,达到MPR (病理性主要缓解,残余存活肿瘤≤10%) [16] 。这种迹象认为是假性进展(PSPD)。PSPD的原因可能是免疫检查点抑制剂使肿瘤部位聚集大量免疫相关细胞,从而增加了肿瘤体积 [17] 。PSPD的发生频率较低,根据癌症和药物类型而不同,但不超过15%。Colle等人的研究表明,在应用免疫药物治疗dMMR/MSI-H转移性结直肠癌时,PSPD的发生率约为10%。发生PSPD的患者2年的无病生存率和总生存率分别为70%和75%,这表明PSPD是ICI敏感性的预测标志 [18] 。但是,目前的成像技术无法区分假性进展和真实的肿瘤进展;因此,临床医生评估免疫治疗疗效时应考虑多种因素,如实验室指标和临床症状、体征,以避免过早停止有效药物或继续使用无效或有毒药物而延误治疗。
4. 结论
综上所述,我们报告了一例dMMR/MSI-H晚期的结肠癌患者,在化疗、免疫治疗后顺利完成手术,至今未出现病情复发。本病例为这类患者提供了更多治疗选择。然而手术前免疫治疗的最佳持续时间、免疫治疗期间假性进展的管理等问题仍需更多的临床实验深入研究。
NOTES
*第一作者。
#通讯作者Email: 18661807696@163.com