1. 引言
磁性纳米二氧化硅空心球具有大量的空间容纳大量的药物,为高载药量提供了机会。他们有一个外壳和内部核心,可以很容易地与所需的有机基团官能化,这有利于药物的装载和靶向递送。此外,外壳可以作为一个保护层,防止药物的降解,特别是脆弱的生物大分子。不同的制备方法可以合成有序和无序孔的介孔纳米微球。有序的直通道被认为有利于吸收分子的扩散,而壳中无序的孔隙被认为有利于控制和多级药物释放。高载药量有利于提高癌细胞的药物浓度。pH敏感和持续释放的药物有利于细胞内吞作用后纳米粒向癌细胞内的释放。磁性纳米二氧化硅空心球在合成和应用方面的发展还处于非常早期的阶段。深入研究空心结构在生物医学中的应用具有很大优势。
磁性空心球是内部空心并具有磁性能的特殊球形材料,具有比表面积大、质轻、热传导率低、介电性好等优点,由于其特殊和优异的物理化学性质,它在在催化剂 [1] [2] 、微波吸收材料 [3] 、药物传输 [4] [5] [6] 、生物分子的固定和吸附 [7] [8] [9] 和磁流体等方向具有广阔的应用前景。在多数的空心微球制备合成中,获得的空心微球往往是不具有功能性的,而只是作为不同尺寸的“容器”。将空心微球赋予功能性,也是空心微球研究工作中尤为吸引科研工作者的一个方向,也是这个领域工作的一个重要目的。
鉴于磁性空心微球具有特殊的内部空腔、吸附渗透性好、物质传递可控等优异性能,可储存负载并缓慢释放药物、香精、染料、菌素等客体分子,由此在功能性吸附、酶固定化载体、物质的分离纯化、活性物质和药物的封装与控释、靶向给药、医学成像、环境保护、食品以及化妆品等领域有着广阔的应用前景 [10] [11] 。因此,随着空心微球制备技术的进展,近年来制备功能性空心微球成为科研的一个热点。
作为磁性空心球的重要分支,硅由于具有无毒、良好的生物相容性以及稳定等优点,在磁性空心二氧化硅球的制备中被广泛研究。有许多不同的合成方法,如层–层包覆技术 [1] [12] 、喷雾热解 [13] 、共沉淀 [14] 和溶胶–凝胶法等等。从众多研究成果中可以看出,将SiO2包覆到磁性空心球的表面是比较容易的,反之,则比较困难。一些将铁化合物包覆到SiO2的表面,例如,Frank Caruso等人将Fe3O4纳米颗粒层交替吸附水溶液 [15] 中的聚电解质,涂覆阴离子聚苯乙烯晶格,制备MHSS。Remesh等人使用化学沉积法得到磁性二氧化硅球。Zhu等人利用铁前驱体吸附的碳球作为模板 [16] 制备了响尾纹状Fe3O4 @SiO2中空介孔球。Shi的团队通过溶胶–凝胶反应,水热处理和H2还原 [17] 制备了MHSS。但其合成过程较为复杂,且空心球表面难以实现功能化。
通常,空心微球功能化有两个大的方向,即空心微球内外壁的功能化或将功能性微球置于空心微球的空腔中,使其具有功能性。例如,Darya Radziuk等 [18] 制备的聚合物电解质银复合空心球就是将空心球内外壁功能化的代表。而将目标药物包裹在空心球中在医学上已有应用。Caruso的小组 [19] 展示了一种利用内功能化中空微球固定酶的新概念,该微球在给定的反应中表现出更好的对映体选择性。此外,利用带有相反电荷的十二烷基磺酸钠(SDS)和四丙基溴化铵(TPAB)所形成的囊泡为模板,通过TEOS在水中的反应,在囊泡表面形成SiO2壳层,产物经煅烧得到SiO2中空微球 [20] 。而以乳液聚合法合成的PS荧光素微球为核,以丙烯酰胺、丙烯酸为壳层单体,制备了具有明显核壳结构、粒径均一的PS/聚(丙烯酰胺G丙烯酸)荧光素微球。该荧光微球的载药量和包封率相对稳定,具有良好的缓释性能 [21] 。由此可看出,聚电解质制备的中空介孔球几乎具有半透性,因此小分子溶剂、维生素B12、染料或离子都可以穿透,有利于小分子药物的缓释。
本文报道了以磺化SiO2微球为硬模板,采用共沉淀法制备MHSS的一种简单、“绿色”的方法。磁性空心球的制备过程示意图如图1所示。用放射性同位素99mTc标记空腔内氨基功能化的MHSS,研究其在体内的磁靶向分布。
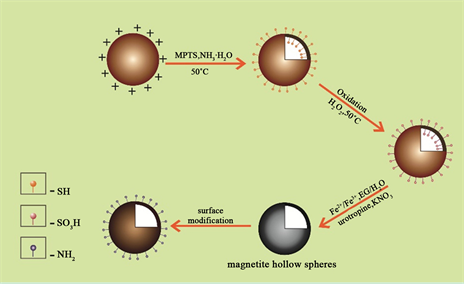
Figure 1. Schematic procedure for the preparation of magnetic hollow spheres
图1. 磁性空心球的制备过程示意图
2. 实验
2.1. 硫醇功能化空心硅球(THSS)的制备
将3.0 g苯乙烯、1.5 g PVP和0.39 g AAPH溶解于100 mL去离子水中,在氮气气氛中70℃保存。搅拌24 h后,用微孔膜过滤器过滤聚苯乙烯乳液,室温放置2天。将40 mL乙醇、5 mL氨水和1.0 g 3-巯基丙基三乙氧基硅烷(MPTS)加入到聚苯乙烯乳液中,在剧烈搅拌下加热至50℃,加热4 h,反应结束后,离心分离,乙醇洗涤3次。制备了巯基功能化空心硅球(THSS)。
2.2. 磺化中空硅球(SHSS)的制备
将制备好的THSS (0.8 g)溶于30 wt% 32 mL过氧化氢中,在300 rpm恒定搅拌下,在50℃下氧化反应12 h。将得到的磺化硅胶空心球再次离心分离,然后用去离子水洗涤3~4次,乙醇洗涤2次。最后,将磺化中空硅球冷冻干燥。
2.3. MHSS及氨基功能化MHSS的制备
首先,将0.3 g冷冻干燥的磺化SHSS超声分散到去离子水与乙二醇(水/乙二醇 = 1:1)的混合液中。然后,加入2.0 g六亚甲基四胺(HMT)和0.2 g硝酸钾(KNO3),搅拌30 min。然后在反应混合物中,将20 mL 0.05 M铁盐(Fe3+, Fe2+)溶液滴加到反应体系中,在氮气保护下80℃反应5 h,搅拌速率为800 r/min,反应结束强磁分离,得到磁性空心二氧化硅球。经离心纯化,室温真空干燥。在保持其它参数不变的情况下,通过改变铁盐浓度和[Fe2+]/[Fe3+]的摩尔比,得到四种样品。表1列出了我们采用铁盐浓度和不同[Fe2+]/[Fe3+]摩尔比样品的命名。

Table 1. The nomenclatures of the prepared samples adopting different Ferric concentration and molar ratio [Fe2+]/[Fe3+]
表1. 采用不同铁盐浓度和[Fe2+]/[Fe3+]摩尔比所制备产品的命名
准确称取0.10 g磁性空心二氧化硅球,分散到50 mL甲苯中,超声30 min。在磁力搅拌作用下,向反应溶液中加入1.00 mL 3-氨丙基三乙氧基硅烷,在123℃下搅拌回流反应12 h,自然冷却后,用无水乙醇洗涤2~3次,强磁分离后,产品于60℃真空干燥箱中干燥,得到内腔氨基化的磁性空心二氧化硅球。
2.4. 锝-99m (99mTc)标记MHSS的制备及其生物分布
利用上海原子科兴药业有限公司提供的Na99TcmO4注射液,用氯化亚锡还原99TcmO4−。将8 mg SnCl2,0.1 ml 0.5 mol/L葡萄糖酸钠溶液,0.4 mL PBS (pH = 5.7),5 mg未标记化合物(MHSS-a) (氨基功能化-MHSS)混合在瓶中,形成均匀溶液,超声处理15 min,然后加入1 mL 5mCi/ml 99TcmO4−洗脱液,加热至70℃ 2 h。用磁场分离标记物(MHSS-99mTc),用去离子水洗涤,用CRC-15R医用放射性核素活度计检测标记物的放射化学纯度。
为了进一步研究纳米颗粒的生物分布,将100 μL 99Tcm标记的MHSS溶液经雌性小鼠尾静脉注射。经一定时间的磁靶向治疗后,用戊巴比妥钠过量处死动物,分离主要脏器(血液、心、肺、肝、脾、胰、胃、小肠、大肠、脑、肌肉、骨)并称重。用缓冲液冲洗主要脏器,用γ-计数器分别测定剩余的细胞相关放射性。
3. 结果与讨论
3.1. THSS的结构和形态
如图2(a)、(b)所示,THSS球体空腔清晰,尺寸均匀。样品的粒径约为100 nm直径,壳厚约为15 nm,芯直径约为75 nm。图2(c)所记录的SEM图像清晰地显示出均匀的球体结构,其直径和尺寸与TEM结果接近。
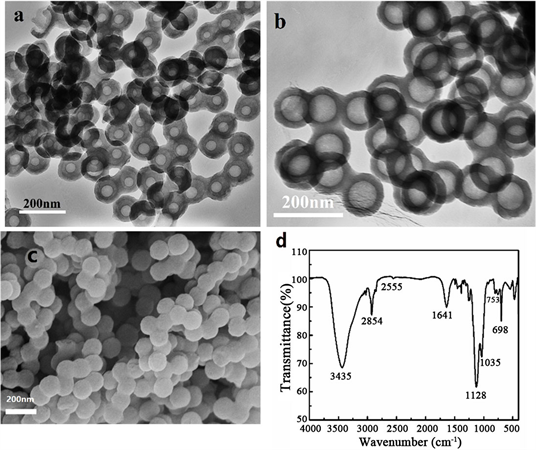
Figure 2. (a)~(b) TEM images, (c) SEM images and (d) FTIR spectra of THSS samples
图2. THSS样品的(a)~(b) TEM图像,(c) SEM图像,(d) FTIR光谱
FTIR测量可以用来推断材料的表面性质。图2(d)为THSS样品的FTIR光谱。2555 cm−1处的峰为S-H的拉伸振动,698 cm−1和753 cm−1处的两个峰为样品中苯基单取代的拉伸振动,1035 cm−1处的峰为Si-O-Si的振动。同样,在1641 cm−1和3435 cm−1的两个峰被分配给O-H键。结果表明THSS中存在巯基。
由于带正电荷的聚苯乙烯(PS)与带负电荷的3-巯基丙基三乙基氧基硅烷(MPTS)相互作用,在氨的催化下,MPTS可水解成SiO2携带的硫醇基,因此纳米SiO2可以成功地包覆在PS表面。因此,空心二氧化硅球的形成过程与氨有关,氨不仅作为生成SiO2的反应物,而且作为碱介质与乙醇“溶解”PS模板球 [22] [23] 。该方法是一种简单、“绿色”的方法,可以在合成过程中去除聚苯乙烯芯的任何模板,不需要任何额外的溶解、煅烧或蚀刻过程。
3.2. SHSS的结构和形貌
合成后的SHSS透射电镜图像如图3(a)和图3(b)所示。透射电镜观察表明,合成的SHSS具有中空结构。平均尺寸在100 nm左右,中空直径75 nm,硅壳15 nm。由于MPTS水解形成的SiO2是Si-O-Si的团聚,部分SiO2的壳层在颗粒之间连接(图3(b))。得到的SHSS形貌如图3(c)所示,呈均匀的球形,尺寸为100 nm。图3(d)为合成的SHSS结构的FTIR光谱图,可以观察到空心硅球的结构变化。698和753 cm−1附近的吸收峰归属于苯基,1035 cm−1附近的吸收峰归属于Si-O-Si的振动。在1641 cm−1和3435 cm−1处的对峰归属于O-H键。此外,与图2(d)相比,2555 cm−1处的峰已经消失,但在1450 cm−1处出现的新峰可归因于磺酸基的吸收峰,表明巯基(S-H)已被氧化为磺酸基。
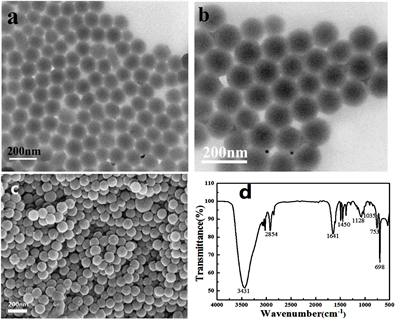
Figure 3. (a)~(b) TEM images, (c) SEM images and (d) FTIR spectra of SHSS samples
图3. SHSS样品(a)~(b) TEM图像,(c) SEM图像,(d) FTIR光谱
3.3. 改变[Fe2+]/[Fe3+]摩尔比对MHSS结构和形貌的影响
图4为不同Fe2+与Fe3+配比制备的MHSS的TEM图像。从MHSS-a的TEM图像(图4(a))可以看出,弥散良好的MHSS直径约为105 nm,包覆了一层厚度为6~6.5 nm的Fe3O4层。当[Fe2+]/[Fe3+]比为2:1,铁浓度为0.10 M时,可以明显看出黑色Fe3O4完全包覆在硅壳上,因为Fe2+与Fe3+的比和总铁浓度是影响MHSS表面磁性颗粒大小的两个关键因素。

Figure 4. TEM of magnetic nanoparticles prepared at different Ferric concentration and the molar ratio of [Fe2+]/[Fe3+], (a) 0.10 M, 2:1, MHSS-a, (b) 0.05 M, 2:2, MHSS-b, (c) 0.05 M, 2:0, MHSS-c, and (d) 0.05 M, 2:1, MHSS-d
图4. 不同铁盐浓度下制备的磁性纳米颗粒的透射电镜及[Fe2+]/[Fe3+]:摩尔比,(a) 0.10 M,2:1,MHSS-a,(b) 0.05 M,2:2,MHSS-b,(c) 0.05 M,2:0,MHSS-c,和(d) 0.05 M,2:1,MHSS-d
一般来说,在理想条件下,当[Fe2+]与[Fe3+]的摩尔比为1:2时,共析出发生。但实际上,Fe2+暴露在空气中很容易被氧化,所以[Fe2+]与[Fe3+]的摩尔比保持在2:1不变,以避免形成橙红色的FeOOH相 [24] 。Fe3+与Fe2+离子的完全共沉淀一般发生在pH 9.2以上,可表示为:
Fe3+ + Fe2+ + 8OH– → Fe3O4 + 4H2O
另一方面,由于Fe3+和Fe2+的Kθsp不同,Fe3+离子的沉积速度比Fe2+离子快。由Kɵsp, Fe(OH)3 = 3.98 × 10−38和Kɵsp, Fe(OH)2 = 7.94 × 10−16,可知,Fe3+和Fe2+分别在pH 3~4和pH 8~9时析出。当[Fe2+]与[Fe3+]离子以2:1的比例共析出Fe3+时,优先析出Fe3+,然后Fe2+与Fe3+共析出促进了SHSS表面Fe3O4晶体的沉积。但当[Fe2+]与[Fe3+]的摩尔比为2:2时,由于Fe2+容易被空气中微量的氧化,因此缺乏的Fe2+离子数量不足以支持整个Fe3+离子接近Fe3O4晶体沉积。因此,过量的Fe3+离子可以加速新形成的Fe3O4晶体之间的静电吸附,形成在SHSS表面聚集严重的MHSS-b,如图4(b)所示。
Fe3+离子的缺失是否有利于SHSS表面Fe3O4晶体的沉积,如图4(c)所示,没有令人满意的答案。这是因为在[Fe2+]与[Fe3+]的比例为2:0时,用于Fe3O4晶体沉积的Fe3+离子只能通过合成过程中残留的微量过氧化氢氧化Fe2+来获得。因此获得的Fe3+离子很少能够参与SHSS表面Fe3O4晶体的沉积,从而产生了覆盖在SHSS表面的少量磁性颗粒的MHSS-c (图4(a)) [25] 。
其次,必须考虑总铁浓度的影响,当[Fe2+]与[Fe3+]的摩尔比控制在2:1,总铁浓度为0.05 M时,图4(d)中记录的MHSS-d图像仍然显示空心二氧化硅/磁性复合球,可以看到SHSS表面包覆了2~3 nm厚度的Fe3O4层。结果表明,总铁浓度会影响SHSS表面Fe3O4涂层的厚度,适当的铁浓度可以改善SHSS表面Fe3O4晶体的沉积,较低的铁浓度只能形成较薄的Fe3O4涂层。
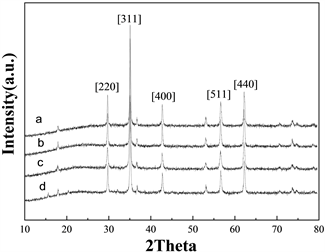
Figure 5. XRD patterns of magnetite nanoparticles prepared at various iron salts concentrations and the molar ratio of [Fe2+]/[Fe3+] (a) MHSS-a, (b) MHSS-b, (c) MHSS-c, and (d) MHSS-d
图5. 不同铁盐浓度和[Fe2+]/[Fe3+]摩尔比下制备的磁性纳米颗粒的XRD谱图,(a) MHSS-a, (b) MHSS-b, (c) MHSS-c, and (d) MHSS-d
为了进一步确定晶体结构,采用XRD测量方法对不同铁盐浓度和不同[Fe2+]/[Fe3+]配比的样品进行了分析。粒子的衍射峰合成研究中测量2θ = 29.70,35.06,42.71,56.60,62.20,分别对应于(2 2 0),(3 1 1),(4 0 0),(5 1 1)和(4 4 0)晶面的Fe3O4 (图5)。它可以发现好看的衍射峰出现在模式和模式可以被索引Fe3O4 (JCPDS # 79-0418年)根据反射峰值位置和相对强度,这证实了这个示例的磁铁矿结构。图5中四条曲线的一致性表明,当铁盐浓度和[Fe2+]/[Fe3+]摩尔比发生变化时,磁性纳米颗粒没有发生晶体转变。
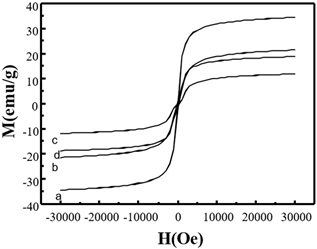
Figure 6. Magnetization curves of magnetite nanoparticles prepared at various iron salts concentrations and the molar ratio of [Fe2+]/[Fe3+]: (a) MHSS-a; (b) MHSS-b; (c) MHSS-c; (d) MHSS-d
图6. 不同铁盐浓度和[Fe2+]/[Fe3+]摩尔比下制备的纳米磁铁矿磁化曲线:(a) MHSS-a;(b) MHSS-b;(c) MHSS-c;(d) MHSS-d
通过改变[Fe2+]/[Fe3+]的用量和铁盐的浓度,可以控制球表面Fe3O4的含量。MHSS的磁性检测结果如图6和表2所示。MHSS球的磁化饱和度(Ms)如表3所示,从结果可以看出,MHSS-a的饱和磁化强度最高,为34.38 emu/g,MHSS-b的饱和磁化强度次之,为24.38 emu/g,MHSS-d的饱和磁化强度第三,为18.77 emu/g,而MHSS-c的磁化强度最小,为11.80 emu/g。矫顽力接近于零,表明它们都属于超顺磁体系。可以看出,由于磁层厚度的不同,MHSS的Ms值随着盐溶液浓度的增加而增大。在[Fe2+]/[Fe3+]的比例下,随着Fe3+含量的增加,MHSS的Ms值也随之增加,这是由于适量的Fe3+能够促进Fe3O4的沉积。考虑到MHSS-a具有34.38 emu/g的最高饱和磁化强度,本文可以选择MHSS-a作为靶向药物的载体,为高效低毒抗肿瘤提供实证研究依据。

Table 2. The magnetic parameters of MHSS prepared by different molar ration of [Fe2+]/[Fe3+]
表2. 不同[Fe2+]/[Fe3+]的比例下MHSS的磁参数
3.4. 体内MHSS靶向
将未标记的氨基功能化MHSS与放射性锝-99前体(Na99Tcm O4)在氯化亚锡(SnCl2)存在下混合,可将99Tcm (VII)还原为99Tcm (III)离子 [26] 。发现99Tcm3+离子也可以通过低价99Tcm3+离子与-NH2基团之间的配位键锚定在MHSS的内腔上(图7)。得到的标记MHSS化合物用生理盐水洗涤,然后用强磁铁分离三次,去除多余的游离99Tcm3+,用CRC-15R医用放射性核素活度计检测所标记化合物的放射化学纯度。将纯化后的MHSS-NH2-99mTc分散于生理盐水中,超声处理生成20 mg/2.5 mL标记复合溶液。99mTc的标记收率经CRC-15R医用放射性核素活度计测定为81%。
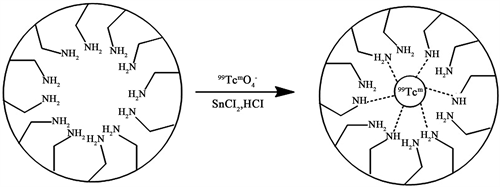
Figure 7. The illustration for the Technetium-99 label
图7. 99Tcm被标记的图示
99Tcm标记的MHSS颗粒不仅可以增强体内的放射性同位素治疗 [27] ,而且也使我们能够定量跟踪这些纳米颗粒在给药后的体内行为。雌性小鼠静脉注射MHSS-NH2-99mTc,单光子发射计算机断层扫描(SPECT)成像。由于注射MHSS-NH2-99mTc后,每个标记的MHSS颗粒在全身分布广泛,注射2小时后,在肝脏、脾脏、肾脏和膀胱中观察到高水平的放射性积聚,但在肺部摄取少量放射性颗粒(图8(a))。结果表明,标记的MHSS颗粒能够成功地突破肺循环,并通过泌尿系统排出体外。相反,MHSS-NH2-99mTc纳米颗粒被网状内皮系统(肺、肝、脾)吞食。
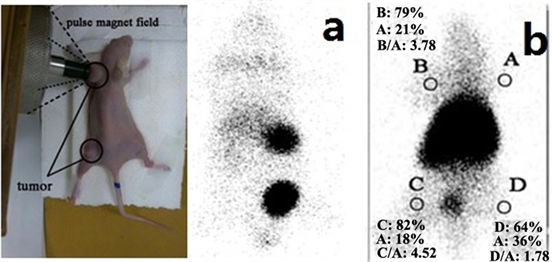
Figure 8. The SPECT images of the mouse after injection with MHSS-99Tcm nanoparticles by (a) no targeting and (b) targeting
图8. (a) 无靶向和(b) 靶向注射后小鼠的SPECT图像
为了探索标记MHSS颗粒的靶向性,将裸鼠肿瘤置于YMC-11医用脉冲磁场发生器的磁极上,控制脉冲磁场输出电压为700 V,持续2 h。图8(b)中,右前肢(A)为正常,左前肢(b)为有靶向的肿瘤区,左后肢(C)为无靶向的肿瘤区,右后肢(D)为炎症感。
图8(b)为裸鼠注射后针对肢体的SPECT成像,图像中密集分布的黑点对应着大量99Tcm标记的MHSS颗粒通过被动磁靶向和主动磁靶向相结合的机制积聚到肿瘤部位。因此,与99Tcm标记的MHSS颗粒在体内的生物分布相比,靶向SPECT成像显示,标记的MHSS颗粒在肿瘤中的活性浓度明显高于未靶向部位的MHSS颗粒浓度。
3.5. 纳米磁性颗粒在不同脏器中的定量分析
为了研究纳米磁性颗粒在不同脏器中的分布情况,本文采用雌性小白鼠为动物模型,研究纳米磁性颗粒在体内器官中的含量。
以小白鼠作为动物模型,进行了体内分布实验,将标记99Tcm的磁性二氧化硅空心球从小鼠的尾静脉注射进入鼠体内。通过γ计数器对各组织放射性99Tcm计数分析,不同时间点将小鼠分批处死后解剖,分别准确称取血液、心脏、肺、肝、脾、胰腺、胃、小肠、大肠、脑、肌肉、骨骼的质量,用γ计数器测试鼠体内各脏器的放射性计数,进行定量分析研究。

Table 3. Biodistribution of nanomagnetic particles in mice (%ID/g)
表3. 纳米磁粒在小白鼠体内的生物分布(%ID/g)
γ计数器测试鼠体内各脏器的放射性计数分析纳米磁性粒子分布%ID/结果:纳米颗粒在肺、肾、肝、脾、骨髓浓聚,胃摄取血液中游离的99Tcm。肠道内的放射影为游离99Tcm由胃内容物蠕动排入肠道,纳米颗粒能进入骨骼。
4. 结论
本文开发了一种高效的功能化SiO2球模板化路线,制备了均匀腔径70 nm、壳厚15 nm的磁性空心二氧化硅球(MHSS)。根据XRD图谱的标度计算了它们的单晶胞参数,它们都属于单斜对称。MHSS-a具有最大的胞角(β),因此具有完美的球形形貌,饱和磁化强度最高,为34.38 emu/g。[Fe2+]/[Fe3+]摩尔比和铁盐浓度对MHSS的磁性能和形貌有影响。在体内应用中,我们将99Tcm标记的MHSS注射到小鼠体内,研究磁性纳米颗粒在不同器官中的生物分布,结果发现MHSS在小鼠的脾脏、肺和肝脏中都有蓄积,在小鼠体内表现出明显的磁性靶向作用。研究结果表明,磁性空心硅球在磁性靶向药物递送系统中具有很大的潜力。