1. 引言
多重键的氢卤化反应是合成卤化合物的基本方法。尽管烯烃的碳–碳双键经过卤化氢的亲电加成以生成烷基卤化物,但炔烃的碳–碳三键不能有效地发生类似的反应,主要是因为sp杂化碳的阳离子中间体比sp2杂化碳的阳离子中间体稳定性低。炔烃的可控制氢卤化反应来可直接合成烯基卤化物,烯基卤化物在药物化学 [1] 、高分子化学 [2] ,生物学 [3] 和日用化工等 [4] [5] 领域都有广泛的应用,此外在过渡金属催化的C-C或C-杂原子交叉偶联反应中它常被视为高效的偶联模块,例如Suzuki-Miyaura [6] 偶联反应和Buchwald-Hartwig [7] 胺化反应等。因此最近炔烃的选择性氢卤化反应引起化学家的广泛关注。
炔烃的氢卤化(主要是I、Br和Cl)反应中研究比较多的是氢碘化反应。2010年,高芳等人 [8] 通过铜催化,利用NIS/H3N·BH3体系对芳基和烷基取代的末端炔烃进行选择性氢碘化反应。同年、2012年和2014年,Kawaguchi课题组相继报道了以二苯基氧膦 [9] 、亚磷酸二苯酯 [10] 为质子源;三苯基膦 [11] 为催化剂;分别进行了端炔的氢碘化加成反应。最近氢氯化反应的研究也比较活跃,2017年,Hammond课题组 [12] 提出了一种高度区域选择性的均相Au(I)催化的非活化炔烃的氢氯化反应。同年,Van课题组 [13] 报道了利用Au-TiO2复合纳米颗粒体系进行区域立体选择的炔烃吸附反应,制备了氯乙烯衍生物。2014年,Morandi课题组 [14] 通过Ir(cod2)2催化炔烃的转移卤化反应合成卤化乙烯。2022年,白宇烨等人 [15] 利用RuCl2 [(p-cymene)]2/TMSOTf/ZnCl2体系对炔烃进行氢氯化加成反应。在该研究领域中炔烃的氢溴化反应有关报道相对较少,2018年,Das课题组 [16] 使用催化量IPrCuCl/NaOH作为活化剂协助氨硼烷与二溴/四溴乙烷对末端的炔烃进行氢溴化加成反应。
在过去的十多年中,尽管该研究领域已取得了一定的进展,但仍存在一些局限性,尤其是对缺电子炔烃的选择性氢卤化反应研究相对较少 [17] 。本文以N-卤代丁二酰亚胺作为卤素源,NaBH4作为氢源,在无催化剂、无添加剂温和条件下、以水作为溶剂,探索了炔酸酯的氢卤化反应,其反应方程式如图1所示。
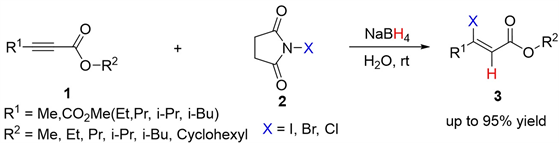
Figure 1. Hydrohalogenation of electron-deficient alkynes
图1. 缺电子炔烃的氢卤化反应
2. 实验部分
2.1. 仪器与试剂
1HNMR和13CNMR测试用Varian Inova型核磁共振仪(美国Varian);熔点测量用XT-4II型显微熔点测定仪(北京泰克仪器有限公司)。所用的化学原料:丁炔二酸二甲酯、丁炔二酸二乙酯、2-丁炔酸甲酯、2-丁炔酸乙酯、N-碘代丁二酰亚胺、N-氯代丁二酰亚胺、N-溴代丁二酰亚胺、无水硫酸镁、氯化钠、正丙醇、异丙醇、异丁醇、仲丁醇均采购于安耐吉公司,没有进行下一步的纯化;其余丁炔酸酯根据文献 [18] 制备;常用溶剂均采购于探索平台(Greagent);薄层层析硅胶板(GF254)和柱层析硅胶(200~300目)购于青岛海洋化工厂。
2.2. 实验方法
2.2.1. 底物丁炔酸酯的合成
将丁炔二酸(1 g, 6.75 mmol)、浓硫酸(0.5 mL)和相应的醇(5 mL)转移到25 mL圆底烧瓶中。80℃回流5小时,用TCL检测目标产物,反应结束后冷却至室温,减压浓缩。用2 mol/L的NaOH溶液调节体系Ph ≈ 8,再用H2O (4 × 15 mL)洗涤。有机相在无水MgSO4中干燥、过滤,乙酸乙酯(3 × 10 mL)洗涤,减压除去溶剂,粗产物利用柱层析(石油醚/乙酸乙酯)纯化,得到丁炔二酸二丙酯、丁炔二酸二异丙酯、丁炔二酸二异丁酯、丁炔二酸二仲丁酯。
2.2.2. 目标化合物的合成
在带有磁子的5 ml反应瓶中,将丁炔二酸二酯(0.21 mmol, 1.0 equiv.)溶于2 mL蒸馏水中,然后依次加入N-卤代丁二酰亚胺(NIS/NBS/NCS) (0.23 mmol, 1.1 equiv.)、分批依次加入硼氢化钠(0.25 mmol, 1.2 equiv.),置于室温条件下搅拌约1.5小时,利用薄层色谱法(TCL)检测目标产物的生成情况,反应混合物用乙酸乙酯萃取,有机相在无水硫酸镁中干燥,减压旋干溶剂,柱层析[V (石油醚):V (乙酸乙酯) = 8:1]分离纯化,得到目标产物3a~3l.
(Z)-2-碘富马酸二甲酯(3a)。产率86%,白色固体,m. p 50~51℃.1H NMR (400 MHz, CDCl3) δ7.59 (s, 1H),3.88 (s, 3H),3.83 (s, 3H)。13C NMR (100MHz, CDCl3) δ164.69,163.48,137.04,102.84,52.49。
(Z)-2-碘富马酸二乙酯(3b)。产率93%,黄色油状。1H NMR (400 MHz, CDCl3) δ7.56 (s, 1H),4.32-4.27 (m, 4H),1.35-1.32 (m, 6H)。13C NMR (100 MHz, CDCl3) δ164.37,163.04,137.18,103.36,63.78,61.71,14.24,14.19。
(Z)-2-碘富马酸二丙酯(3c)。产率75%,黄色油状。1H NMR (400 MHz, CDCl3) δ7.58 (s, 1H),4.24-4.18 (t, J = 6.4 Hz, 4H),1.76-1.69(m, 4H),0.99 (t, J = 7.6 Hz, 6H)。13C NMR (100 MHz, CDCl3) δ164.46,163.05,137.19,103.08,69.26,67.29,22.00,10.56。
(Z)-2-碘富马酸二异丁酯(3d)。产率78%,黄色油状。1H NMR (400 MHz, CDCl3) δ7.60 (s, 1H),4.04 (d, J = 8.7 Hz, 4H),2.09-1.98 (m, 2H),0.99 (d, J = 7.2 Hz, 12H)。13C NMR (100 MHz, CDCl3) δ165.03,164.47,137.25,88.22,73.66,73.21,27.89,19.14。
(Z)-2-氯富马酸二乙酯(3e)。产率94%,黄色油状。1H NMR (400 MHz, CDCl3) δ7.59 (s, 1H),4.76-4.69 (m, 4H),1.78-1.74 (m, 6H)。13C NMR (100 MHz, CDCl3) δ163.02,161.40,134.38,126.64,63.13,61.11,13.89。
(Z)-2-氯富马酸二丙酯(3f)。产率77%,黄色油状。1H NMR (400 MHz, CDCl3) δ6.93 (s, 1H),4.24 (t, J = 6.7 Hz, 4H),1.87-1.70 (m, 4H),1.05 (t, J = 7.5 Hz, 6H)。13C NMR (100 MHz, CDCl3) δ165.23,161.82,133.74,126.97,68.94,67.04,21.96,10.47。
(Z)-2-氯富马酸二异丙酯(3g)。产率76%,黄色油状。1H NMR (400 MHz, CDCl3) δ6.80 (s, 1H),5.24-4.97 (m, 2H),1.28 (d, J = 6.4 Hz, 12H)。13C NMR (100 MHz, CDCl3) δ164.71,162.99,134.02,127.18,71.55,69.03,21.88。
(Z)-2-溴富马酸二乙酯(3h)。产率95%,黄色油状。1H NMR (400 MHz, CDCl3) δ7.48 (s, 1H),4.34-4.28 (m, 4H),1.37-1.31(m, 6H)。13C NMR (100 MHz, CDCl3) δ163.52,161.65,133.46,130.61,63.30,61.14,13.91。
(Z)-2-溴富马酸二丙酯(3i)。产率77%,黄色油状。1H NMR (400 MHz, CDCl3) δ6.85 (s, 1H),4.16 (t, J = 6.7 Hz, 4H),1.71-1.69 (m,4H),0.97 (t, J = 7.4 Hz, 6H)。13C NMR (100 MHz, CDCl3) δ165.23,163.16,133.74,126.70,67.26,67.04,22.04,10.47。
(Z)-2-溴富马酸二异丙酯(3j)。产率84%,黄色油状。1H NMR (400 MHz, CDCl3) δ6.80 (s, 1H),5.22-5.02 (m, 2H),1.28 (d, J = 6.3 Hz, 12H)。13C NMR (100 MHz, CDCl3) δ164.72,163.48,134.02,131.12,71.69,69.04,21.88。
(Z)-2-溴富马酸二异丁酯(3k)。产率73%,黄色油状.1H NMR (400 MHz, CDCl3) δ6.86 (s, 1H),3.98 (d, J = 6.7 Hz, 4H),2.11-1.89 (m, 2H),0.96 (d, J = 6.7 Hz, 12H)。13C NMR (100 MHz, CDCl3) δ165.21,163.96,133.74,130.96,71.77,71.52,27.85,19.17。
(Z)-2-溴富马酸二仲丁酯(3l)。产率77%,黄色油状.1H NMR (400 MHz, CDCl3) δ6.82 (s, 1H),5.11-4.78 (m, 2H),1.62 (dt, J = 14.5, 7.3 Hz, 4H),1.65-1.58(m, 6H),0.91 (t, J = 7.5 Hz, 6H)。13C NMR (100 MHz, CDCl3) δ164.88,163.66,133.98,131.11,74.13,73.58,28.87,19.49,9.73。
(2E,4E)-2,5-二碘-3,4-二甲基-2,4-二烯二酸二乙酯(3m’)。产率68%,黄色油状。1H NMR (400 MHz, CDCl3) δ4.31 (q, J = 7.2 Hz, 4H),2.67 (s, 6H),1.36 (t, J = 7.2 Hz, 6H)。13C NMR (100 MHz, CDCl3) δ166.30,96.98,85.14,62.77,38.57,14.00。
(2E,4E)-2,5-二碘-3,4-二甲基-2,4-二烯二酸二甲酯(3n’)。产率75%,黄色油状。1H NMR (400 MHz, CDCl3) δ3.86 (s, 6H),2.68 (s, 6H)。13C NMR (100MHz, CDCl3) δ166.70,97.63,53.46,38.68,18.58。
3. 结果与讨论
3.1. 反应条件优化
以丁炔二酸二甲酯(1a),N-碘代丁二酰亚胺(2a)与硼氢化钠的反应为模板,探索了该反应的优化条件,结果列在表1中。首先考察了溶剂对反应的影响,并尝试了1,2-二氯乙烷(DCE)、甲醇(MeOH)、乙腈(MeCN)、四氢呋喃(THF)、乙醇(EtOH)、N,N-二甲基甲酰胺(DMF)、N,N-二甲基亚砜(DMSO)、乙酸乙酯(EtOAc)、苯(PhH)和水(H2O)等溶剂。结果发现,1,2-二氯乙烷,N,N-二甲基亚砜和苯作为溶剂时反应几乎没有发生(Entry 1、Entry 7和Entry 9)。N, N-二甲基甲酰胺、乙醇、乙腈、四氢呋喃为溶剂时目标产物的收率相对较低(14~49%)。以甲醇(Entry 2)、乙酸乙酯(Entry 8)、水(Entry 10)为溶剂进行反应,均能得到产率为86%的目标产物3a。考虑到水是绿色的溶剂,故选择水为该反应的最佳溶剂。后续考察了反应物投料量对反应的影响。其他条件不变,当2a的投料量分别从1.1当量逐渐降低至0.9和1.0当量时,目标产物的产率从86%降到72%和83% (Entry 11和Entry 12),但当2a的投料量增加到1.2当量时,目标化合物的产率并未如期得到提高,而是保持86%的产率(Entry 13),因此选择2a的最佳投料量为1.1当量;随后保持2a的投料量不变,探究NaBH4的投料量对反应的影响,当NaBH4的投料量降到0.9当量时,反应产率为77% (Entry14),当NaBH4的投料量增加到1.2当量时产率没有变化,得到86%产率的3a (Entry15)。结果表明NaBH4的投料比增大对该反应影响不显著。
综上所述,该反应的最佳反应条件为:丁炔二酸二甲酯(1a, 1.0 equiv)和N-碘代丁二酰亚胺(2a, 1.1 equiv),NaBH4 (1.2 equiv)以蒸馏水为溶剂,反应温度为室温。

Table 1. Optimization of reaction conditions
表1. 反应条件优化
Yield表示产物3a的分离产率,在室温条件下反应,溶剂为水。
3.2. 底物的拓展
确定了最佳反应条件后,进一步探索了该反应的底物适应性,如图2所示。首先探索对称丁炔二酸二酯与N-碘代丁二酰亚胺(2a)的反应性研究。其中丁炔二酸二甲酯为原料时,反应产率为86% (3a);当丁炔二酸二酯的取代基为乙基(-Et)时,化合物3b的产率可高达93%;当取代基为正丙基(-Pr)时,产率降低得到75%产率的目标化合物3c;而取代基为仲丁基(sec-Bu)时,化合物3d的产率为78%,由此不难发现随着对称炔酸酯中取代基碳链的增大,目标化合物产率逐渐降低,这表明,空间位阻对该反应具有一定的影响。
然后考察具有不同取代基的丁炔二酸二酯与N-氯代丁二酰亚胺(2b)的反应,可以发现随着丁炔二酸二酯中的取代基中碳原子数目的增加,目标产物对应的产率有所下降,如3e产率高达94%但3g的产率仅有76%,由此可以推测原料丁炔二酸二酯的结构尤其是取代基的支链结构对于碳碳三键的氢氯化加成的产率有着显著的影响。但令我们惊讶的是,丁炔二酸二环己酯作为底物时,并没有如期获得相应的氢氯化产物或加氢还原产物。
随后探索了具有不同取代基的丁炔二酸二酯与N-溴代丁二酰亚胺(2c)的反应,当使用丁炔二酸二乙酯和丁炔二酸二丙酯进行反应时,分别得到相应的氢溴化产物3h (95%)和3i (77%),不难发现随着炔酸酯中直链取代基中碳原子数目的增加,目标化合物的产率相应下降;但当丁炔二酸二酯的取代基分别为异丙基(-iPr)、仲丁基(sec-Bu)、异丁基(iso-Bu)时,得到的产物3j、3k和3l的产率分别为84%、73%、77%,可以发现其产率远不及化合物3h和3i的产率,考虑到原料炔酸酯中取代基的空间位阻可能是影响目标化合物产率低下的主要原因。
最后尝试了不对称丁炔酸酯,如:2-丁炔酸甲酯和2-丁炔酸乙酯与NIS的反应,可惜得不到预测的氢碘化产物,相反分别得到了相应的自身偶联产物3m’(68%)和3n’(75%)。
图2. 炔酸酯的氢卤化反应
3.3. 反应机理
为了验证反应的机理,在最优反应条件下:丁炔二酸二甲酯,NIS与NaBH4的反应体系中添加1.0当量自由基捕获剂2,2,6,6-四甲基哌啶-1-氧自由基(TEMPO)时仍然能得到82%产率的目标化合物3a,该实验结果表明反应以离子型反应为主。初步的实验结果和相应的文献 [19] [20] 基础上预测了反应的机理,如图3所示,首先N-卤代丁二酰亚胺(NXS)提供的卤素正离子与炔烃相互作用生成亲电性的卤鎓离子中间体I,而后从硼氢化钠释放出的具有亲核性的H−进攻中间体I生成目标产物3,因为H−从卤鎓离子的背面进攻,所以主要生成反式加成产物。
图3. 反应机理预测
4. 结论
本文建立了一种在无催化剂、添加剂的温和条件下以缺电子炔酸酯、N-卤代丁二酰亚胺和硼氢化钠为原料高效合成烯基卤化物类化合物的新方法。该反应中,不同电子和空间特征的缺电子炔烃与多种卤素源(NIS、NCS、NBS),在水作为溶剂的室温条件下顺利进行,得到产率高达73%~95%的目标产物3a~3l。本工作中报道的方法具有原料易得、操作简单、条件温和、适应性广等优点。
基金项目
新疆储能及光电催化材料重点实验室(No.XJDX1709-2022-02)资助项目。
参考文献
NOTES
*通讯作者。