1. 前言
慢性淋巴细胞白血病(chronic lymphocytic leukemia, CLL)是一种主要发生在中老年人群的一种成熟B淋巴细胞克隆增殖性肿瘤,其特征为CD5+小淋巴细胞在外周血、骨髓、脾脏和淋巴结中异常聚集 [1] 。随着新的治疗策略出现,CLL患者的生存率逐渐提高,据2022年美国权威的癌症统计数据库(Surveillance, pidemiology, and End Results, SEER)的统计,CLL的总体5年相对生存率为87%,但除异基因造血干细胞移植外仍无法完全治愈 [2] [3] [4] ,CLL的发病机制及潜在治疗靶点仍需进一步研究。
CLL患者外周血中CD4+ T辅助细胞亚群数量及功能存在紊乱,T辅助细胞亚群在CLL中分泌不同的细胞因子并发挥特定的免疫功能。CD4+ T细胞包括辅助性T细胞(helper T cell, Th) 1、Th2、Th17、调节性T细胞(regulatory cell, Treg)、滤泡性调节性T细胞(follicular regulatory T-cell, Tfr)以及滤泡性辅助性T细胞(follicular helper T cell, Tfh细胞)等 [5] 。滤泡辅助性T细胞是由Schaerli和Breifeld在2000年发现的,它属于一种特殊CD4+ T细胞亚群,可促进B细胞成熟、决定B细胞分化为记忆B细胞或浆细胞,同时调节抗体的产生与类别转换,在维持免疫稳态方面发挥着关键作用。Tfh细胞表面表达CD4+CXCR5+PD-1+ICOS+,并且分泌白细胞介素(interleukin, IL)-4,IL-21,CXCL-13等。Tfh细胞在破坏正常免疫功能和调节肿瘤细胞增殖方面发挥作用需进一步探索。
Tfh细胞通过分泌不同的细胞因子并发挥特定的免疫功能。其中IL-21是参与产生Tfh细胞的关键细胞因子,可通过自分泌方式上调CXCR5和ICOS的表达,影响Tfh细胞和B细胞的相互作用,从而促进Tfh细胞分化和功能发育 [6] 。Tfh对B细胞的支持即主要通过CD40L和IL-21信号传导提供。IL-21主要由活化的CD4+ T细胞、NK细胞、Tfh细胞、Th17细胞分泌,是一种多功能细胞因子 [7] ,它与由幼稚和生发中心B细胞表达的IL-21R结合,二者形成复合物后通过包括JAK-STAT、PI3K和MAPK在内的通路进行转导,IL-21和BCR在体外的组合通过IL-21诱导的Blimp-1的转录直接激活幼稚B细胞向浆细胞的分化。临床研究表明,IL-21的异常表达和自身免疫性疾病在多种肿瘤的发生、发展中发挥重要作用 [8] 。
在包括T细胞,自然杀伤(NK)细胞、调节性T (Treg)细胞、rδT细胞和B细胞的许多免疫细胞亚群均在肿瘤微环境中产生γ干扰素(IFN-γ),IFN-γ是一种可溶性二聚体细胞因子,在免疫领域具有十分亮眼的表现,在协调固有和适应性免疫反应中发挥重要作用 [9] 。随着对肿瘤微环境的深入研究,IFN-γ似乎具有双重作用,协调促肿瘤和抗肿瘤两种免疫反应 [10] 。IFN-γ在肿瘤免疫中的作用或许取决于肿瘤特异性环境,而在CLL肿瘤免疫中的作用及其潜在治疗意义需进一步探索。
2. 材料与方法
流式抗体CD4-FITC、IL-21-PE、IFN-γ-FITC及同型对照抗体、IgG1-FITC、IgG2a-PE均购自美国BD公司,抗体PE-CXCR5购自Biolegend公司;高速离心机和酶标仪购自美国Thermo公司,FACS Arias II流式细胞仪购自美国贝克曼公司。
3. 研究对象
将2022年12月至2023年6月期间于新疆医科大学第一附属医院血液科住院接受治疗的30例CLL患者作为研究对象,所选病例诊断均符合《中国慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的诊断与治疗指南(2022年版)》,选取同期健康体检者20例设为对照组。所有研究对象均签署知情同意书,本研究经新疆医科大学第一医院伦理委员会审核同意。CLL患者组共30例,其中男性20例(66.7%),女性10例(33.3%),中位年龄63.70岁;健康对照组共20例,其中男性9名(57.5%),女性11名(42.5%),中位年龄65.15岁,CLL患者和健康对照人群性别、年龄指标具有可比性(P > 0.05) (表1)。

Table 1. The general clinical formation of CLL group and control group
表1. CLL患者和对照组一般临床资料
4. 标本采集
获取知情同意后,分别采集30例CLL患者和20例健康对照者清晨空腹平卧位肘静脉血约2 ml于EDTA真空抗凝管,并保存于4℃冰箱中,在8小时内进行相关检测,否则弃用。
5. 流式细胞检测
流式细胞仪质控,各通道PASS,取收集的样本全血100 μl加入流式管,在流式管中加入下列荧光标记抗体:CD4-FITC、CXCR5-PE各5 μl,并设同型对照,室温避光孵育15~30分钟。裂解红细胞,在装有破膜及固定好细胞的流式管中加入相应的IL-21,IFN-γ抗体,同型对照管中分别加入5 μl IgG1-FITC、IgG2a-PE,上机检测。使用FACS Aria II流式细胞仪(美国BD公司)进行数据采集,将来自20名健康对照和30名CLL患者的血液样本采集到的数据应用FlowJo软件进行分析,先以FSC和SSC设门圈出淋巴细胞,再以CD4设亚门,圈出CD4+T淋巴细胞,在此基础上分析CD4+CXCR5+Tfh细胞百分比,最后对IL-21和IFN-γ的这两种表达水平进行检测分析。
6. 统计学分析
实验所获数据采用SPSS26.0分析软件进行统计学处理。临床基本资料采用中位数(范围)、百分率表示,用均数 ± 标准差(
)描述计量资料。临床各组计量数据经方差齐性检验(Levine检验)后,符合正态分布采用独立样本t检验,非正态分布资料则采用非参数的检验,认为P < 0.05具有统计学意义。
7. 结果
7.1. CLL患者和HC组Tfh细胞及其分泌的IL-21和IFN-γ水平
我们通过流式细胞术分别测定了CLL患者和健康对照者外周血中IL-21+IFN-γ−Tfh、IL-21−IFN-γ+Tfh、IL-21+IFN-γ+Tfh水平如下图所示(见图1)。
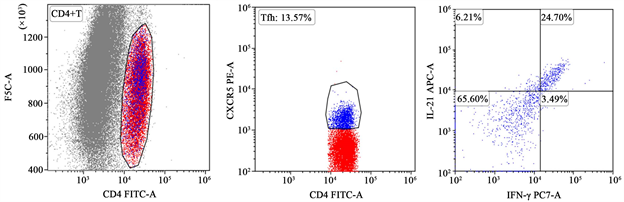
Figure 1. Flow chart of Tfh cells and the level of IL-21, IFN-γ in CLL group
图1. CLL组Tfh细胞及其分泌的IL-21、IFN-γ水平流式图
7.2. CLL患者与健康对照组Tfh细胞比例差异
用流式细胞术检测30例CLL组和20例对照组外周血Tfh细胞百分比,结果表明,CLL组Tfh细胞比例为(14.95 ± 8.02)%,健康组Tfh细胞比例为(7.67 ± 4.59)%,CLL组外周血Tfh细胞水平显著高于对照组,差异有统计学意义(t = −3.67, P < 0.05) (见表2,图2)。

Table 2. Tfh cell proportions between CLL group and healthy group (%,
)
表2. CLL组及健康组Tfh细胞比例比较(%,
)
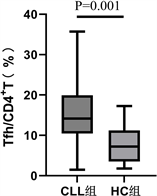
Figure 2. Difference of Tfh cell proportion in CLL and HC group
图2. CLL组和HC组Tfh细胞比例差异
7.3. CLL患者及对照组Tfh细胞表达IL-21、IFN-γ的水平的比较
用流式细胞术胞内染色法,CLL患者外周血中Tfh细胞表达的IL-21+IFN-γTfh/Tfh和IL-21+IFN-γ+Tfh/Tfh比例高于HC组,两组间具有统计学差异(P < 0.05);而CLL患者外周血中Tfh细胞表达的IL-21−IFN-γ+Tfh/Tfh比例与HC组之间不具有统计学差异(P > 0.05) (见表3,图3)。

Table 3. The level of IL-21, IFN-γ expressed by Tfh cells (%,
)
表3. Tfh细胞表达IL-21和IFN-γ水平(%,
)
7.4. Tfh细胞表达IL-21、IFN-γ水平在不同CLL临床指标分组间的比较
不同临床分组间分析结果显示,CLL患者淋巴细胞高于均值组和淋巴结肿大组外周血中IL-21+IFN-γ−Tfh/Tfh细胞比例均较高(P < 0.05),而在不同血红蛋白水平、血小板水平、β2微球蛋白水平及有无脾肿大组间无统计学差异(P > 0.05);而CLL患者淋巴细胞高于均值组和高β2微球蛋白组的IL-21+IFN-γ+Tfh/Tfh细胞比例较高,差异具有统计学意义(P < 0.05),在其余不同血红蛋白水平、血小板水平等分组间无明显差异(P > 0.05) (见表4)。

Figure 3. Expression levels of IL-21 and IFN-γ in CLL Group Tfh cell
图3. CLL患者Tfh细胞表达IL-21和IFN-γ水平

Table 4. Comparison of IL-21 and IFN-γ expression levels in CLL Tfh among different clinical groups (%,
)
表4. CLL患者Tfh细胞表达IL-21、IFN-γ水平在不同临床指标分组间的比较(%,
)
注:*P < 0.05。
7.5. Tfh细胞表达IL-21、IFN-γ水平在与临床分期及高危预后指标相关性
不同临床分期分组分析显示,CLL患者外周血中IL-21+IFN-γ−Tfh/Tfh细胞比例在不同Rai分期、Binet分期、IPI评分、有无IGHV突变间无统计学差异(P > 0.05);IPI指数为高危、极高危组及无IGHV突变组的CLL患者外周血IL-21+IFN-γ+Tfh/Tfh细胞比例较高,差异具有统计学意义(P < 0.05),在其余不同临床分期分组间无明显差异(P > 0.05) (见表5)。

Table 5. The correlation between the expression of IL-21, IFN-γ levels in Tfh cells and clinical staging and high-risk indicators (%,
)
表5. Tfh细胞表达IL-21、IFN-γ水平比例与临床分期及高危指标相关性(%,
)
注:*P < 0.05。
8. 讨论
慢性淋巴细胞白血病不同患者的预后呈高度异质性 [11] 。CLL的病因和发病机制尚不明确,由单克隆B淋巴细胞增多症(MBL),最终演变为CLL是由遗传学、表观遗传异常、B细胞受体(BCR)通路异常、肿瘤微环境和T细胞因素共同决定的 [12] 。目前采用传统免疫化疗和新的靶向抑制剂等治疗方案,取得一定疗效。CLL患者机体内存在T细胞亚群构成比例失衡、功能失调所造成免疫功能失衡可能是CLL进展的重要原因之一。
尽管基因改变在CLL的发病机制中起着关键作用,但有研究表明,CLL B细胞(B-CLL)与辅助性T细胞的相互作用对B-CLL的增殖和促进其对细胞凋亡的抵抗至关重要 [3] 。每个CD4+ T细胞亚群在CLL发病机制中的意义仍存在争议。
在Th亚群中,辅助性T卵泡细胞(Tfh)是支持生发中心(GC)B细胞分化和存活的主要亚群 [13] 。Tfh细胞的分化经过几个阶段,在黏附分子CCR7和CCL21的共同作用下,原始T细胞迁徙到淋巴结副皮质区,树突状细胞(dendritic cells, DCs)或巨噬细胞(Macrophage cells)刺激T细胞,下调CCR7,上调C-X-C趋化因子受体5 (C-X-C motif chemokine receptor type 5, CXCR-5),分化为Tfh细胞。B细胞淋巴瘤6蛋白的(Bcl-6)是Tfh细胞的主要转录因子。在CXC趋化因子配体13 (chemokine C-X-C motif ligand 13, CXCL13)的作用下,CXCR5介导Tfh细胞迁移至淋巴滤泡T-B细胞交界处并与B细胞相互作用,B细胞表面的SLAM (signalling lymphocytic activation molecule, SLAM)和T细胞表面的SLAM相关蛋白(SLAM-associated protein, SAP)相互作用形成稳定的T-B细胞连接 [13] 。目前对Tfh细胞在不同类型恶性血液病中的作用研究侧重点不同。Tfh细胞在淋巴瘤、多发性骨髓瘤患者的相关研究中比例升高 [14] [15] [16] [17] [18] ,但其在骨髓增生异常综合征患者比例却偏低 [19] [20] 。各种疾病中Tfh细胞亚群比例不同,并且在疾病进展或治疗各阶段,其比例表现出动态变化。
许多研究报告了CLL患者中T细胞亚群和功能的异常,如先前的一项报道,在CLL患者中CD4+ T细胞中Th1细胞的百分比高于HD患者,而在任何其他亚群(Th2、Th17或Treg)却没有明显差异 [21] ;本研究通过流式细胞术对CLL患者外周血中滤泡辅助性T细胞这一亚群比例进行了分析,结果与WU X等人的研究一致,CLL患者的外周血中Tfh细胞异常升高。既往有研究讨论了Tfh细胞与患者免疫状态和肿瘤负荷以及临床高危指标的关系,发现CLL患者外周血中Tfh细胞百分比随着Rai分期的增加而增加,在该报道中还提到了Tfh细胞水平与IGHV突变状态缺乏关联,据此推测Tfh细胞的比例的改变或许可以作为CLL中反映淋巴组织受累严重程度和疾病进展的替代生物标志物。
为进一步探讨在CLL患者中Tfh细胞的细胞因子分泌特点,本研究采用流式细胞术胞内染色法分析CLL患者的细胞因子IL-21及IFN-γ表达水平,目前已经发现IL-21的主要来源是Tfh细胞、Th17和调节性T (Treg)细胞。在许多报道中,Tfh细胞部分以依赖IL-21的方式促进异常GC反应,并增强浆细胞自身抗体的产生作用,并且也作用于免疫球蛋白类别转换 [22] [23] 。
对于在CLL中IL-21这一靶点的研究及其免疫作用机制的研究尚不充分。本研究发现与对照组相比,CLL患者Tfh产生的IL-21水平升高,并且IL-21+IFN-γ−Tfh、IL-21+IFN-γ+Tfh的比例与在单克隆B淋巴细胞计数较高组中呈高表达,而与血红蛋白计数、血小板计数、脾大无明显相关性,这些数据表明这两种细胞因子在诱导CLL肿瘤细胞扩增中可能有意义。这一结果与Pascutti MF的研究一致,在CLL患者中产生IL-21的T淋巴细胞有助于恶性B细胞增殖,并且在CLL患者淋巴结中也检测到IL-21水平升高 [24] 。IL-21对B-CLL细胞的增殖是关键的,有报道IL-21诱导CLL肿瘤细胞存活率增加 [25] ,IL-21可能是抗肿瘤免疫相关的关键细胞因子,而IFN-γ对B-CLL细胞生长没有直接影响,推测由Tfh细胞介导的CLL肿瘤增殖是依赖于IL-21,而不依赖于IFN-γ的产生。类似的发现,有淋巴结肿大的CLL患者外周血中IL-21+IFN-γ−Tfh水平较无淋巴结肿大的患者高,因此,本研究的数据也支持IL-21+Tfh细胞参与CLL疾病的进展,这为将来使用抗IL-21或阻断IL-21R为未来的IL-21靶向治疗提供了线索。
IFN-γ是近60余年发现的II型干扰素家族中唯一的成员,IFN-γ可通过IFN-γ受体传导信号,磷酸化STAT1和上调B细胞中的T-bet来诱导GC的形成 [26] 。IFN-γ是一种多效性细胞因子,在协调先天免疫反应和适应性免疫反应方面发挥着重要作用。有研究认为IFN-γ在体外已被证明可直接抑制B-CLL细胞凋亡,血浆IFN-γ或IFN-γ在B-CLL细胞水平上的表达与疾病进展相关 [27] [28] ,但本研究中的数据提示CLL患者与对照组Tfh细胞表达的IFN-γ未见明显差异,IL-21−IFNγ+Tfh的比例与肿瘤负荷无相关性,推测CLL-Tfh不以依赖IFN-γ的方式诱导CLL患者肿瘤细胞增殖。
在不同CLL临床分期及高危指标分组间Tfh细胞表达IL-21、IFN-γ水平,IPI指数评估预后低危、中危组CLL患者组外周血中IL-21+IFN-γ+Tfh细胞比例比IPI指数评估预后高危、极高危组高,二者差异有统计学意义,但IL-21+IFN-γ−Tfh细胞比例在两组中无明显差异,提示这两种细胞因子协同作用,与CLL患者不良预后相关。然而Tfh细胞IL-21和IFN-γ的表达水平在不同Rai和Binet分期中均未见明显差异,或许与使用单独的预后评估方式具有局限性有关。
综上,本研究表明,CLL患者Tfh细胞及其分泌的细胞因子IL-21、IFN-γ高表达,Tfh细胞的积累及IL-21与B-CLL克隆增殖相关,可能有助于支持CLL细胞的增殖、参与CLL的免疫发病机制,可以作为评估CLL患者分期及预后评估的参考指标。IFN-γ在其中的作用尚不明确,经过治疗后Tfh细胞的比例失衡是否有所扭转还需要进一步研究。
NOTES
*通讯作者。