1. 前言
钢筋混凝土已成为世界上应用最为广泛的结构材料,然而大量的结构在未达到设计使用寿命前就出现了耐久性问题,混凝土结构的过早失效给国家造成巨大的经济损失,同时危机人们的生命财产安全。钢筋锈蚀被列为造成结构破坏的第一大元凶,而诱使钢筋锈蚀的主要原因是服役环境中氯盐的侵入[1] [2] 。我国东南沿海绵延上万公里的海岸线且包括众多岛屿,西北地区拥有察尔汗盐湖、茶卡盐湖、巴里坤盐湖等众多盐湖及盐渍土,海洋与盐湖环境中氯盐的存在将严重威胁到钢筋混凝土结构的安全性。随着我国西部大开发战略和向海洋进军计划的实施,越来越多的混凝土结构被用在严酷环境中,如已投入使用的杭州湾跨海大桥、兰新高铁、正在建设的港珠澳大桥等,如何保证混凝土结构服役期间的安全性、耐久性将是一大挑战。因此,加强氯盐环境下混凝土结构的耐久性研究,探明氯离子在混凝土中的传输行为与过程成为科研者工作面临的重大课题。
研究氯离子在混凝土中传输的关键是确定氯离子在混凝土中的浓度分布,目前测定氯离子浓度的常用方法有化学滴定法和直接电位法 [3] [4] 。化学滴定法是以AgNO3标准溶液作滴定剂、以指示剂颜色变化判定终点,该方法的不足之处是指示剂颜色判定因人而异,滴定终点判断不准。直接电位法是预先制定标准氯盐溶液浓度与其电位的标准曲线,利用电极测得待测溶液的电位通过查找标准曲线获得对应的氯离子浓度,该方法易受待测溶液中其他离子的干扰,误差较大。沉淀–电位滴定法仍是以AgNO3标准溶液作滴定剂使氯离子形成AgCl沉淀,以滴定过程中溶液电位的突变判定终点,该方法相比于化学滴定法和直接电位法准确度较高、结果客观、效率高,目前已在水检、药检、石油化工等行业得到广泛应用。本研究尝试采用沉淀–电位滴定法测定混凝土中氯离子含量,为研究氯盐环境下混凝土中氯离子浓度分布提供可靠手段。
2. 试验部分
试剂:0.005 mol/L的AgNO3标准溶液;0.5%的酚酞溶液(0.5 g酚酞,95 mL无水乙醇 + 5 mL蒸馏水);稀硫酸(浓硫酸:蒸馏水 = 1:50,体积比);0.01 mol/L的NaCl标准溶液。
混凝土试样的制备:所用混凝土的配合比及基本性能如表1所示,成型试样为100 mm立方块,经24小时脱模后在标准条件下(RH ≥ 95%,20℃)养护60天,然后浸泡于3% NaCl溶液中。当浸泡时间分

Table 1. Mix proportion and basic properties of concrete
表1. 混凝土配合比及基本性能
别为3个月、6个月和1年时,取出试样,采用立式钻床钻取深度为0~5 mm的粉末,分别标记为样品1、样品2和样品3。
仪器设备:自动电位滴定仪(ZDJ-4A,上海雷磁),配备银电极(指示电极)和甘汞电极(参比电极);离子色谱仪(IC-881,瑞士万通);电子天平,精确至0.0001 g。
试验过程:1) 将钻取的混凝土粉末在105℃下干燥24小时,然后用0.15 mm方孔筛筛除大颗粒后备用;2) 用电子天平称取2 g左右粉末置于三角瓶中,加入50 mL蒸馏水浸泡24小时,且在浸泡过程中振荡三角瓶3~5次;3) 将浸泡后的溶液用中速定性滤纸进行过滤,用移液管移取10 mL滤液置于玻璃杯中,滴加1滴酚酞溶液作指示剂,用稀硫酸中和至无色,然后将玻璃杯置于自动电位滴定仪上用已知浓度的AgNO3标准溶液进行滴定,滴定过程中玻璃杯底部有搅拌子进行搅拌。
3. 试验原理
沉淀–电位滴定法以已知浓度的AgNO3溶液作滴定剂,使待测溶液中的氯离子形成AgCl沉淀,以滴定过程中溶液电位的突跃判定终点。进行电位滴定时,被测溶液中同时插入银电极和甘汞电极,分别用作指示电极和参比电极,以此组成工作电池。随着滴定剂的加入,不断生成AgCl沉淀,氯离子浓度不断降低,溶液的电位E也相应地发生变化,当滴定至终点时,溶液中的氯离子浓度会连续变化多个数量级,引起电位的突跃,此时记录所消耗的AgNO3溶液的体积 [5] 。待测溶液中氯离子的浓度可通过以下公式计算:
 (1)
(1)
其中: ——待测溶液中氯离子浓度(mol/L);
——待测溶液中氯离子浓度(mol/L); ——所用AgNO3标准溶液的浓度(mol/L);
——所用AgNO3标准溶液的浓度(mol/L); ——所消耗的AgNO3标准溶液的体积(mL);
——所消耗的AgNO3标准溶液的体积(mL);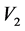 ——移取的待测溶液的体积(mL)。
——移取的待测溶液的体积(mL)。
若将结果表示为粉末样品中氯离子的含量,则:
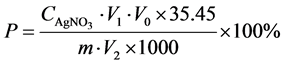 (2)
(2)
其中:P——样品中氯离子质量百分数(%); ——所用AgNO3标准溶液的浓度(mol/L);
——所用AgNO3标准溶液的浓度(mol/L);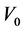 ——浸泡样品所用蒸馏水体积(mL);
——浸泡样品所用蒸馏水体积(mL);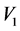 ——所消耗的AgNO3标准溶液的体积(mL);
——所消耗的AgNO3标准溶液的体积(mL); ——移取的待测溶液的体积(mL);m——称取的粉末样品的质量(g)。
——移取的待测溶液的体积(mL);m——称取的粉末样品的质量(g)。
为进一步阐明沉淀–电位滴定法及验证其结果的可靠性,采用该方法连续两次滴定浓度为0.01 mol/L的NaCl标准溶液。如图1所示,随着AgNO3溶液体积的增加,溶液的电位呈上升趋势。将电位E对AgNO3溶液体积V进行求导,则得到微分曲线。显而易见,微分曲线上存在明显的峰值点,即所谓的突跃点(滴定终点),依据此点得到消耗的AgNO3标准溶液的体积量分别为19.94 mL、19.96 mL。利用式(1)计算得到所测NaCl溶液的浓度分别为0.0097 mol/L、0.0098 mol/L,与实际浓度的偏差分别为3%、2%,其结果可靠性高,重复性强。
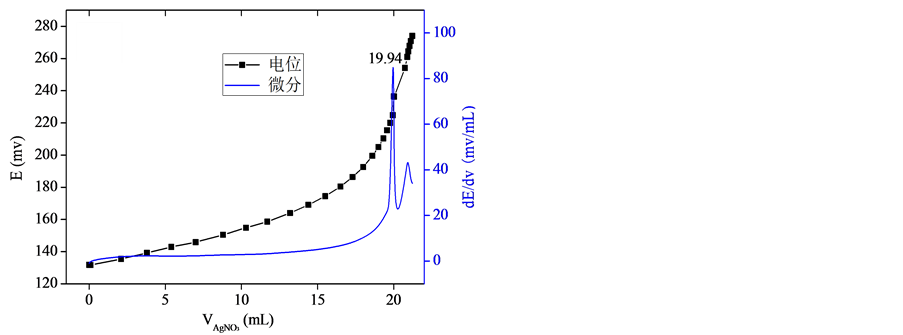
 (a) (b)
(a) (b)
Figure 1. The titration of standard NaCl solution. (a) For the first time; (b) for the second time
图1. NaCl标准溶液的滴定. (a) 第一次;(b) 第二次
4. 试验结果与分析
众所周知,水泥水化产生大量的Ca(OH)2和碱金属氢氧化物,溶液呈强碱性,其硬化水泥浆体仍然保持较高的碱度(通常pH > 13) [6] 。本研究中钻取的三个混凝土粉末样品加入蒸馏水浸泡后,其滤液的pH皆大于12.5。为研究溶液的碱度对滴定结果的影响,在滴定前设计了两组试验进行对比:一组未用稀硫酸中和,直接滴定;另一组采用稀硫酸中和,以酚酞溶液作指示剂。图2和图3分别是未中和与中和后待测溶液的滴定结果。从图2和图3可以看出,无论待测溶液中和与否,在滴定的过程中都能出现电位的突跃(滴定终点),但是达到滴定终点时所消耗的AgNO3溶液的体积量不同,未中和溶液消耗的AgNO3溶液的体积量整体上大于中和后的溶液。根据式(2)将结果表示为粉末样品的氯离子含量,如表1所示。为进一步评价中和与否对滴定结果的影响,本研究同时采用离子色谱(IC)对同一滤液中的氯离子浓度进行测试,并以此结果对采用沉淀-电位滴定法得到的结果进行评判。
如表2所示,当待测溶液未中和时采用沉淀–电位滴定法测得的氯离子含量与离子色谱法测得结果偏差较大,其中样品3的偏差已接近30%;而将待测溶液用稀硫酸中和后,其滴定结果与离子色谱法测得结果极为接近,最大偏差仅为5.3%。分析其原因,未中和溶液呈强碱性,在滴定过程中Ag+易与OH−结合形成AgOH沉淀,但AgOH在常温条件下极不稳定,易分解为微溶于水的褐色Ag2O固体,其反应过程如式(3)所示,这一反应的存在影响了滴定结果。图4是中和与未中和溶液滴定后的颜色对比,可以看出,中和后的溶液生成了白色的AgCl沉淀,而未中和溶液滴定后呈褐色,该现象佐证了以上的理论分析。
 (3)
(3)
5. 结论
采用沉淀–电位滴定法可以测定混凝土中的氯离子含量,待测溶液的碱度影响其测试结果的准确性;当待测溶液未中和时,采用沉淀–电位滴定法测得结果与离子色谱法结果偏差较大,最大偏差接近30%;而将待测溶液用稀硫酸中和后,其滴定结果与离子色谱法测得结果极为接近,最大偏差仅为5.3%。该方法操作简单、结果可靠性高、使用性强,且相比于离子色谱法具有较高的经济性,可以作为标准方法用于测试水泥基材料中的氯离子含量。
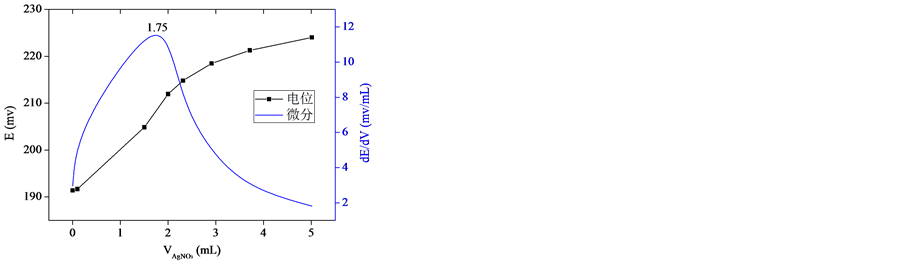
 (a) (b)
(a) (b)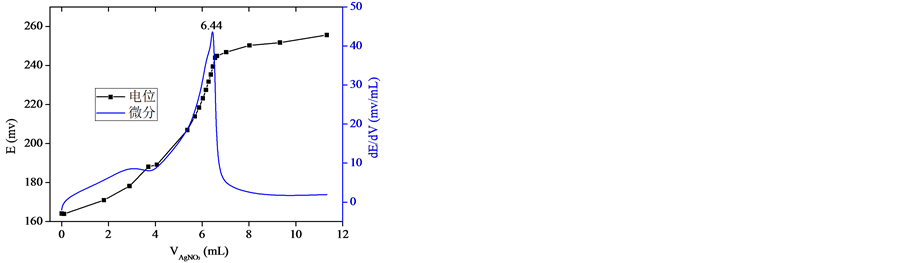 (c)
(c)
Figure 2. Titration results of non-neutralized solution. (a) Sample 1; (b) Sample 2; (c) Sample 3
图2. 未中和溶液的滴定结果。(a) 样品1;(b) 样品2;(c) 样品3

 (a) (b)
(a) (b) (c)
(c)
Figure 3. Titration results of neutralized solution. (a) Sample 1; (b) Sample 2; (c) Sample 3
图3. 中和溶液的滴定结果。(a) 样品1;(b) 样品2;(c) 样品3

Table 2. Experiment results and deviation
表2. 试验结果与偏差

Figure 4. Color contrast of non-neutralized solution and neutralized solution after titrating
图4. 中和与未中和溶液滴定后颜色对比
基金项目
国家重点基础研究发展计划(973计划) (2015CB655102);国家自然科学基金(51178106, 51378116 & 51408597);中国铁路总公司科技发展项目(2013G001-A-2)。
*第一作者。
#通讯作者。