1. 引言
随着人类经济社会的不断发展,人们的生活水平不断提高的同时,化石能源这种不可再生的资源却在急剧减少,而随之所带来的能源危机和环境污染也严重地阻碍着人类未来的可持续发展。因此,开发出一种绿色环保的新型能源来代替传统的化石能源具有深远的意义 [1] 。葡萄糖氧化酶生物燃料电池是以葡萄糖氧化酶作为生物催化剂,将燃料葡萄糖的的化学能转化为电能的一种新型发电装置。相比于传统的燃料电池,酶生物燃料电池具有运行过程绿色环保、燃料来源广泛、反应条件温和、生物相容性好等优点 [2] [3] 。
目前葡萄糖氧化酶燃料电池的研究和使用还处于不成熟阶段,电池的输出功率小、使用寿命短是影响其发展和应用的主要问题 [4] 。解决以上问题的有效途经就是寻找合适的酶催化剂的固定载体,使酶的活性中心与电极材料之间实现快速的电子转移。介孔材料不仅具有良好的生物相容性,还拥有优异的介观结构和可调的孔径尺寸,这些优势都让其成为固定化酶的理想载体 [5] 。二氧化硅介孔泡沫分子筛(MCFs, Mesostructured Cellular Foams)以其蜂窝状介孔泡沫结构以及较大的孔径,已经广泛应用于葡萄糖氧化酶的固定研究领域中 [6] 。经过碳化后的MCFs除了具有介孔材料的上述特点之外,相对硅基材料还具有更高的化学稳定性、高水热电阻和优越的电导性。因此,碳基介孔材料被大量地用作燃料电池和超级电容器的电极材料,并且有望在未来大大提高生物传感器和酶燃料电池的使用性能 [7] [8] 。本文通过使用糠醇为碳源,对二氧化硅泡沫分子筛进行碳化处理制备出介孔碳材料C-MCF (Carbon-based Mesostructured Cellular Foams)。通过SEM、TEM和氮气吸附–脱附对碳化前后的介孔材料进行表征,对比其外部形貌和内部孔道结构的变化。最后探究了碳化前后的介孔材料对葡萄糖氧化酶的吸附性能的变化,讨论了介孔材料形貌和结构的改变对其吸附性能的影响。
2. 实验
2.1. 原料与试剂
三嵌段共聚物聚氧乙烯–聚氧丙烯–聚氧乙烯(Pluronic P123, MW = 5800, EO20PO70EO20),葡萄糖氧化酶(EC 1.1.3.4),购自美国Sigma公司。正硅酸乙酯(TEOS),1,3,5-三甲苯(TMB),糠醇(FA),氢氧化钠(NaOH),均购自成都市科龙化工试剂厂。试验所有用水为二次去离子水。
2.2. MCFs介孔泡沫分子筛的制备
硅基泡沫介孔分子筛(MCFs)的制备方法采用之前文献所报道的微乳液模板法 [9] ,其具体合成过程如下:秤取2.0 g P123放置于250 ml的烧杯中,溶解到60 mL浓度为2.3 mol/L的HCl溶液并在室温下于磁力搅拌器中慢速搅拌4 h待其充分溶解,之后向溶液中缓慢滴入2.0 g扩孔剂TMB,升温至40℃并于磁力搅拌器中强力搅1 h后,缓缓加入4.4 g TEOS持续剧烈搅拌5 min后停止,随即保持40℃静置20 h。然后将混合液置于具有聚四氟乙烯内衬的水热晶化釜中,在100℃的烘箱中水热晶化处理24 h。待产物冷却至室温后过滤得到白色固体,在50℃下真空干燥,最后所得样品在550℃的马弗炉中高温焙烧5 h后自然冷却至室温得到的白色粉末即为MCFs。
2.3. 以糠醇为碳源对MCFs进行碳化处理
为了在MCFs内部结构中创造出更多有利于有机碳前驱体发生聚合反应的酸性催化位点,因此需要将活性金属Al原子嵌入其骨架之中,Al的嵌入通过将模板剂MCFs浸渍到AlCl3的溶液中实现(Si/Al = 20)。糠醇的引入参考文献报道合成NCC-1-x的方法 [10] ,具体过程如下:将1.0 g的Al-MCFs 浸渍于8 mL糠醇含量为25%的TMB溶液中,混合溶液在真空条件下保持80℃加热12 h,随后升温至150℃加热6 h待糠醇聚合。将以MCFs模板剂所制备出的C/Si复合物样品在N2保护气氛下,置于管式炉高温碳化,并以1℃∙min−1的速度升温至300℃,5℃∙min−1升温至850℃并在该温度下保持4 h。碳化所得样品用摩尔分数为1 M的NaOH-乙醇溶液去除硅模板,最终所得产物即为碳基介孔泡沫分子筛C-MCF。
2.4. 材料的测试与表征
材料的微观形貌特征由日本HITACHI S4800型扫描电子显微镜测试得出,加速电压为5 kV,硅基样品测试前进行了真空喷金处理。透射结果由美国FEI公司TECNAI G2 F20型透射电镜分析得到,其加速电压为200 kV,测量之前样品分散于酒精中超声振荡10 min,然后滴于铜网上自然干燥。氮气吸附的数据由美国Micromeritic GEMINI VII 2390型物理吸附仪在吸附温度为77 K时测得。其中孔径分布及孔容由Barrett-Joyner-Halenda (BJH)法计算得到。材料的胞体孔径及窗口直径分别由吸附支及脱附支得出。孔容在相对压力(p/p0)为0.99时由氮气吸附量计算得到。比表面积则采用Brunauer-Emmett-Teller (BET)法计算。所有的样品在测量之前均在200℃真空条件下脱气2 h。紫外光谱数据由日本日立公司的U-3010型紫外–可见分光光度计测得。
2.5. GOD葡萄糖氧化酶的吸附
根据之前的文献报道,当葡萄糖氧化酶溶液的pH值在其等电点5.0附近时,葡萄糖氧化酶分子表面几乎不带电荷,酶分子之间排斥力最小,有利于酶分子之间的紧密排列以获得最大吸附量。因此,我们选用pH = 5的Na2CO3-NaHCO3溶液作为本实验的缓冲溶液。具体实验过程如下:首先用电子天平称取16.0 mg葡萄糖氧化酶粉末,用8 ml的pH = 5.0的Na2CO3-NaHCO3缓冲溶液将其充分溶解,即可得到浓度为2.0 mg/ml的葡萄糖氧化酶溶液,之后分别称取MCFs、C-MCF各8.0 mg于10 ml的离心管中,各加入4 ml缓冲液超声5 min混合均匀。紧接着各取4 ml的葡萄糖氧化酶溶液于上述两种混合液的离心管中,此时所有的实验样品初始酶浓度为1.0 mg/ml,体积为8 ml。最后将所有实验样品转入恒温水浴摇床中,在温度为25℃,转速为150 r/min的条件下进行吸附。在不同的吸附时间点,取混合液于10,000 r/min 的离心机上离心10 min后取上层澄清液,用紫外分光光度计测定其280 nm处的吸光度值,固定化酶量则等于吸附前原酶溶液和吸附后上清液的浓度差,具体公式如2-1:
 (2-1)
(2-1)
其中,LGOD表示载酶百分比,V0 (mL)表示混合液总体积,C0 (mg/mL)表示GOD的最初浓度,C (mg/mL)表示上清液的浓度,M (g)表示载体质量。
3. 结果与讨论
3.1. 材料结果与表征
图1为二氧化硅泡沫分子MCFs和以其为硬模板碳化后所制备得到的介孔碳分子筛C-MCF的SEM和TEM图。从SEM图a和d中我们可以观察到,碳化前后分子筛呈现出均匀的颗粒分布,并且其外观形貌保持稳定,颗粒粒径都大约为2 μm,而从进一步放大的SEM图(b),(e)中我们可以看出,经过碳化后的C-MCF的3D孔道结构更加明显,这也更有利于其对酶等生物大分子的吸附。从TEM图片c和f中可见,以糠醇为碳源经过碳化后的C-MCF不仅维持了二氧化硅泡沫分子筛的外部形貌,同时也很好的复制出了泡沫分子筛典型的3-D蜂窝状介孔泡沫结构,并且大致可以看出碳化后的C-MCF的胞体孔径相比较之前的二氧化硅模板的胞体孔径有所下降。
图2为二氧化硅泡沫分子筛MCFs和以其为硬模板碳化后所制备得到的介孔碳分子筛C-MCF的氮气吸附–脱附等温曲线及其孔径分布曲线。从孔径分布曲线可以观察到,碳化后的C-MCF样品的吸附支和脱附支在3.9 nm附近处出现了明显的峰值,这说明经过碳化后的C-MCF材料除了拥有之前硬模板MCFs的“墨水瓶”结构以外,胞体周围还环绕着去除硅模板后留下的次级孔道,这些在胞体周围大量存在的小孔道使得酶在进行氧化还原催化时有利于增加所固定酶的催化效率,因为其为催化反应提供了一条能够有效降低传质阻力的“基底传输通道(substrate-transport channel)” [11] 。从图中我们可以发现,经过高温碳化的样品吸附支和脱附支的孔径分布集于在10 nm和20 nm,分别与其胞体孔径与窗口直径相对应,这样较大的胞体孔径和窗口直径非常有利于介孔碳泡沫分子筛对于生物大分子的吸附。
根据氮气吸附–脱附等温曲线计算得到硬模板MCFs和碳化后所得到的介孔碳泡沫分子筛C-MCF样品的胞体孔径、窗口孔径、孔容和比表面积(表1)。我们发现,经过高温碳化C-MCF的孔容相比于之前的硅基硬模板从1.66 cm3/g下降到了1.42 cm3/g,可见碳源糠醇的的引入将会占据之前硅模板孔道内部的一些空间而导致介孔材料孔容的减小。但是在孔容减小的同时,介孔碳泡沫分子筛的比表面积却由之前硅基材料的611.4 m2/g增大到了795.5 m2/g,这主要因为碳化后的介孔材料胞体周围还存在着去除硅模板后留下的次级孔道,这与之前孔径分布结果相一致。
3.2. 葡萄糖氧化酶的吸附性能
图3为将GOD溶液初始浓度固定在1 mg/mL时,pH值在4.0到6.0之间MCFs和C-MCF的葡萄糖
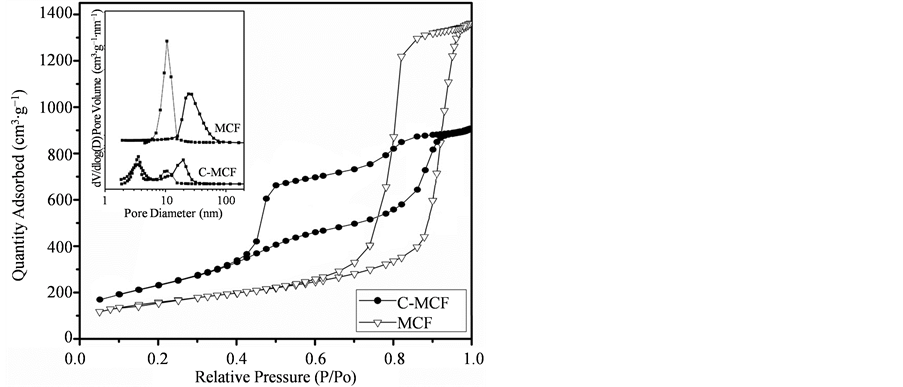
Figure 2. N2 adsorption/desorption isotherms and pore size distribution plots of MCFs and C-MCF
图2. MCFs和C-MCF的氮气吸附-脱附等温曲线和孔径分布曲线

Table 1. Surface area and pore -structure parameters of MCF and C-MCF
表1. MCF和C-MCF的比表面积和孔结构参数表
注:a表示该数据采用BJH模型计算得出,其中胞体孔径和窗口直径分别由吸附质和脱附支得出,用其峰值的横坐标表示;b表示该数据采用BET模型计算得出。
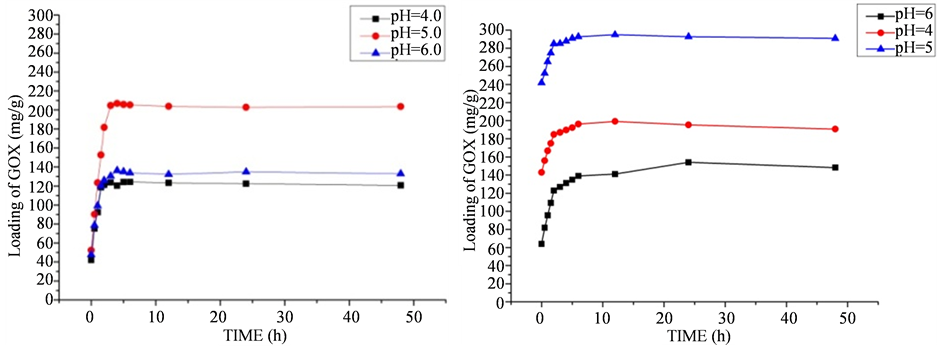
Figure 3. Immobilized amounts of GOD on C-MCF as a function of time with different pH
图3. 不同pH条件下,GOD在MCFs和C-MCF的固定量与时间关系图
氧化酶负载量与时间的关系曲线图。从图中我们可以直观地发现碳化后的介孔分子筛C-MCF的葡萄糖负载量有了很大的提高。从图中我们还可以得到对于MCFs模板来说,在吸附大约进行至4 h时,其对葡萄糖氧化酶的吸附达到平衡点,而对于C-MCF载体材料却在吸附开始后大约8个小时后才达到吸附平衡点,说明了相对于碳化前的硅基模板MCFs,C-MCF载体与葡萄糖氧化酶分子间有着更强的相互作用力,这可能是由于碳化过程使得C-MCF表面暴露出了很多具有较强静电引力的基团。缓冲溶液pH值对于介孔材料的载酶能力也有着巨大的影响,图中MCFs和C-MCF两者对葡萄糖氧化酶的吸附能力都随溶液pH值的不同有着很大的变化。当缓冲溶液的pH值为5.0时,MCFs和C-MCF对葡萄糖氧化酶的吸附能力都达到最大值,而当缓冲溶液的pH值低于或者高于5.0时,二者对于葡萄糖氧化酶的吸附能力都有着不同程度的下降。这是因为葡萄糖氧化酶的等电点接近于5.0 [6] [12] ,由酶分子等电点与溶液pH的关系我们知道,当GOD分子在pH值低于5.0的溶液中时带正点而在pH值高于5.0的溶液中时带负点,当溶液pH值恰好在5.0附近时则GOD分子表面几乎不带电。
由于MCFs和C-MCF均在GOD分子表面成电中性的情况下达到最大的吸附量,说明泡沫状介孔材料对于GOD的吸附主要是依靠二者之间的分子间力,因此对于外界溶液的pH值的变化并不敏感。另一方面,GOD分子之间的库仑作用力是随着pH值的增加先减小后增大,其最小值正好在GOD的等电点处获得,即在溶液pH值为5.0时GOD分子间的斥力最小,使得GOD分子的排列最紧密。吸附在介孔材料内部的GOD分子之间紧密堆积表现表现为介孔材料固定化酶量的增加;反之,当pH值高于或者低于等电点时,带正电或带负电的GOD分子之间的库仑斥力随这自身所带电量的增大而逐渐增大,GOD分子之间无法紧密排列,其平均间距增大,表现为介孔材料的固定化酶量的减少。
随后,我们比较了MCFs和C-MCF载体在不同初始浓度(1 mg~7.0 mg/mL)的GOD溶液中固定化酶量的变化以进一步研究GOD在硅基和碳基介孔材料样品上的吸附行为。通过之前的研究结果我们将测试的所有酶溶液的pH均固定为5.0,吸附等温线图如图4所示。从图中我们可以看出,随着GOD溶液浓度的增加,GOD的固定量也随之有着明显的增加,C-MCF对酶的吸附能力大大地强于MCFs,但二者都在酶溶液浓度为6.0 mg/mL时达到GOD固定量的最大值。当底物浓度继续增大时,固定化酶量不再随着GOD浓度增加而不断增加,这也和Lee等人 [11] 的研究结果相同,说明GOD的固定于介孔材料的机制是基于将酶束缚于样品的介孔孔道内部,而不是将酶吸附于载体的表面,由于当酶溶液浓度达到6.0 mg/mL时,GOD分子之间的距离已经足够接近,无法更紧密的堆积。
由于在实际使用过程中吸附上的酶可能会因为外界条件的变化而发生脱附,所以即使载体材料在最开始拥有对目标生物酶很强的吸附性能,但是如果其固酶稳定性不好容易发生脱附的话,也极大限制了其在实际的生活生产中的应用。因此,我们研究了GOD在MCFs和C-MCF上的脱附行为以比较硅基的介孔材料和碳基的介孔材料载体对GOD固定的稳定性:我们分别将10 mg的MCFs和C-MCF载体材料分散于3 ml pH为5.0、GOD浓度为6 mg/mL的缓冲溶液中,于室温20℃条件下在摇床中振荡(150 rpm) 12小时达到吸附平衡,得到其初始固定化酶量,最后将固定化GOD载体用缓冲液冲洗3次,测试其残余固定化酶量。结果如表2所示。碳化后的C-MCF相比之前的模板剂MCFs对酶有着更好的抗脱附作用,在经过同样的3次缓冲溶液的冲洗后,C-MCF上的葡萄糖氧化酶还有92.0%残留,而未经过碳化的MCFs上仅有86.3%的酶还存在。
通过研究我们发现残余固定化酶量则与球形孔室的储存空间和窗口的尺寸相关。C-MCF的球形孔室由10.1 nm的窗口相互连通,该窗口直径小于MCFs的窗口直径。一旦GOD分子进入其球形孔室,随着孔道内部的GOD分子越来越多,GOD分子会在其窗口处发生聚集甚至部分酶分子会堵住窗口。这时,窗口直径越小的介孔材料其孔道内部的GOD分子越难以离开孔道,因此孔室内部的酶分子也就难以发生脱附,C-MCF也就表现出更高的对于葡萄糖氧化酶的储存力。由此可以推断,GOD的固定化机制是基于将酶束缚于介孔材料孔道内部,而不是吸附于载体表面。结果表明,碳基介孔泡沫分子筛材料相比硅基介孔泡沫分子筛更有潜力成为一个良好的固定GOD的载体。
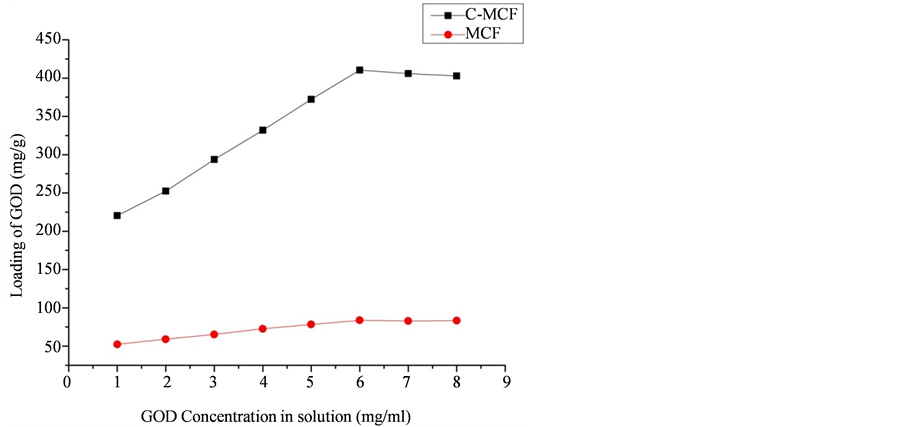
Figure 4. Adsorption isotherm of GOD in MCF and C-MCF at pH 5.0. The sample (10 mg) was incubated in GOD solution (3 mL) of specified concentration under shaking (at 150 rpm) at room temperature for 12 h
图4. 在pH为5.0时,GOD固定于MCF和C-MCF的等温吸附线图。样品(10 mg)分散于各指定浓度的GOD溶液(3 mL)中,于室温条件下振荡(150 rpm) 12小时

Table 2. Desorption of GOD on MCF and C-MCF at pH 5.0
表2. 当pH为5.0时,MCF和C-MCF上GOD的脱附行为
注:a所有载体都在6 mg/mL的GOD溶液中吸附12小时,b残余固定量于缓冲液彻底冲洗之后测定,c为残余固定化酶量与初试固定化酶量之比。
4. 结论
本文以糠醇为碳源,对二氧化硅泡沫分子筛进行碳化,制备出了介孔碳泡沫分子塞C-MCF。通过SEM、TEM和氮气吸附–脱附对碳化前后的介孔材料进行表征,发现经过碳化后的C-MCF很好地复制出MCFs的外部形貌和内部孔道特征。碳化后的介孔材料胞体孔径和窗口直径都有所减小,孔容也从1.66 cm3/g下降到了1.42 cm3/g,这是因为碳源的引入会占据之前孔道的一部分空间。然而,其比表面积却从611.4 m2/g增大到了795.5 m2/g,这主要胞体周围还存在着去除硅模板后留下的次级孔道。将碳化后的介孔材料C-MCF用于葡萄糖氧化酶的固定,其对葡萄糖氧化酶的负载能力要明显好于之前未经过碳化处理的MCFs,说明介孔碳材料与葡萄糖氧化酶分子之前有着更好的亲和力,加之介孔碳材料相对硅基材料还具有更高的化学稳定性、高水热电阻和优越的电导性。因此,C-MCF有望成为性能优异的固定酶载体材料,在生物催化,生物传感器和酶燃料电池等领域也将得到广泛应用。
*通讯作者。