1. 引言
为解决药物生物利用度低、药物代谢参数不理想等问题,化学家将药物活性成分进行合理修饰,设计成前药。随着对分子生物学、细胞生物学连同酶及转运体的深入认识,通过药物靶向修饰的方法改善药物的理化性质,在提高其生物利用度、优化药物代谢动力学参数的同时,可以更好的靶向到目标组织与器官、增强药效 [1] 。利用前药设计理念,根据人体不同生物环境,设计新型靶向药物载体,同样可达到降低药物不良反应、提高药效、组织靶向的目的 [2] 。
维生素C是人类常见的必需营养素之一,又名抗坏血酸(Ascorbic acid, AA)。维生素C在体内可同时作为氧化剂与抗氧化剂存在,在临床上应用广泛,如:坏血病、牙龈出血、肿瘤、动脉粥样硬化等疾病防治 [3] 。此外因其体内转运体数量丰富,分布广泛,还被设计应用于靶向药物及载体的设计中。本文主要对维生素C及其衍生物在药物修饰、载体靶向修饰中的应用进行概述,以期为合理设计靶向药物分子提供思路和方法。
2. 维生素C在体内的转运机制
维生素C有L-型和D-型两种异构体,仅L-型具有生理功能,其还原型(AA)和氧化型(脱氢抗坏血酸DHA)都具有生理活性。哺乳动物细胞摄取维生素C依靠两种不同的转运体蛋白:钠-维生素共转运蛋白(SVCTs)及葡萄糖转运蛋白(GLUTs)。其中SVCTs易与还原型维生素C(AA)结合,通过主动运输将其转运至细胞内;而GLUTs则易与氧化型维生素C(DHA)结合,通过易化扩散的方式进入细胞。
SVCTs表面糖蛋白,由两种基因编码,具有两种不同亚型SVCT1与SVCT2,虽然二者结构相似,但在组织分布与功能上却有明显的差异。SVCT1主要分布在肾脏、小肠、肝脏的上皮细胞,通过小肠吸收与肾小管重吸收方式摄取维生素C,维持机体内稳态与代谢平衡。SVCT2主要在内皮细胞上表达,如血小板、巨噬细胞、晶状体细胞等,主要分布在大脑、眼睛、骨骼肌等器官,保护代谢组织免受频繁氧化损伤 [4] [5] 。
GLUTs为细胞摄取葡萄糖所必须,目前已发现的葡萄糖转运体共有14种异构体,按其发现的先后顺序命名为GLUT1-GLUT12,GLUT14和HMIT1,它们的分布具有组织和细胞的特异性。GLUT1主要分布于红细胞及血脑屏障,对于维持血糖浓度的稳定和大脑供能起到关键作用;GLUT3则主要分布于神经元上,负责将脑组织细胞间液中的葡萄糖转运到神经元中。目前认为GLUT1和GLUT3是决定脑组织葡萄糖利用的关键转运体。研究发现GLUTs在大多数肿瘤细胞中高表达,这是因为癌细胞的生物合成速度和葡萄糖代谢反应加快,以满足其葡萄糖摄取和糖酵解代谢 [6] [7] [8] 。
还原型维生素C(AA)以及脱氢抗坏血酸(DHA)在体内转运吸收机制如图1。

Figure 1. Vitamin C transport and efflux across cell plasma membrane [5]
图1. 维生素C及脱氢抗坏血酸在体内的转运摄取途径 [5]
3. 维生素C在药物结构修饰中的应用
还原型维生素C对于目标药物靶向修饰,主要发生于其5,6位羟基取代,其结构类型总结如图2。
脑部疾病的治疗一直是医学史上的难题,主要是因为血脑屏障(图3)的存在使得药物进入中枢神经的含量较低,因此药物疗效降低。血脑屏障是血液与脑组织及脑脊液之间的通透性较低的膜性结构,主要有脑毛细血管内皮细胞、基膜和神经胶质细胞的足突组成,对维持中枢神经系统内环境的稳定和防止有害物质进入有非常重要的作用 [9] 。
中枢治疗药物按照其疗效主要分为:抗氧化、抗炎、腺苷受体拮抗剂、受体竞争性拮抗剂、代谢受体拮抗剂、γ-氨基丁酸受体(GABA受体)抑制剂、抗病毒七类。Manfredini S.选用具有代表性的药物:7-氯犬尿酸(受体竞争性拮抗剂)、哌啶甲酸(GABA受体抑制剂)、奎诺二甲基丙烯酸酯(抗氧化剂),利用维生素C及其衍生物(已对其2、3位进行苄基或苯甲酰基等取代)对上述药物进行前药修饰。通过体内药效试验发现,前药修饰后的药物具有通过血脑屏障的能力,从而起到对大鼠戊四唑惊厥的保护作用,进一步表明经维生素C衍生物修饰的前药可更好的透过血脑屏障,发挥药效 [11] 。
非甾体抗炎药包括布洛芬、酮洛芬、萘普生。以布洛芬为例,其作为中枢系统疾病治疗药物,可以降低患病风险,延缓发病,因此备受关注。但由于血脑屏障的存在,布洛芬透过能力较差,为达到治疗浓度药物,通常需要口服大剂量药物,这将造成严重的胃肠道不良反应及毒性,不可避免的对机体造成损伤,限制其在中枢疾病治疗领域的应用。Tang L等人对非甾体抗炎药进行前药修饰,合成其抗坏血酸酯,经修饰后的前药水溶性增加、生物利用度提高、血脑屏障透过率增加。可以用于脑病疾病的治疗,如:脑中风、大脑缺血性损伤、阿尔茨海默症等 [12] 。Zhao Y等人使用维生素C对布洛芬进行修饰,合成布洛芬前药,具有良好的透过血脑屏障能力,静脉注射给药后,在相同的给药剂量情况下,相较于游离药物,布洛芬在小鼠大脑中的浓度显著提高 [13] 。吴雪莹等人通过使用维生素C衍生物利用其5位羟基对布洛芬进行前药修饰,通过体内实验,进一步验证修饰后的前药具有更好的脑靶向效果,脑内布洛芬浓度得到显著提升 [14] 。李玲等人通过化学合成布洛芬-C6-O-抗坏血酸前药,使用MDCK-MDR1细胞单层模型模拟血脑屏障,经修饰过后的前药与原形药物相比具有良好的血脑屏障透过率。从小鼠体内分布实验来看,前药具有明显的脑靶向性 [15] 。修饰后的布洛芬前药在血脑屏障中的转运如图4。
Laras Y在实验室合成具有生物活性的伪肽物质thiazolamide衍生物,该伪肽可抑制γ-分泌酶(为阿尔茨海默症发病直接相关的人源γ分泌酶复合物)活性。进一步使用维生素C对伪肽衍生物进行前药修饰,对其进行血脑屏障透过能力测定,体内脑部摄取实验表明经修饰后前药可以更好的递送进大脑,大大改善药物代谢动力学曲线,同时维生素C本身对大脑具有一定的保护作用,可以对抗认知障碍,进而改善药效 [16] 。
沙奎那韦作为首个FDA批准的蛋白酶抑制剂药物,用于HIV治疗,疗效显著,但因其低水溶性、低渗透性、体内代谢快等缺陷,严重影响其临床使用。Shuanghui Luo等人通过合成沙奎那韦维生素C拼合物,借助维生素C靶向胃肠道上皮细胞的SVCT1转运体,用结肠腺癌细胞(Caco-2)与犬肾上皮细胞(MDCK-MDR1)建立肠道模型,进行药物转运实验。与沙奎那韦原形药物相比,沙奎那韦维生素C拼合物具有一系列优点:水溶性显著提高,使用浓度范围内无细胞毒性,沙奎那韦代谢稳定性提高,药物口服的吸收与生物利用度增强 [17] 。
Manfredini S等人通过研究进一步发现,经过6位溴取代修饰的维生素C(BrAA),与未经修饰的维生
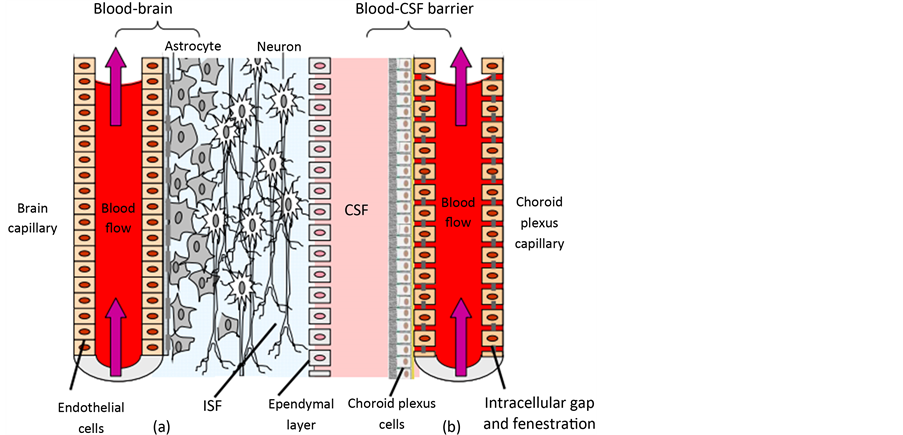 A:血脑屏障 B:血脑脊液屏障 C:ISF细胞间夜 D:脑脊髓液
A:血脑屏障 B:血脑脊液屏障 C:ISF细胞间夜 D:脑脊髓液
Figure 3. The two main barriers in the CNS: blood-brain barrier (a) and blood cerebrospinal fluid barrier (b) [10]
图3. 血脑屏障(a)与血–脑脊液屏障(b) [10]

Figure 4. Distribution, sequential metabolism and brain “lock-in” pathways of prodrug [11]
图4. 维生素C修饰布洛芬靶向前药在血脑屏障中的转运机制 [11]
素C(AA)相比,与SVCT2受体结合能力更强。中枢疾病治疗药物:哌啶类药物(主要用于抗癫痫的治疗)、喹啉类药物(可用于中枢神经退行性病变的治疗),二者本身透过血脑屏障能力较差,使用BrAA对其进行前药修饰,结果表明经过修饰后的前药,可以更好的与SVCT2受体结合,进入中枢,进而起到更好的治疗效果。同时,与经AA修饰的前药相比,经BrAA修饰的前药与SVCT2结合能力更强 [18] 。Dalpiaz A等人同样经试验验证,经过6位溴取代修饰的维生素C(BrAA),与未经修饰的维生素C(AA)相比,与人视网膜色素上皮细胞(HRPE)细胞上SVCT2受体具有更好的结合能力 [19] 。Corpe等人经过SVCT敲除小鼠验证,6-Br-6-脱氧抗坏血酸仅可以与SVCTs结合,无法通过GLUTs识别转运入细胞内 [20] 。
4. 维生素在药物载体靶向修饰中的应用
利用维生素C对纳米载体进行修饰,合成纳米载体6-Vc-PEG-PE,在神经胶质瘤细胞中的药物载体靶向性研究表明,经维生素C修饰的纳米载体具有良好的靶向性,维生素C是一种良好的靶向制剂,可以使负载药物更好的进入靶组织,同时维生素C修饰的纳米给药系统在治疗脑部疾病上具有很好的应用前景 [21] 。
邵坤等人使用经炔丙基修饰后的脱氢抗坏血酸DHA对聚合胶束(PEG-pLys-pPhe)表面结构进行修饰,合成pPhe-pLys-PEG-DHA (图5)。选用伊曲康唑作为模型药物。主要利用抗坏血酸盐可以通过细胞膜上葡萄糖转运蛋白转运进入细胞的特性,经修饰后的含药胶束与游离型药物给药相比脑实质中药物浓度显著提高,具有明显的脑靶向作用,同时可以有效提高药物在血液中的贮存时间 [21] 。
杨果通过合成DHAA-PEG-pLys-pPhe高分子材料,自组装形成载有阿霉素的胶束,利用脱氢抗坏血酸(DAHH)可以通过葡萄糖转运体GLUT转运进入细胞,利用GLUT1在肝癌细胞表面大量表达的特性,经过修饰的胶束可达到良好的肝癌细胞靶向作用,同时增强阿霉素对于癌细胞的杀伤作用 [22] 。
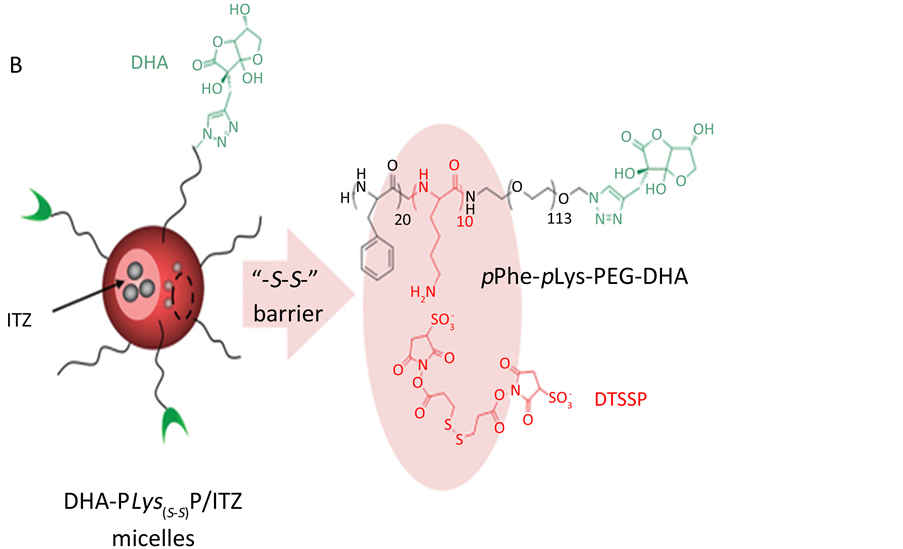
Figure 5. Illustration of DHA-PLys(s-s)P/ITZ micelles and the structure of “-S-S-” barriers [20]
图5. pPhe-pLys-PEG-DHA胶束结构 [20]
陈鹏利用维生素C的高水溶性,以及对SVCT2特异性选择作用合成以维生素C丙烯酸酯为单体的两亲性药物载体,该载体有望将包裹的小分子药物直接通过血脑屏障到达脑部,以治疗脑部疾病 [23] 。合成苄基保护-维生素C丙烯酸酯亲水片段、[(胆固醇迷-2-乙氧基)]丙烯酸酯丙烯酸酯为疏水片段的两亲性高分子材料。该材料生物相容性好、无毒、具有脑-靶向性,载药能力强 [24] 。但同时一些研究表明,经维生素C修饰过后的前药与载体材料却无明显的脑靶向效果。Kesinger等人使用维生素C对黄腐酚前药修饰,修饰后的前药性质不稳定,在室温下几小时后降解成褐色油状物。利用Caco-2细胞,模拟胃肠道吸收,进行前药转运进入细胞膜性能测定,结果表明前药分子无法透过Caco-2细胞膜,该前药不具有靶向进入细胞的能力,对提高药物生物利用度无明显作用 [25] 。王艳斋通过合成聚乳酸-嵌-聚维生素C丙烯酸酯(PLA-block-AAA)两亲性嵌段聚合物,该聚合物可自组装形成稳定的纳米溶液体系。在聚合物材料细胞靶向性实验研究中,PLA-bIock-PAAA材料未能表现出被脑胶质瘤C6细胞特异性摄取的性质,证明该材料不具有脑靶向性 [26] 。
5. 结论与展望
维生素C作为人体必需的营养成分,天然无毒,且具有良好的抗氧化、抗病毒、细胞内解毒等功能,临床上辅助用于多种类型的疾病治疗。维生素C转运体SVCTs与GLUTs体内含量丰富、组织分布广泛。选用维生素C对活性药物或药物载体进行靶向修饰,一定程度上可以大大降低经修饰化合物、载体的细胞毒性,并且靶向性良好,在治疗脑部疾病以及提高药物生物利用度方面具有广泛的应用前景。然而也有相关文献报导部分经修饰后的药物和材料不具有明显的靶向作用,这主要是因为经修饰后的药物稳定性较差,结构极易改变,修饰后的材料在中性条件以下,维生素C的结构会遭到破坏,结构的不稳定性造成靶向性的缺失。因此,药学工作者今后应加强维生素C修饰产物的稳定性研究,重点合成结构稳定的维生素C修饰前药及其药物载体,确保维生素C修饰产物在医药领域中的安全应用。