1. 引言
春剑,兰科兰属植物,主产于四川、云南、贵州等地区,深受兰友喜爱。叶艺是指叶片上出现银色或金色的斑块或条纹,其观赏和商品价值较高 [1] 。鉴于中国兰叶艺性状对其商品性的重要作用,研究其形成机理,对人工诱发叶艺具有重要意义。关于植物失绿、缺绿、黄化等突变体的叶绿体形态及超微结构,至今已对水稻 [2] [3] 、玉米 [4] 、油菜 [5] 、高粱 [6] 、小麦 [7] 等作物进行了研究。研究发现,有些突变体的叶绿体形态及数目与野生型没有明显差异,但其叶绿体结构发生明显改变,表现为内部结构简单,光合膜系统发育程度低,基粒数目少,基粒类囊体垛叠层数少,或未分化出基粒和基粒片层;而有些突变体,不仅叶绿体结构发育存在明显缺陷,且叶绿体数目减少,形状也发生改变。苏畅等对辐射诱变黄色素花虎头兰与黄蝉兰杂交后代F1杂交苗进行超微结构分析,结果显示经辐射诱变叶艺兰与未经辐射植株叶肉细胞结构存在差异 [8] 。蒋彧等用60Co-γ射线辐照处理中国兰春剑根状茎,发现分化苗失绿变淡 [9] 。但未见报道组培诱变获得的兰属春剑叶色新材料叶绿素含量及叶绿体超微结构的相关研究。
本研究在LCS-1无性繁殖系建立的基础上,对根状茎进行高激素水平、高糖浓度条件下的长时间固体培养,诱发出了颜色变黄的根状茎群,进而建立了变异的根状茎无性繁殖系,通过诱导,根状茎分化出了叶色变异试管苗LCS-2 [10] 。经过多年的继代培养,其叶艺性状可以稳定遗传。LCS-2属线缟及中透缟,其独特的魅力和艺术价值,自问世以来,一直是兰苑大家族的娇宠,具有较高的文化和经济价值,以此材料进行叶绿素含量及叶绿体超微结构研究,以期为揭示这一特异突变材料的叶色突变机理提供理论依据。
2. 材料与方法
2.1. 试材及取样
试验所用材料为LCS-1及LCS-2 (图1)。LCS-2是由LCS-1通过组织培养技术诱导获得的叶色新材料。培养基为MS + 6-BA 0.5 mg/L + NAA 0.2 mg/L + AC 0.3%。培养基pH 6.0。白天培养温度22℃~25℃、夜间培养温度18℃左右;光照周期14 h/d,光照强度2000 lx。接种180天后取材料进行指标测定。材料由四川省农业科学院园艺研究所提供。
 LCS-1 LCS-2
LCS-1 LCS-2
Figure 1. LCS-1 and LCS-2 with verge line pattern leaves
图1. 亲本LCS-1与组培诱变新材料LCS-2
2.2. 叶绿素和类胡萝卜素含量的测定
参照刘永军等 [11] 的方法,分别测定LCS-1和LCS-2根状茎与试管苗叶片的叶绿素和胡萝卜素的含量,并比较差异。试验3次重复。
2.3. 叶绿体超微结构
透射电镜制样时,先将去脉叶片切成2 mm × 2 mm 的小片,然后用2%的戊二醛进行前固定,在冰箱中过夜,漂洗后,再用1%的四氧化锇进行固定,再次漂洗,样品用浓度逐级递增的乙醇和丙酮脱水。按照Epo n812的配方配制包埋剂 [12] ,先作样品渗透,然后进行包埋和聚合。用超薄切片机切片,并经醋酸铀和柠檬酸铅液双染色,在JEM-1200EX型透射电镜下观察和拍照。
3. 结果与分析
3.1. 叶绿素含量和类胡萝卜素含量
从表1可以看出,LCS-1和LCS-2在根状茎和叶片的色素含量方面有较大的差别。从叶片色素含量和组成来看,LCS-2叶片的叶绿素a、叶绿素b、叶绿素a + b含量分别为LCS-1的16.71%、15.86%、16.49%,LCS-2根状茎的叶绿素a、叶绿素b、叶绿素a + b含量分别为LCS-1的3.54%、4.18%、3.77%。由此可见,叶绿素含量低下是LCS-2的显著特征之一。
从叶绿素a/b来看,LCS-2叶片和根状茎分别为对照的105.17%、85.47%。说明在LCS-2根状茎分化成苗的过程中,叶绿素b的含量增加,而叶绿素a的含量降低。此为LCS-2的另一特征。
从类胡萝卜素的含量看,LCS-2根状茎和叶片低于LCS-1,但类胡萝卜素/叶绿素指标显示LCS-2叶片和根状茎都相对较高,分别为LCS-1的125.95%和138.76%。由此可见,类胡萝卜素相对含量高是LCS-2的第3个特征。
3.2. 叶绿体超微结构
在透射电镜下观察LCS-1及LCS-2叶绿体的形态以及在细胞中的分布发现,LCS-2黄区与LCS-1有着明显的差别。在LCS-1叶片中,叶绿体呈纺锤形“八字”贴壁分布于叶肉细胞中,超微结构典型。叶绿体结构完整,基质浓厚,基粒片层沿叶绿体长轴排列。类囊体结构清晰。片层垛叠紧密整齐,基质中分布有数个体积较大的淀粉粒及分散的嗜锇滴。在LCS-2中,叶绿体仍沿细胞壁分布,但叶绿体形状变得不规则,整个叶绿体呈高密度的囊泡状结构,内部结构严重解体,体积较小的嗜锇滴聚集分布。基质内不存在类囊体结构,无基粒片层,无淀粉粒(图2)。
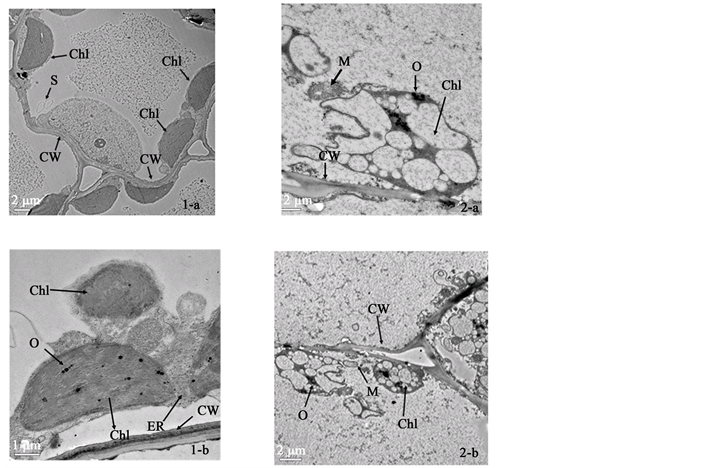
Figure 2. Electron micrograph of chloroplast ultra- structures of the mutant and the control. 1-a and 1-b: LCS-1 leaves; 2-a and 2-b: LCS-2 with verge line pattern. CW: cell wall, Chl: chloroplast, S: starch grain, M: mitochondria, O: plastoglobulus
图2. 叶绿体超微结构。1-a 和1-b:LCS-1叶绿体超微结构观察;2-a和2-b:LCS-2叶绿体超微结构观察,CW:细胞壁,Chl:叶绿体,S:淀粉粒,M:线粒体,O:质体小球(嗜锇滴)

Table 1. The content of chlorophyll and carotenoids in LCS-1 and LCS-2
表1. LCS-1与LCS-2叶绿素及类胡萝卜素含量
4. 讨论
叶绿素缺乏的突变体是植物界中发生频率比较高的一种突变类型,推测可能由多种原因导致。目前对于许多植物的叶绿素缺失突变体的研究比较多,结果却是不尽相同,而对兰科植物特别是对兰属植物的研究鲜有报道。有研究表明,叶绿素含量的变化与叶色表型变化是一致的,叶色黄化突变体的叶绿素含量明显低于对照,叶绿素含量增加的同时,叶片颜色也进一步加深 [13] 。由于叶绿体内膜系统被破坏,类胡萝卜素呈现,嗜锇颗粒也大量产生 [14] 。本试验中,LCS-2叶绿素减少,类胡萝卜素与叶绿素相对含量提高,是呈现叶艺的主要生理原因。
许多研究报道显示,条斑叶突变体基因参与了叶绿体发育的调控过程 [15] 。本研究发现LCS-2中,叶绿体仍沿细胞壁分布,但叶绿体形状变得不规则,整个叶绿体呈高密度的囊泡状结构,内部结构严重解体,体积较小的嗜锇滴聚集分布。基质内不存在类囊体结构,无基粒片层,无淀粉粒。从超微结构观察的结果可以得出质体变异是产生该突变的原因之一。叶色突变体质体没有基粒片层和类囊体的形成,前质体的发育在此被阻断,不能形成完整的叶绿体结构,叶绿素的合成受到阻碍。叶片因此缺乏叶绿素而表现叶艺性状。
基金项目
四川省应用基础研究(2017JY0287);四川省农业科学院青年基金专项;四川省科技支撑计划。
NOTES
*通讯作者。